1 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将 样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 |  已变质 已变质 |
| B | 往某溶液中先加稀硫酸酸化,再加氯化钡溶液,出现白色沉淀 | 溶液中含有 |
| C | 向某溶液中加入稀氢氧化钠溶液,用湿润的红色石蕊试纸靠近试管口,试纸未变蓝 | 不能证明溶液中是否含有 |
| D | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中,变浑浊 | 该溶液中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 某研究小组根据文献模拟利用氨浸法从某钢铁厂烟灰(主要成分为ZnO,并含有少量的CuO、Fe2O3等)中制备碱式碳酸锌,并测定其组成的流程如下:
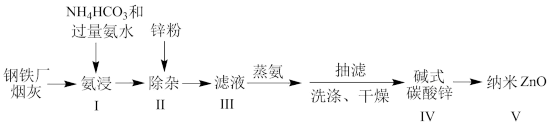
已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2 →Zn(NH3)
→Zn(NH3) +H2O
+H2O
Zn(NH3) →Zn2++4NH3
→Zn2++4NH3
Zn2++2OH-→Zn(OH)2↓
Zn2++ →ZnCO3↓
→ZnCO3↓
(1)“氨浸”时加入过量氨水的目的:
①使HCO 转化为
转化为 :
:
②_______ 。
(2)下列说法不正确的是_______。
(3)I、该研究小组利用步骤V对碱式碳酸锌[Zn3(OH)m(CO3)n(其中m。n为整数)]组成进行测定,从下列选项中选出合理的操作并排序:坩埚预处理后将样品放入坩埚中称量,再置于高温炉中加热→_______→_______→_______→_______→_______。_______
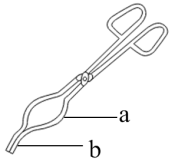
①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
①根据数据计算该碱式碳酸锌的化学式_______ 。
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式_______ 。

已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2
 →Zn(NH3)
→Zn(NH3) +H2O
+H2OZn(NH3)
 →Zn2++4NH3
→Zn2++4NH3Zn2++2OH-→Zn(OH)2↓
Zn2++
 →ZnCO3↓
→ZnCO3↓(1)“氨浸”时加入过量氨水的目的:
①使HCO
 转化为
转化为 :
:②
(2)下列说法不正确的是_______。
| A.步骤I可以采用加热方式来加快浸出速率,提高浸出量 |
| B.步骤II过滤得到的滤渣中含有Cu、Fe、Zn |
| C.步骤III蒸氨过程产生气体除了氨气还有CO2,冷凝后得到的碳化氨水循环用于氨浸 |
| D.步骤IV洗涤时可先用浓氨水洗涤,减少固体溶解,再用无水乙醇洗涤 |

①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
| 电子天平视数/g | |
| 空坩埚 | 19.2500 |
| 空坩埚+样品 | 25.7100 |
| 第一次灼烧后称量 | 24.3251 |
| 第二次灼烧后称量 | 24.1414 |
| 第三次灼烧后称量 | 24.1101 |
| 第四次灼烧后称量 | 24.1100 |
| 第五次灼烧后称量 | 24.1099 |
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式
您最近一年使用:0次
2021-09-17更新
|
709次组卷
|
4卷引用:解密13 实验化学(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密13 实验化学(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题2021年湖北高考化学试题变式题11-192020年全国卷Ⅰ理综化学高考真题变式题
解题方法
3 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成___________ 色,说明生成了Ca(OH)2,写出该反应的化学方程式___________ ;较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,是因为___________ ,
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。你是否认同上述方案,理由是___________ ;
实验探究二:测定久置过氧化钙纯度
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
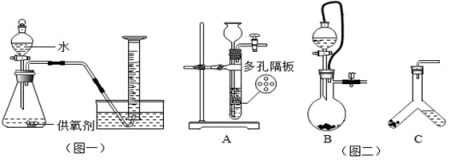
(3)取一定质量的供氧剂溶于水,按照图一装置进行装配。充分反应后,待量筒中液面不再变化,读出体积时,需使___________ ;
(4)为保证测量的准确性,收集气体的时机是导管口___________ (填序号):
a.还没有气泡产生时 b.连续均匀冒出气泡时 c.冒出气泡很多时
(5)用此装置测得的含量会偏大,原因是___________ ,为了避免此误差可将发生装置换成图二中的装置___________ (填序号);
方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图三

(6)滴加的Na2CO3溶液要过量的原因是___________ ;
(7)检验沉淀已经洗涤干净的方法是:取最后一次洗涤液,滴加___________ (填化学式)溶液,若无明显现象,则表示已经洗净。
(8)若供氧剂的质量m=5g,碳酸钙质量n=5g,请通过计算得出供氧剂中的过氧化钙的含量___________ %。
(9)若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将___________ (填“偏大”、“偏小”或“无影响”)。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。你是否认同上述方案,理由是
实验探究二:测定久置过氧化钙纯度
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。

(3)取一定质量的供氧剂溶于水,按照图一装置进行装配。充分反应后,待量筒中液面不再变化,读出体积时,需使
(4)为保证测量的准确性,收集气体的时机是导管口
a.还没有气泡产生时 b.连续均匀冒出气泡时 c.冒出气泡很多时
(5)用此装置测得的含量会偏大,原因是
方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图三

(6)滴加的Na2CO3溶液要过量的原因是
(7)检验沉淀已经洗涤干净的方法是:取最后一次洗涤液,滴加
(8)若供氧剂的质量m=5g,碳酸钙质量n=5g,请通过计算得出供氧剂中的过氧化钙的含量
(9)若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将
您最近一年使用:0次
名校
4 . 天空课堂第二课中航天员展示了金属锆(40Zr)在无容器实验柜中从液体变成固体时的“再辉”现象。以锆英石(主要成分是ZrSiO4,还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产锆的流程如图所示:
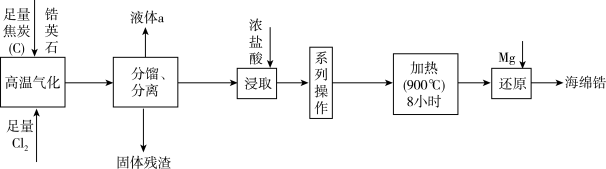
已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是_______ 。
(2)分馏过程中,为防止产品变质,过程中一定需要注意的是_______ 。液体a的电子式是_______ 。
(3)实验室中洗涤ZrOCl2·8H2O沉淀操作是_______ 。
(4)“还原”中氧化剂是_______ (填化学式)。
(5)由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。
第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用_______
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3) Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是
Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是_______ 。
③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是_______ 。
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是_______ 。

已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是
(2)分馏过程中,为防止产品变质,过程中一定需要注意的是
(3)实验室中洗涤ZrOCl2·8H2O沉淀操作是
(4)“还原”中氧化剂是
(5)由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。
第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3)
 Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是
Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是
您最近一年使用:0次
5 . SO2和焦亚硫酸钠(Na2S2O5)可用作食品添加剂。回答下列问题:
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为_______ 。欲净化与收集SO2,选择必要装置,按气流方向连接顺序为_______ (填仪器接口的字母编号)。
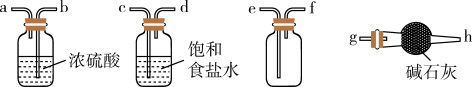
(2)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
已知:2NaHSO3 Na2S2O5+H2O。
Na2S2O5+H2O。
试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(3)某小组利用下列装置测定空气中SO2的含量。
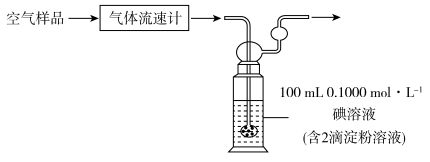
已知该反应的化学方程式为:SO2+I2+2H2O=H2SO4+2HI。若空气流速为a m3·min-1,当观察到_______ 时,结束计时,测定耗时t min。假定样品中的SO2可被溶液充分吸收,该空气样品中SO2的含量是_______ mg·m-3。
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为

(2)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
已知:2NaHSO3
 Na2S2O5+H2O。
Na2S2O5+H2O。试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | / |
| II | 取实验I的溶液, | 样品已氧化变质 | |
| III | 另取实验I的溶液, | 样品未完全氧化变质 |

已知该反应的化学方程式为:SO2+I2+2H2O=H2SO4+2HI。若空气流速为a m3·min-1,当观察到
您最近一年使用:0次
2022-04-22更新
|
1288次组卷
|
5卷引用:广东省广州市2022届高三下学期二模综合测试化学试题
广东省广州市2022届高三下学期二模综合测试化学试题(已下线)化学-2022年高考押题预测卷01(天津卷)(已下线)押广东卷化学第17题 化学实验综合题-备战2022年高考化学临考题号押题(广东卷)(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)超重点10 高考必考元素——氧、硫
解题方法
6 . 下列实验能达到预期目的的是
| 实验内容 | 实验目的 | |
| A | 向1mL 0.1mol•L-1NaOH溶液中加入2mL 0.1mol•L-1CuSO4溶液,振荡后滴加0.5mL葡萄糖溶液,加热后未出现红色沉淀 | 证明葡萄糖中不含醛基 |
| B | 向1mL 0.2mol•L-1AgNO3溶液中滴入2滴0.1mol•L-1KCl溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1KI溶液,又生成黄色沉淀 | 证明在相同温度下,Ksp(AgCl)>Ksp(AgI) |
| C | 室温下,用pH试纸测定同浓度的Na2CO3与NaClO的pH,比较二者pH的大小 | 证明碳元素的非金属性弱于氯 |
| D | 将FeCl2样品溶于盐酸,滴加KSCN溶液,溶液变红色 | 证明FeCl2样品已变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . “绿色化学”是化工生产中的重要理念。下图为利用尿素工厂废气以及磷肥工厂废渣(液)联合生产硫酸铵的工艺流程。
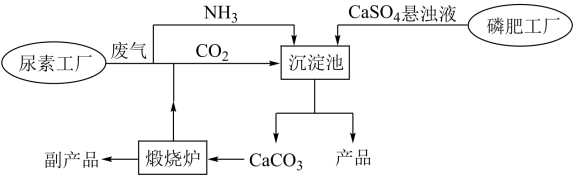
完成下列填空:
(1)沉淀池中发生反应的化学方程式为___________ 。已知硫酸铵溶解度变化趋势与氯化钠相似,则从沉淀池中获得产品的操作包含___________ 、___________ 、洗涤、烘干等。
(2)流程中体现“绿色化学”理念的设计有___________ 、___________ 等。
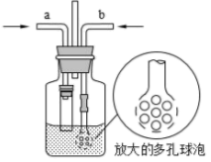
(3)为在实验室模拟沉淀池中的反应,设计了如图所示的装置,导管a下端连接粗管的目的是___________ ;导管b下端使用多孔球泡的目的是___________ 。
可用甲醛法测定所得 样品中氮的质量分数。其反应原理可以表示为:
样品中氮的质量分数。其反应原理可以表示为:
 [已知:
[已知: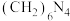 不与NaOH反应]
不与NaOH反应]
实验过程:称取样品1.500g,溶解配制成250mL溶液,取25.00mL样品溶液于锥形瓶中,加入过量的甲醛溶液,摇匀、静置5min后,加入1~2滴甲基橙试液,用NaOH标准溶液滴定至终点。
(4)终点的判断依据是___________ 。
(5)已知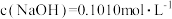 ,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为
,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为___________ 。(保留4位小数),实验测得硫酸铵样品中氮的质量分数略高,原因可能是___________ 。
a.甲醛被氧化 b.没有进行平行实验
c.氢氧化钠溶液久置变质 d.锥形瓶没有用待测液润洗

完成下列填空:
(1)沉淀池中发生反应的化学方程式为
(2)流程中体现“绿色化学”理念的设计有
(3)为在实验室模拟沉淀池中的反应,设计了如图所示的装置,导管a下端连接粗管的目的是

可用甲醛法测定所得
 样品中氮的质量分数。其反应原理可以表示为:
样品中氮的质量分数。其反应原理可以表示为: [已知:
[已知: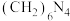 不与NaOH反应]
不与NaOH反应]实验过程:称取样品1.500g,溶解配制成250mL溶液,取25.00mL样品溶液于锥形瓶中,加入过量的甲醛溶液,摇匀、静置5min后,加入1~2滴甲基橙试液,用NaOH标准溶液滴定至终点。
(4)终点的判断依据是
(5)已知
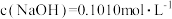 ,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为
,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为a.甲醛被氧化 b.没有进行平行实验
c.氢氧化钠溶液久置变质 d.锥形瓶没有用待测液润洗
您最近一年使用:0次
2021-04-20更新
|
349次组卷
|
4卷引用:上海市宝山区行知中学-2021-2022学年高三下学期3月月考化学试题
上海市宝山区行知中学-2021-2022学年高三下学期3月月考化学试题(已下线)化学-2022年高考押题预测卷02(上海卷)(含考试版、全解全析、参考答案、答题卡)上海市浦东新区2021届高三二模化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)
名校
8 . 下列实验操作、现象和所得到的结论均正确的是
| 选项 | 实验内容 | 实验结论 |
| A | 将Fe(NO3)2样品溶于稀HNO3溶液中,加入KSCN溶液,显红色 | Fe(NO3)2已经氧化变质 |
| B | 用pH试纸测定同浓度的NaCl和NaF溶液的pH,pH(NaCl)<pH(NaF) | 结合H+能力:Cl-<F- |
| C | 取1mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI和FeCl3反应有一定限度 |
| D | 向2支盛有5mL不同浓度NaHSO3溶液的试管中,同时加入2mL5%H2O2溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-02-23更新
|
218次组卷
|
3卷引用:浙江省宁波市奉化区2021-2022学年高二上学期期末联考化学试题
名校
9 . 下列方案设计、现象和结论有不正确 的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验硫酸厂周边空气中是否含有二氧化硫 | 用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,观察溶液颜色变化 | 若溶液不变色,说明空气中不含二氧化硫 |
| B | 探究Na2SO3固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 | 若有白色沉淀产生,则样品已变质 |
| C | 探究钠在氧气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入2mL蒸馏水 | 若无气体生成,则固体粉末为Na2O;若有气体生成,则固体粉末为Na2O2 |
| D | 检验某样品中是否含Cl- | 取少量样品加稀硝酸酸化,再加硝酸银溶液,振荡,观察溶液变化 | 若出现白色沉淀,则说明有Cl- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
10 . 乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是常用的补铁剂易溶于水,吸收效果比无机铁好。乳酸亚铁可由乳酸与FeCO3反应制得。制备乳酸亚铁晶体和定量测量
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70℃下搅拌使反应充分进行,一段时间后,经过分离提纯操作,从所得溶液中得到乳酸亚铁晶体。现需要设计实验检测产品在制备过程是否因氧化而发生变质,可选用的试剂_______ 。
(2)用碘量法测定晶体样品中铁元素的含量并计算样品的纯度。称取3.00g晶体样品,在足量空气中灼烧成灰,加足量稀硫酸溶解,将所有可溶物配成l00mL溶液。取25.00mL该溶液加入过量的KI反应,加入几滴_______ (试剂名称)作指示剂,用0.l0mol/L的硫代硫酸钠溶液滴定(I2+2S2O =S4O
=S4O +2I-),重复实验3次,滴定终点时平均消耗硫代硫酸钠25.00mL,则样品纯度为
+2I-),重复实验3次,滴定终点时平均消耗硫代硫酸钠25.00mL,则样品纯度为_______ 。
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70℃下搅拌使反应充分进行,一段时间后,经过分离提纯操作,从所得溶液中得到乳酸亚铁晶体。现需要设计实验检测产品在制备过程是否因氧化而发生变质,可选用的试剂
(2)用碘量法测定晶体样品中铁元素的含量并计算样品的纯度。称取3.00g晶体样品,在足量空气中灼烧成灰,加足量稀硫酸溶解,将所有可溶物配成l00mL溶液。取25.00mL该溶液加入过量的KI反应,加入几滴
 =S4O
=S4O +2I-),重复实验3次,滴定终点时平均消耗硫代硫酸钠25.00mL,则样品纯度为
+2I-),重复实验3次,滴定终点时平均消耗硫代硫酸钠25.00mL,则样品纯度为
您最近一年使用:0次



