1 . 在潜水艇和消防员的呼吸面具中,常用 粉末作为氧气的来源。已知每人每小时消耗的
粉末作为氧气的来源。已知每人每小时消耗的 在标准状况下的体积约为
在标准状况下的体积约为 。请计算:
。请计算:
(1)每人每小时消耗 的物质的量约为
的物质的量约为_______  ;
;
(2)假设所需的氧气全部由 来提供,则每位消防员工作1小时所消耗
来提供,则每位消防员工作1小时所消耗 的质量为
的质量为_______  ;
;
(3)取久置呼吸面具中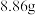 粉末溶于水(杂质为
粉末溶于水(杂质为 ),加入
),加入 盐酸完全反应至溶液呈中性,共消耗
盐酸完全反应至溶液呈中性,共消耗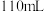 盐酸,则该呼吸面具中的
盐酸,则该呼吸面具中的 的质量分数为
的质量分数为_______ 。
 粉末作为氧气的来源。已知每人每小时消耗的
粉末作为氧气的来源。已知每人每小时消耗的 在标准状况下的体积约为
在标准状况下的体积约为 。请计算:
。请计算:(1)每人每小时消耗
 的物质的量约为
的物质的量约为 ;
;(2)假设所需的氧气全部由
 来提供,则每位消防员工作1小时所消耗
来提供,则每位消防员工作1小时所消耗 的质量为
的质量为 ;
;(3)取久置呼吸面具中
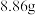 粉末溶于水(杂质为
粉末溶于水(杂质为 ),加入
),加入 盐酸完全反应至溶液呈中性,共消耗
盐酸完全反应至溶液呈中性,共消耗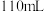 盐酸,则该呼吸面具中的
盐酸,则该呼吸面具中的 的质量分数为
的质量分数为
您最近一年使用:0次
2 . 设NA为阿伏加德罗常数的值。下列说法正确的是
A.1L0.1mol•L-1NH4ClO4溶液中NH 、ClO 、ClO 的数目都小于0.1NA 的数目都小于0.1NA |
| B.100g质量分数为46%的乙醇溶液中,含O-H键的数目为NA |
| C.常温下,1LpH=13的Ba(OH)2溶液中,含OH-的数目为0.2NA |
| D.浓硝酸与铜反应得到NO2和N2O4共23g,则铜失去的电子数0.5NA |
您最近一年使用:0次
名校
解题方法
3 . 氧钒(IV)碱式碳酸铵化学式为(NH4)5[(VO)6(CO3)4(OH)9]•10H2O,它是制备热敏材料VO2的原料,已知VO2+在酸性条件下易被氧化,氧钒(IV)碱式碳酸铵的制备流程如图:
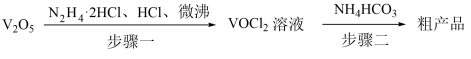
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能_______ ;生成VOCl2的同时,还生成一种无色无污染的气体,该反应的化学方程式为_______ 。
(2)步骤二可在如图装置中进行。

①接口的连接顺序为a→_______ 。
②实验开始时,先关闭K2,打开K1,当_______ 时(写实验现象),再关闭K1,打开K2,充分反应,静置,得到固体。
(3)测定产品纯度
称取mg样品用稀硫酸溶解后,加入50.0mL0.02mol•L-1KMnO4溶液,VO2+转化成VO ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
①滴定至反应终点的现象为_______ ;
②样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为_______ %;
③下列情况会导致产品纯度偏大的是_______ (填标号)。
A.Na2SO3溶液部分变质
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
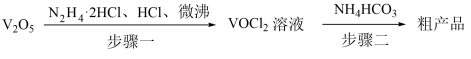
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能
(2)步骤二可在如图装置中进行。

①接口的连接顺序为a→
②实验开始时,先关闭K2,打开K1,当
(3)测定产品纯度
称取mg样品用稀硫酸溶解后,加入50.0mL0.02mol•L-1KMnO4溶液,VO2+转化成VO
 ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。①滴定至反应终点的现象为
②样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为
③下列情况会导致产品纯度偏大的是
A.Na2SO3溶液部分变质
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
您最近一年使用:0次
2023-06-18更新
|
375次组卷
|
3卷引用:T15-实验探究题
解题方法
4 . 工业上以铬铁矿(FeCr2O4质量分数为a%,含Al2O3、SiO2等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程图如图,回答下列问题:
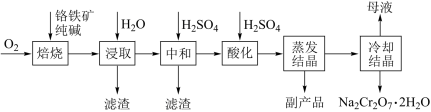
(1)焙烧的目的是将FeCr2O4转化为Na2CrO4,写出转化过程中生成可溶性含铝组分的化学方程式:______ 。
(2)下列有关说法不正确 的是______ 。
(3)蒸发结晶,盛放样品的容器名称是_______ 。
(4)酸化的目的是(结合离子方程式说明)______ 。
(5)利用氧化还原滴定法测定Na2Cr2O7•2H2O产品的纯度,从下列选项中选择合适的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器,“(_______)”内填写一种操作 ,均用字母表示]。用______ (称量产品2.50g)→在烧杯中__________ →用容量瓶__________ →用移液管(取25.00mL所配溶液于锥形瓶中)→加入足量碘化钠溶液→加入3滴淀粉指示剂→用______ (用0.1200mol•L-1Na2S2O3标准溶液滴定)→_________ 并且 内不恢复原来的颜色,消耗标准溶液40.00mL
内不恢复原来的颜色,消耗标准溶液40.00mL
仪器:a.碱式滴定管;b.酸式滴定管;c.电子天平;d.托盘天平;
操作:e.加硫酸溶解;f.加盐酸溶解;g.配制250mL溶液;h.观察到溶液蓝色褪去:i.观察到溶液变成蓝色
(6)若以铬铁矿为原料制备mkg硼化铬(CrB),在工艺流程中Cr损失b%,则至少需要铬铁矿的质量为______ kg(用含字母的计算式表示)。

(1)焙烧的目的是将FeCr2O4转化为Na2CrO4,写出转化过程中生成可溶性含铝组分的化学方程式:
(2)下列有关说法
| A.蒸发结晶时如果长时间蒸发,有利于提高Na2Cr2O7•2H2O的产率 |
| B.除了Na2Cr2O7外,在上述工艺流程中可循环利用的物质还有H2SO4 |
| C.含铁元素的化合物可在中和过程中被除去 |
| D.焙烧时气流与矿料逆流而行,其目的是增大反应物接触面积,提高反应速率 |
(4)酸化的目的是(结合离子方程式说明)
(5)利用氧化还原滴定法测定Na2Cr2O7•2H2O产品的纯度,从下列选项中选择合适的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器,“(_______)”内填写
 内不恢复原来的颜色,消耗标准溶液40.00mL
内不恢复原来的颜色,消耗标准溶液40.00mL仪器:a.碱式滴定管;b.酸式滴定管;c.电子天平;d.托盘天平;
操作:e.加硫酸溶解;f.加盐酸溶解;g.配制250mL溶液;h.观察到溶液蓝色褪去:i.观察到溶液变成蓝色
(6)若以铬铁矿为原料制备mkg硼化铬(CrB),在工艺流程中Cr损失b%,则至少需要铬铁矿的质量为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
5 . 三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)简称“三盐”,不溶于水及有机溶剂。主要适用于不透明的聚氯乙烯硬质管、注射成型制品,也可用于人造革等软质制品。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示
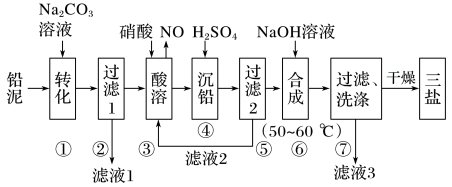
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13
请回答下列问题:
(1)写出步骤①“转化”的离子方程式:_______ 。
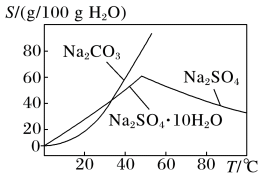
(2)根据下图溶解度曲线,由滤液1得到Na2SO4固体的操作为:将“滤液1”_______ 、_______ 、用乙醇洗涤后干燥。
(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是_______ (任意写出一条)。
(4)“滤液2”中可循环利用的溶质为_______ (填化学式)。若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO )=
)=_______ mol·L-1。
(5)步骤⑥“合成”三盐的化学方程式为_______ 。
(6)若消耗100.0 t铅泥,最终得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有75%转化为三盐,则铅泥中铅元素的质量分数为_______ 。

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13
请回答下列问题:
(1)写出步骤①“转化”的离子方程式:
(2)根据下图溶解度曲线,由滤液1得到Na2SO4固体的操作为:将“滤液1”

(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是
(4)“滤液2”中可循环利用的溶质为
 )=
)=(5)步骤⑥“合成”三盐的化学方程式为
(6)若消耗100.0 t铅泥,最终得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有75%转化为三盐,则铅泥中铅元素的质量分数为
您最近一年使用:0次
解题方法
6 . 设 为阿伏加德罗常数的值,下列叙述错误的是
为阿伏加德罗常数的值,下列叙述错误的是
 为阿伏加德罗常数的值,下列叙述错误的是
为阿伏加德罗常数的值,下列叙述错误的是A.向1L0.1  溶液中滴加 溶液中滴加 溶液至中性,所得溶液中 溶液至中性,所得溶液中 的数目小于0.1 的数目小于0.1 |
B.10g质量分数为92%的乙醇溶液与足量金属钠充分反应,产生 的分子数为0.1 的分子数为0.1 |
C.常温常压下,46g 中的分子数目小于 中的分子数目小于 |
D.1  晶体所含离子总数为2 晶体所含离子总数为2 |
您最近一年使用:0次
7 . 为了检验某含有 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将 样品加热,其质量变为
样品加热,其质量变为 ,请列式计算该样品中
,请列式计算该样品中 的质量分数
的质量分数_______ 。
 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将 样品加热,其质量变为
样品加热,其质量变为 ,请列式计算该样品中
,请列式计算该样品中 的质量分数
的质量分数
您最近一年使用:0次
2023高三·全国·专题练习
8 . 银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
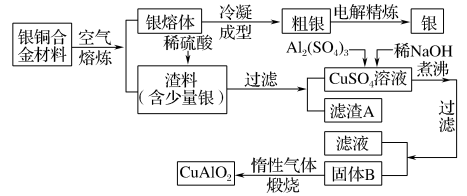
注: 和
和 开始分解的温度分别为
开始分解的温度分别为 和
和 。
。
若银铜合金中铜(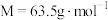 )的质量分数为63.5%,理论上
)的质量分数为63.5%,理论上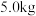 废料中的铜可完全转化为
废料中的铜可完全转化为_______ 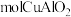 ,至少需要
,至少需要 的
的 溶液
溶液_______ L。

注:
 和
和 开始分解的温度分别为
开始分解的温度分别为 和
和 。
。若银铜合金中铜(
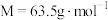 )的质量分数为63.5%,理论上
)的质量分数为63.5%,理论上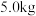 废料中的铜可完全转化为
废料中的铜可完全转化为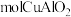 ,至少需要
,至少需要 的
的 溶液
溶液
您最近一年使用:0次
2023高三·全国·专题练习
9 . 将SO2通入用硫酸酸化的重铬酸钾溶液中,可制得硫酸铬钾KCr(SO4)2,反应的化学方程式为_______ ;如果溶液的酸碱性控制不当,可能会有Cr(OH)SO4杂质生成。现从得到的硫酸铬钾产品中取出3.160g样品加入足量盐酸和BaCl2溶液后,得到白色沉淀5.126g。若产品中杂质只有Cr(OH)SO4,则该产品中KCr(SO4)2的质量分数为_______ (用百分数表示,保留1位小数)。[摩尔质量/g·mol-1:KCr(SO4)2283;Cr(OH)SO4165]
您最近一年使用:0次
名校
10 . 2022年9月9日,国家航天局、国家原子能机构联合在北京发布“嫦娥五号”最新科学成果:中国科学家首次在月球上发现新矿物,并命名为“嫦娥石”。“嫦娥石”是一种新的磷酸盐矿物,属于陨磷钠镁钙石族。设NA为阿伏加德罗常数的值,下列说法正确的是
| A.27.5gPCl3中含有P—Cl键的数目为6NA |
| B.23gNa与足量H2O反应生成的H2分子数目为NA |
| C.100g质量分数为49%的H3PO4溶液中,含有的氧原子总数为2NA |
| D.在25℃时,1L pH=12的Ca(OH)2溶液中含有OH-数目约为0.01NA |
您最近一年使用:0次
2023-02-22更新
|
651次组卷
|
9卷引用:专题卷04 阿伏加德罗常数及其应用-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
(已下线)专题卷04 阿伏加德罗常数及其应用-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)考点06 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省部分学校2022-2023学年高三上学期11月联考化学试题山西省部分学校2022-2023学年高三上学期联考化学试题河南省创新发展联盟2022-2023学年高三上学期11月联考化学试题黑龙江省绥化市第九中学2022-2023学年高三上学期第三次月考化学试题河北省2022-2023学年高三上学期11月联考化学试题江西省宜春市第一中学2022-2023学年高二上学期期末考试化学试题河北省张家口市张北县2022-2023学年高三上学期11月月考化学试题



