22-23高一下·北京海淀·开学考试
名校
解题方法
1 . 工业上,处理低品位黄铜矿[二硫化亚铁铜(CuFeS2)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(FeSO4∙7H2O)和胆矾(CuSO4∙5H2O)。相关流程如下图。
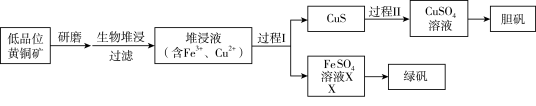
已知:①溶液中的c(H+)越大,pH越小,酸性越强。
②生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
③溶液中pH很小时,金属通常以离子形式存在,随着pH增大,有些离子会形成氢氧化物沉淀(即使pH<7也可沉淀),不同离子形成沉淀时的pH如下表所示。
(1)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段是在T。f细菌作用下,将黄铜矿溶解,第二阶段为Fe2+继续被氧化转变成Fe3+。
①补全第一阶段反应的离子方程式(反应物已配平):_______ 。CuFeS2+4H++O2 =_______。
=_______。
②写出第二阶段反应的离子方程式:_______ 。
(2)结合已知推断:生物堆浸过程中,应控制溶液的pH在_______ 范围内。
(3)已知:CuS是一种难溶于水的黑色固体。过程II中,用H2O2和稀硫酸处理后,CuS完全溶解 ,用离子方程式表示H2O2的作用是_______ 。
(4)绿矾的纯度可通过其与KMnO4反应测定。取mg绿矾晶体,加适量稀硫酸溶解,与物质的量浓度为cmol/L的KMnO4溶液恰好反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的计算式为_______ 。(已知:FeSO4·7H2O摩尔质量为278g/mol)

已知:①溶液中的c(H+)越大,pH越小,酸性越强。
②生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
③溶液中pH很小时,金属通常以离子形式存在,随着pH增大,有些离子会形成氢氧化物沉淀(即使pH<7也可沉淀),不同离子形成沉淀时的pH如下表所示。
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
①补全第一阶段反应的离子方程式(反应物已配平):
 =_______。
=_______。②写出第二阶段反应的离子方程式:
(2)结合已知推断:生物堆浸过程中,应控制溶液的pH在
(3)已知:CuS是一种难溶于水的黑色固体。过程II中,用H2O2和稀硫酸处理后,CuS
(4)绿矾的纯度可通过其与KMnO4反应测定。取mg绿矾晶体,加适量稀硫酸溶解,与物质的量浓度为cmol/L的KMnO4溶液恰好反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的计算式为
您最近一年使用:0次
2023·山东菏泽·一模
2 . 碳酸锰( )用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为
)用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 ,过程如下(部分操作和条件略)。已知:
,过程如下(部分操作和条件略)。已知: 不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;
不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;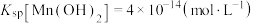 。回答下列问题:
。回答下列问题:
(1)制备 溶液:m g软锰矿粉经除杂后制得
溶液:m g软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如下图所示(夹持和加热装置略)。
溶液,实验装置如下图所示(夹持和加热装置略)。
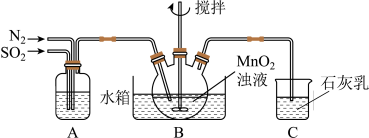
通过装置A可观察通入 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是_______ ;为使 尽可能转化完全,在停止实验前应进行的操作是
尽可能转化完全,在停止实验前应进行的操作是_______ ; 转化为
转化为 的离子方程式为
的离子方程式为_______ 。实验中若将 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是_______ 。
(2)制备 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到
溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到 固体。若用同浓度的
固体。若用同浓度的 溶液代替
溶液代替 溶液,将导致制得的
溶液,将导致制得的 产品中混有
产品中混有_______ (填化学式);用乙醇洗涤的目的是_______ 。
(3)测定软锰矿中锰元素的含量:向产品中加入稍过量的磷酸和硝酸,加热使 完全转化为
完全转化为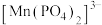 (其中
(其中 完全转化为
完全转化为 ),除去多余的硝酸,加入稍过量的硫酸铵除去
),除去多余的硝酸,加入稍过量的硫酸铵除去 ,加入稀硫酸酸化,再用
,加入稀硫酸酸化,再用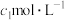 硫酸亚铁铵标准溶液滴定,发生反应
硫酸亚铁铵标准溶液滴定,发生反应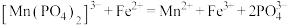 ,消耗标准液的体积平均为
,消耗标准液的体积平均为 mL;用
mL;用 mL
mL 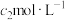 酸性
酸性 溶液恰好除去过量的
溶液恰好除去过量的 。软锰矿中锰元素的质量分数为
。软锰矿中锰元素的质量分数为_______ (用m,c,V的式子表示);用硫酸亚铁铵标准溶液滴定时,下列操作会使锰元素的质量分数偏大的是_______ (填标号)。
A.滴定管水洗后直接装入标准液 B.滴定终点时俯视滴定管读数
C.滴定管在滴定前有气泡,滴定后无气泡 D.锥形瓶未干燥即盛放待测液
 )用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为
)用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 ,过程如下(部分操作和条件略)。已知:
,过程如下(部分操作和条件略)。已知: 不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;
不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;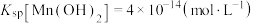 。回答下列问题:
。回答下列问题:(1)制备
 溶液:m g软锰矿粉经除杂后制得
溶液:m g软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如下图所示(夹持和加热装置略)。
溶液,实验装置如下图所示(夹持和加热装置略)。
通过装置A可观察通入
 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是 尽可能转化完全,在停止实验前应进行的操作是
尽可能转化完全,在停止实验前应进行的操作是 转化为
转化为 的离子方程式为
的离子方程式为 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是(2)制备
 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到
溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到 固体。若用同浓度的
固体。若用同浓度的 溶液代替
溶液代替 溶液,将导致制得的
溶液,将导致制得的 产品中混有
产品中混有(3)测定软锰矿中锰元素的含量:向产品中加入稍过量的磷酸和硝酸,加热使
 完全转化为
完全转化为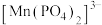 (其中
(其中 完全转化为
完全转化为 ),除去多余的硝酸,加入稍过量的硫酸铵除去
),除去多余的硝酸,加入稍过量的硫酸铵除去 ,加入稀硫酸酸化,再用
,加入稀硫酸酸化,再用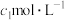 硫酸亚铁铵标准溶液滴定,发生反应
硫酸亚铁铵标准溶液滴定,发生反应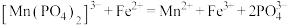 ,消耗标准液的体积平均为
,消耗标准液的体积平均为 mL;用
mL;用 mL
mL 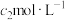 酸性
酸性 溶液恰好除去过量的
溶液恰好除去过量的 。软锰矿中锰元素的质量分数为
。软锰矿中锰元素的质量分数为A.滴定管水洗后直接装入标准液 B.滴定终点时俯视滴定管读数
C.滴定管在滴定前有气泡,滴定后无气泡 D.锥形瓶未干燥即盛放待测液
您最近一年使用:0次
2023高三·全国·专题练习
3 . 某实验小组以 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
步骤2,产品中 的含量测定
的含量测定
①称取产品 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的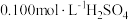 溶液,
溶液,
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为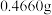 。
。
产品中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:步骤2,产品中
 的含量测定
的含量测定①称取产品
 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的
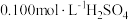 溶液,
溶液,③沉淀完全后,
 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为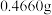 。
。产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
4 . 若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2.样品中CuSO4·5H2O的质量分数为_______ (列出算式可能用到的化学式量:CuSO4 160、CuSO4·5H2O 250、Cu(NO3)2·3H2O 242、BaSO4 233)。
您最近一年使用:0次
5 . 高锰酸钾溶液常用于物质的定性检验与定量分析。
Ⅰ.实验室欲用 固体来配制
固体来配制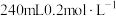 的
的 溶液。
溶液。
(1)计算所需 固体的质量为
固体的质量为_______ g。
(2)配制溶液时,必须用到的玻璃仪器有烧杯、玻璃棒、量筒、_______ 、_______ 。
(3)写出配制溶液时的正确操作顺序:_______ (填标号,每个操作只能用一次)。
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)配制过程中,下列操作导致溶液浓度偏小的是_______(填标号)。
Ⅱ.为了增强高锰酸钾溶液的氧化性,需要加入 的稀硫酸。现用其测定某补血剂片中
的稀硫酸。现用其测定某补血剂片中 (Ⅱ)的含量:称取
(Ⅱ)的含量:称取 含
含 的补血剂片,充分研磨后溶于水,配成
的补血剂片,充分研磨后溶于水,配成 溶液,取
溶液,取 该溶液与配制的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液
该溶液与配制的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液 。上述过程发生反应的化学方程式为
。上述过程发生反应的化学方程式为 。
。
(5)该补血剂片中 的质量分数为
的质量分数为_______ (用含a的代数式表示)。
Ⅰ.实验室欲用
 固体来配制
固体来配制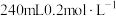 的
的 溶液。
溶液。(1)计算所需
 固体的质量为
固体的质量为(2)配制溶液时,必须用到的玻璃仪器有烧杯、玻璃棒、量筒、
(3)写出配制溶液时的正确操作顺序:
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)配制过程中,下列操作导致溶液浓度偏小的是_______(填标号)。
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.为了增强高锰酸钾溶液的氧化性,需要加入
 的稀硫酸。现用其测定某补血剂片中
的稀硫酸。现用其测定某补血剂片中 (Ⅱ)的含量:称取
(Ⅱ)的含量:称取 含
含 的补血剂片,充分研磨后溶于水,配成
的补血剂片,充分研磨后溶于水,配成 溶液,取
溶液,取 该溶液与配制的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液
该溶液与配制的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液 。上述过程发生反应的化学方程式为
。上述过程发生反应的化学方程式为 。
。(5)该补血剂片中
 的质量分数为
的质量分数为
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
6 . 完成下列问题
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值_______ (列出计算过程)。
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=_______ 。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=
您最近一年使用:0次
22-23高三上·安徽蚌埠·阶段练习
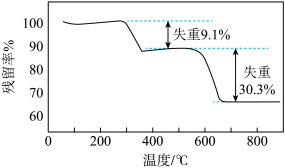
7 . 采用热重分析法测定FeS2/C复合材料中各组分的含量。FeS2/C样品在空气中的热重曲线如图所示。[注:残留率(%)=剩余固体质量 样品质量
样品质量 100%],下列说法中不正确的是
100%],下列说法中不正确的是
 样品质量
样品质量 100%],下列说法中不正确的是
100%],下列说法中不正确的是
A.300~400℃之间发生的主要反应为C+O2 CO2 CO2 |
| B.800℃时残留的固体是Fe3O4 |
| C.复合材料中FeS2的质量分数为90.9% |
| D.复合材料中FeS2与C的物质的量之比约为1∶1 |
您最近一年使用:0次
22-23高三下·湖南长沙·阶段练习
名校
8 . 明矾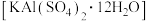 可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。
可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。
Ⅰ.制备明矾
实验步骤如图:
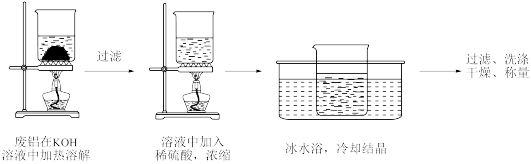
(1)溶解步骤中主要发生的离子反应方程式为_______ 。
(2)用蒸馏水洗涤晶体的操作过程是_______ 。
(3)生活中明矾可用作净水剂,结合离子方程式说明净水原理:_______ 。
Ⅱ.样品中硫酸根的测定
(一)绘制标准硫酸钡悬浊液吸光光谱图
①分别量取0、1.0、2.0、3.0、4.0mL浓度为500μg/mL的标准硫酸钾溶液移入10mL的比色管中,然后分别加入5mL浓度为1g/mL的 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。
②用分光光度计测量标准系列(波长采用420nm),数据如下(忽略混合过程中的体积变化)。
③绘制硫酸钡悬浊液的吸光光谱图,绘制如下。
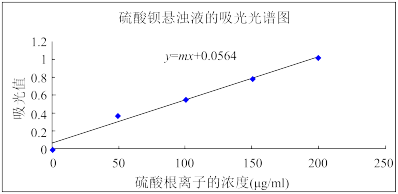
(4)上述实验数据中b=_______ ,m=_______ (保留1位有效数字)。
(二)测定样品中硫酸根浓度
①称取1.018g样品晶体配制成250mL的样品溶液。
②量取1.0mL样品溶液移入10mL的比色管中,然后加入5mL浓度为1g/mL的 溶液,用蒸馏水定容,测得样品的吸光值为0.858。
溶液,用蒸馏水定容,测得样品的吸光值为0.858。
(5)测得样品中硫酸根的质量分数为_______ %(保留2位有效数字)。
(6)实验测得硫酸根的含量小于理论值,可能的原因有_______(填标号)。
 可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。
可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。Ⅰ.制备明矾
实验步骤如图:

(1)溶解步骤中主要发生的离子反应方程式为
(2)用蒸馏水洗涤晶体的操作过程是
(3)生活中明矾可用作净水剂,结合离子方程式说明净水原理:
Ⅱ.样品中硫酸根的测定
(一)绘制标准硫酸钡悬浊液吸光光谱图
①分别量取0、1.0、2.0、3.0、4.0mL浓度为500μg/mL的标准硫酸钾溶液移入10mL的比色管中,然后分别加入5mL浓度为1g/mL的
 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。②用分光光度计测量标准系列(波长采用420nm),数据如下(忽略混合过程中的体积变化)。
 (mL) (mL) | 1.0 | 2.0 | 3.0 | 4.0 | |
| 蒸馏水体积(mL) | 5 | a | b | c | 1 |
 浓度(μg/mL) 浓度(μg/mL) | 0 | 50 | 100 | 150 | 200 |
| 吸光值A | 0 | 0.371 | 0.553 | 0.778 | 1.013 |

(4)上述实验数据中b=
(二)测定样品中硫酸根浓度
①称取1.018g样品晶体配制成250mL的样品溶液。
②量取1.0mL样品溶液移入10mL的比色管中,然后加入5mL浓度为1g/mL的
 溶液,用蒸馏水定容,测得样品的吸光值为0.858。
溶液,用蒸馏水定容,测得样品的吸光值为0.858。(5)测得样品中硫酸根的质量分数为
(6)实验测得硫酸根的含量小于理论值,可能的原因有_______(填标号)。
A.实验Ⅰ制得样品中有 杂质 杂质 | B.实验中所用标准硫酸钾溶液浓度偏大 |
| C.样品溶液配制过程中,定容仰视读数 | D.样品溶液配制过程中,容量瓶未润洗 |
您最近一年使用:0次
2022·江苏南京·模拟预测
名校
解题方法
9 . 四水醋酸锰[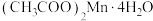 ]用于染色催化剂和分析试剂等。
]用于染色催化剂和分析试剂等。
(1)以四水醋酸锰为电解液,控制适当电压电解,降低温度后减压抽滤,用乙酸洗涤干燥,制得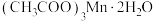 。将
。将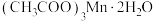 在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
①第一阶段释放出2种等物质的量的物质,它们的分子式分别为_______ 。
②剩余物B的化学式为_______ 。
(2)用四水醋酸锰和乙酰氯(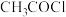 )为原料制备无水二氯化锰流程如下:
)为原料制备无水二氯化锰流程如下:
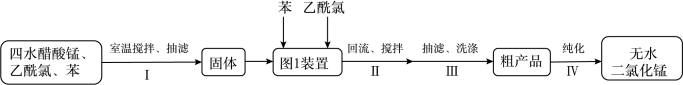
已知:a无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸、不溶于苯。
b.制备无水二氯化锰的主要反应: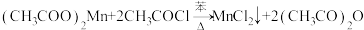
c.乙酰氯遇水发生反应: 。
。
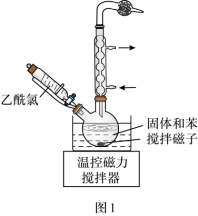
请回答:
①步骤Ⅰ所获固体主要成分是_______ (用化学式表示)。
②步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,加热回流的目的是_______ 。
③测定无水 的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 ,使
,使 氧化为
氧化为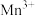 。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[
。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[ ]滴定
]滴定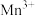 ,滴定过程中发生的反应为:
,滴定过程中发生的反应为: ,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是
,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是_______ 。样品中 的质量分数多少(写出计算过程)。
的质量分数多少(写出计算过程)。_______
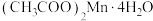 ]用于染色催化剂和分析试剂等。
]用于染色催化剂和分析试剂等。(1)以四水醋酸锰为电解液,控制适当电压电解,降低温度后减压抽滤,用乙酸洗涤干燥,制得
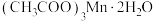 。将
。将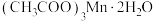 在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。| 阶段 | 热效应 | 剩余物 | 失重 |
| Ⅰ | 吸热 | A | 29.1% |
| Ⅱ | 放热 | B | 70.5% |
②剩余物B的化学式为
(2)用四水醋酸锰和乙酰氯(
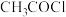 )为原料制备无水二氯化锰流程如下:
)为原料制备无水二氯化锰流程如下:
已知:a无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸、不溶于苯。
b.制备无水二氯化锰的主要反应:
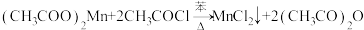
c.乙酰氯遇水发生反应:
 。
。
请回答:
①步骤Ⅰ所获固体主要成分是
②步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,加热回流的目的是
③测定无水
 的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 ,使
,使 氧化为
氧化为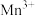 。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[
。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[ ]滴定
]滴定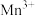 ,滴定过程中发生的反应为:
,滴定过程中发生的反应为: ,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是
,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是 的质量分数多少(写出计算过程)。
的质量分数多少(写出计算过程)。
您最近一年使用:0次
2022高三·全国·专题练习
10 . 碳酸钠产品中 含量测定:
含量测定:
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸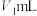 ;
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸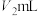 ;
;
④平行测定三次,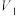 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
开始分解。
(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
(1)产品中 的质量分数为
的质量分数为___________ (保留三位有效数字);
(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果___________ (填“偏大”“偏小”或“无影响”)。
 含量测定:
含量测定:①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用
 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸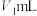 ;
;③在上述锥形瓶中再加入2滴指示剂N,继续用
 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸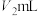 ;
;④平行测定三次,
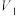 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。已知:(i)当温度超过35℃时,
 开始分解。
开始分解。(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
 | 11.9 | 15.8 | 21.0 | 27.0 | |||
 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
 的质量分数为
的质量分数为(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则
 质量分数的计算结果
质量分数的计算结果
您最近一年使用:0次



