23-24高三上·河南南阳·阶段练习
1 . 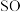 2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
(1)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开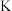 1和
1和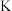 2,缓缓通入
2,缓缓通入 2,加热。实验后反应管A中残留的固体为红色粉末
2,加热。实验后反应管A中残留的固体为红色粉末
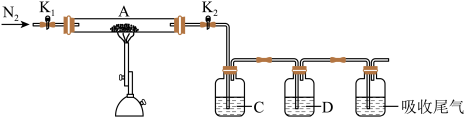
①装置C的溶液为_______ (填标号)。装置D可观察到的实验现象为_______ 。
a.品红 b.NaOH c.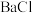 2 d.
2 d. e.浓硫酸
e.浓硫酸
②写出硫酸亚铁高温分解的化学方程式_______ 。
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性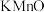 4溶液恰好褪色,停止实验。
4溶液恰好褪色,停止实验。
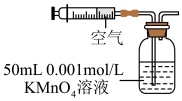
①二氧化硫和酸性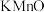 4溶液反应的离子方程式为
4溶液反应的离子方程式为_______ 。
②该空气中二氧化硫的体积分数为_______ (用含Ⅴ的代数式表示)。
(3)某化工厂用如图所示工艺流程除去燃煤产生的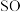 2。
2。

①过程I发生的反应中,氧化剂与还原剂的物质的量之比为_______ 。
②过程Ⅱ发生反应的化学方程式为_______ 。
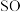 2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:(1)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开
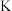 1和
1和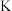 2,缓缓通入
2,缓缓通入 2,加热。实验后反应管A中残留的固体为红色粉末
2,加热。实验后反应管A中残留的固体为红色粉末
①装置C的溶液为
a.品红 b.NaOH c.
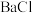 2 d.
2 d. e.浓硫酸
e.浓硫酸②写出硫酸亚铁高温分解的化学方程式
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性
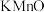 4溶液恰好褪色,停止实验。
4溶液恰好褪色,停止实验。
①二氧化硫和酸性
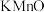 4溶液反应的离子方程式为
4溶液反应的离子方程式为②该空气中二氧化硫的体积分数为
(3)某化工厂用如图所示工艺流程除去燃煤产生的
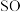 2。
2。
①过程I发生的反应中,氧化剂与还原剂的物质的量之比为
②过程Ⅱ发生反应的化学方程式为
您最近一年使用:0次
2023·重庆·二模
2 . 硫氰化钾(KSCN)的用途非常广泛,如用KSCN溶液检验 。实验室可用如下装置制取KSCN。
。实验室可用如下装置制取KSCN。
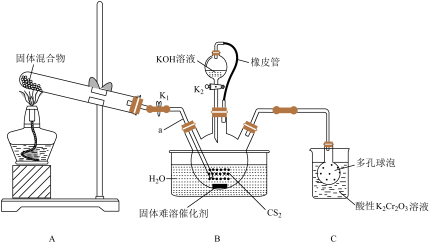
请回答下列问题:
(1)橡皮管的作用是_______ 。
(2)A装置是氨气发生装置,试管中的固体混合物为_______ (填化学式)。
(3)导管a插入 中的目的是
中的目的是_______ 。
(4)水浴加热B装置,三颈烧瓶中的反应除了生成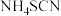 外,还生成了另一种酸式盐,其反应方程式为
外,还生成了另一种酸式盐,其反应方程式为_______ 。
(5)当三颈烧瓶中的液体不出现分层时,熄灭酒精灯,关闭 ,继续水浴加热(保持100℃),待酸式盐完全分解(保持100℃),再打开
,继续水浴加热(保持100℃),待酸式盐完全分解(保持100℃),再打开 ,继续水浴加热,就可以得到KSCN溶液。若要制取KSCN晶体,需进行的操作是:先将三颈烧瓶中的混合物进行
,继续水浴加热,就可以得到KSCN溶液。若要制取KSCN晶体,需进行的操作是:先将三颈烧瓶中的混合物进行_______ 、再将滤液蒸发浓缩、冷却结晶、过滤、_______ 、干燥。
(6)装置C中酸性 溶液的作用是
溶液的作用是_______ ;若三颈烧瓶中挥发出来的含硫物质恰好与200mL 2.0mol/L的 溶液反应,其中50%的硫元素转化为+6价硫,其余都转化为零价硫,理论上可制得KSCN质量为
溶液反应,其中50%的硫元素转化为+6价硫,其余都转化为零价硫,理论上可制得KSCN质量为_______ g。
 。实验室可用如下装置制取KSCN。
。实验室可用如下装置制取KSCN。
请回答下列问题:
(1)橡皮管的作用是
(2)A装置是氨气发生装置,试管中的固体混合物为
(3)导管a插入
 中的目的是
中的目的是(4)水浴加热B装置,三颈烧瓶中的反应除了生成
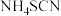 外,还生成了另一种酸式盐,其反应方程式为
外,还生成了另一种酸式盐,其反应方程式为(5)当三颈烧瓶中的液体不出现分层时,熄灭酒精灯,关闭
 ,继续水浴加热(保持100℃),待酸式盐完全分解(保持100℃),再打开
,继续水浴加热(保持100℃),待酸式盐完全分解(保持100℃),再打开 ,继续水浴加热,就可以得到KSCN溶液。若要制取KSCN晶体,需进行的操作是:先将三颈烧瓶中的混合物进行
,继续水浴加热,就可以得到KSCN溶液。若要制取KSCN晶体,需进行的操作是:先将三颈烧瓶中的混合物进行(6)装置C中酸性
 溶液的作用是
溶液的作用是 溶液反应,其中50%的硫元素转化为+6价硫,其余都转化为零价硫,理论上可制得KSCN质量为
溶液反应,其中50%的硫元素转化为+6价硫,其余都转化为零价硫,理论上可制得KSCN质量为
您最近一年使用:0次
2023·山东菏泽·一模
3 . 碳酸锰( )用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为
)用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 ,过程如下(部分操作和条件略)。已知:
,过程如下(部分操作和条件略)。已知: 不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;
不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化; 。回答下列问题:
。回答下列问题:
(1)制备 溶液:m g软锰矿粉经除杂后制得
溶液:m g软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如下图所示(夹持和加热装置略)。
溶液,实验装置如下图所示(夹持和加热装置略)。
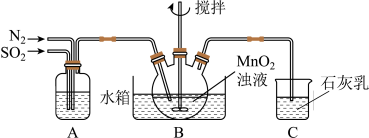
通过装置A可观察通入 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是_______ ;为使 尽可能转化完全,在停止实验前应进行的操作是
尽可能转化完全,在停止实验前应进行的操作是_______ ; 转化为
转化为 的离子方程式为
的离子方程式为_______ 。实验中若将 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是_______ 。
(2)制备 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到
溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到 固体。若用同浓度的
固体。若用同浓度的 溶液代替
溶液代替 溶液,将导致制得的
溶液,将导致制得的 产品中混有
产品中混有_______ (填化学式);用乙醇洗涤的目的是_______ 。
(3)测定软锰矿中锰元素的含量:向产品中加入稍过量的磷酸和硝酸,加热使 完全转化为
完全转化为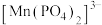 (其中
(其中 完全转化为
完全转化为 ),除去多余的硝酸,加入稍过量的硫酸铵除去
),除去多余的硝酸,加入稍过量的硫酸铵除去 ,加入稀硫酸酸化,再用
,加入稀硫酸酸化,再用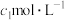 硫酸亚铁铵标准溶液滴定,发生反应
硫酸亚铁铵标准溶液滴定,发生反应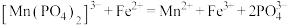 ,消耗标准液的体积平均为
,消耗标准液的体积平均为 mL;用
mL;用 mL
mL 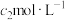 酸性
酸性 溶液恰好除去过量的
溶液恰好除去过量的 。软锰矿中锰元素的质量分数为
。软锰矿中锰元素的质量分数为_______ (用m,c,V的式子表示);用硫酸亚铁铵标准溶液滴定时,下列操作会使锰元素的质量分数偏大的是_______ (填标号)。
A.滴定管水洗后直接装入标准液 B.滴定终点时俯视滴定管读数
C.滴定管在滴定前有气泡,滴定后无气泡 D.锥形瓶未干燥即盛放待测液
 )用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为
)用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 ,过程如下(部分操作和条件略)。已知:
,过程如下(部分操作和条件略)。已知: 不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;
不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;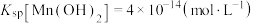 。回答下列问题:
。回答下列问题:(1)制备
 溶液:m g软锰矿粉经除杂后制得
溶液:m g软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如下图所示(夹持和加热装置略)。
溶液,实验装置如下图所示(夹持和加热装置略)。
通过装置A可观察通入
 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是 尽可能转化完全,在停止实验前应进行的操作是
尽可能转化完全,在停止实验前应进行的操作是 转化为
转化为 的离子方程式为
的离子方程式为 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是(2)制备
 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到
溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到 固体。若用同浓度的
固体。若用同浓度的 溶液代替
溶液代替 溶液,将导致制得的
溶液,将导致制得的 产品中混有
产品中混有(3)测定软锰矿中锰元素的含量:向产品中加入稍过量的磷酸和硝酸,加热使
 完全转化为
完全转化为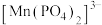 (其中
(其中 完全转化为
完全转化为 ),除去多余的硝酸,加入稍过量的硫酸铵除去
),除去多余的硝酸,加入稍过量的硫酸铵除去 ,加入稀硫酸酸化,再用
,加入稀硫酸酸化,再用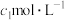 硫酸亚铁铵标准溶液滴定,发生反应
硫酸亚铁铵标准溶液滴定,发生反应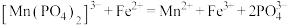 ,消耗标准液的体积平均为
,消耗标准液的体积平均为 mL;用
mL;用 mL
mL 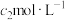 酸性
酸性 溶液恰好除去过量的
溶液恰好除去过量的 。软锰矿中锰元素的质量分数为
。软锰矿中锰元素的质量分数为A.滴定管水洗后直接装入标准液 B.滴定终点时俯视滴定管读数
C.滴定管在滴定前有气泡,滴定后无气泡 D.锥形瓶未干燥即盛放待测液
您最近一年使用:0次
23-24高三上·湖北恩施·阶段练习
4 . W、X、Y、Z为元素周期表中前四周期的元素,原子序数依次增大。W的一种核素无中子,X的最外层电子数是次外层的3倍,Y的原子M层有2对成对电子,Z的合金是用量最大、用途最广的合金。将ZY2在空气中氧化,测得氧化过程中剩余固体的质量与起始ZY2的质量的比值随温度变化的曲线如图所示。下列叙述正确
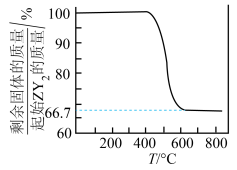

| A.W2X2为非极性分子 |
| B.W2Y2X8分子中X均为-2价 |
| C.ZY2是工业制备W2YX4的原料 |
| D.800℃时,ZY2氧化成含有两种元素的固体产物为Z3X4 |
您最近一年使用:0次
2023-01-12更新
|
325次组卷
|
3卷引用:专题卷09 根据原子结构和物质结构特点叙述型元素推断-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
(已下线)专题卷09 根据原子结构和物质结构特点叙述型元素推断-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)湖北省部分重点中学2023届高三上学期第二次联考化学试题湖北省恩施土家族苗族自治州2022-2023学年高三上学期期末考试化学试题
2023·海南海口·三模
名校
解题方法
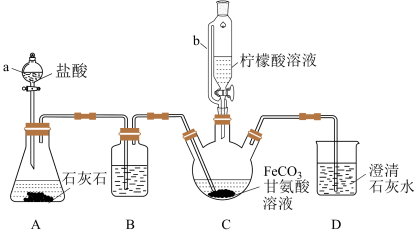
5 . 甘氨酸亚铁[(H2NCH2COO)2Fe]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
已知:①反应原理为2H2NCH2COOH+FeCO3 (H2NCH2COO)2Fe+CO2↑+H2O。
(H2NCH2COO)2Fe+CO2↑+H2O。
②甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:I.装置C中盛有过量的FeCO3和200mL 1.0 mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌;然后向三颈烧瓶中滴加柠檬酸溶液。
II.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)装置B中的试剂为_______ 。
(2)装置A制备CO2的用途是_______ 。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为_______ 。
(4)过程I加入柠檬酸溶液促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,pH过高导致产率下降的原因是_______ 。
②柠檬酸溶液除了起酸性作用外,还有的作用是_______ 。
(5)过程II中加入无水乙醇的目的是_______ 。
(6)本实验制得15.3 g甘氨酸亚铁(Mr=204g/mol),则其产率是_______ %。

已知:①反应原理为2H2NCH2COOH+FeCO3
 (H2NCH2COO)2Fe+CO2↑+H2O。
(H2NCH2COO)2Fe+CO2↑+H2O。②甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:I.装置C中盛有过量的FeCO3和200mL 1.0 mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌;然后向三颈烧瓶中滴加柠檬酸溶液。
II.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)装置B中的试剂为
(2)装置A制备CO2的用途是
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为
(4)过程I加入柠檬酸溶液促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,pH过高导致产率下降的原因是
②柠檬酸溶液除了起酸性作用外,还有的作用是
(5)过程II中加入无水乙醇的目的是
(6)本实验制得15.3 g甘氨酸亚铁(Mr=204g/mol),则其产率是
您最近一年使用:0次
2022·山东·模拟预测
名校
6 . 铁和铝都是用途广泛的金属,同温、同压下,将 铁与足量稀硫酸反应,生成
铁与足量稀硫酸反应,生成 体积为
体积为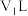 ;将
;将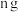 铝与足量浓氢氧化钠溶液反应,生成
铝与足量浓氢氧化钠溶液反应,生成 体积为
体积为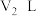 。下列说法正确的是
。下列说法正确的是
 铁与足量稀硫酸反应,生成
铁与足量稀硫酸反应,生成 体积为
体积为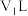 ;将
;将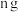 铝与足量浓氢氧化钠溶液反应,生成
铝与足量浓氢氧化钠溶液反应,生成 体积为
体积为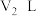 。下列说法正确的是
。下列说法正确的是A.两反应生成 的物质的量之比为 的物质的量之比为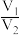 |
B. 铁与足量稀硫酸反应,生成 铁与足量稀硫酸反应,生成 的物质的量一定为 的物质的量一定为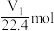 |
C.保持温度压强不变,将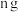 铝与足量稀硫酸反应,生成 铝与足量稀硫酸反应,生成 体积大于 体积大于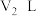 |
D.参加反应的铁与铝的质量比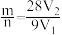 |
您最近一年使用:0次
2022-04-15更新
|
954次组卷
|
5卷引用:专题讲座(一) 化学计算的常用方法(练)-2023年高考化学一轮复习讲练测(全国通用)
(已下线)专题讲座(一) 化学计算的常用方法(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第06练 物质的量-2023年高考化学一轮复习小题多维练(全国通用)(已下线)提升卷05-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)吉林省实验中学2022-2023学年高一上学期线上期末考试(一卷)化学试题重庆市2022-2023学年高三下学期5月月考化学试题
21-22高二·全国·课时练习
7 . 著名科学家泽维尔用激光闪烁照相机拍摄到化学反应中化学键断裂和形成的过程,因而获得1999年诺贝尔化学奖。激光有很多用途,例如波长为10.3 μm的红外激光能切断B(CH3)3分子中的一个B-C键,使之与HBr发生取代反应:B(CH3)3+HBr B(CH3)2Br+CH4,而利用9.6 μm的红外激光能切断两个B-C键,并与HBr发生二元取代反应。
B(CH3)2Br+CH4,而利用9.6 μm的红外激光能切断两个B-C键,并与HBr发生二元取代反应。
(1)试写出二元取代的化学方程式:______
(2)现用5.6 g B(CH3)3和9.72 g HBr恰好完全反应,则生成物中除了甲烷外,其他两种产物的物质的量之比为多少?______
 B(CH3)2Br+CH4,而利用9.6 μm的红外激光能切断两个B-C键,并与HBr发生二元取代反应。
B(CH3)2Br+CH4,而利用9.6 μm的红外激光能切断两个B-C键,并与HBr发生二元取代反应。(1)试写出二元取代的化学方程式:
(2)现用5.6 g B(CH3)3和9.72 g HBr恰好完全反应,则生成物中除了甲烷外,其他两种产物的物质的量之比为多少?
您最近一年使用:0次
2021·山东聊城·二模
解题方法
8 . 过氧化钙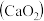 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。
Ⅰ.制备
利用反应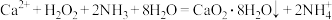 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
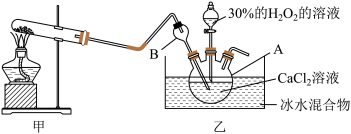
(1) 的电子式为
的电子式为_______ 。
(2)写出甲装置中反应的化学方程式_______ 。
(3)仪器A的名称为_______ ;仪器B的作用是_______ 。
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高 的产率和
的产率和_______ 。
(5)反应结束后,分离提纯 的过程中,洗涤的操作为
的过程中,洗涤的操作为_______ 。
Ⅱ.制得产品并定量检测
(6) 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有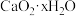 和
和 ,已知
,已知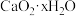 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取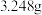 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀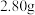 ,则该产品中
,则该产品中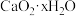 的x值为
的x值为_______ 。
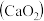 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。Ⅰ.制备

利用反应
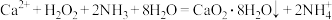 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
(1)
 的电子式为
的电子式为(2)写出甲装置中反应的化学方程式
(3)仪器A的名称为
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高
 的产率和
的产率和(5)反应结束后,分离提纯
 的过程中,洗涤的操作为
的过程中,洗涤的操作为Ⅱ.制得产品并定量检测
(6)
 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有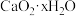 和
和 ,已知
,已知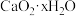 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取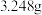 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀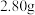 ,则该产品中
,则该产品中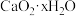 的x值为
的x值为
您最近一年使用:0次
解题方法
9 . 钛铁矿是铁和钛的氧化物矿物,成分可表示为FeTiO3 (Ti为+4价)。钛白粉(TiO2)涂料、塑料、油墨、造纸行业具有广泛的用途,制备流程如图:
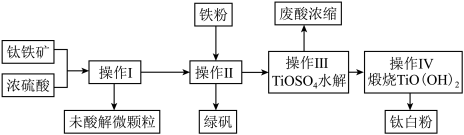
(1)钛铁矿与硫酸反应时可表示为FeTiO3+H2SO4→TiOSO4+X+H2O,其中X的化学式为______ ,该反应为______ (填“氧化还原反应”或“非氧化还原反应”)。
(2)某钛铁矿中FeTiO3的含量为76%,该钛铁矿与硫酸反应时Ti转化率为92%,操作I到操作IV的过程中Ti的转化率为96%,则1t该钛铁矿可生产钛白粉______ t (所有计算结果保留两位有效数字),能否计算绿矾的产量______ ?(若能则计算数值,否则说明理由)。
(3)操作I的名称是______ ,操作II包括搅拌、结晶、______ ,操作II中加入铁粉的目的是______ (用离子方程式表示)。
(4)写出操作III中TiOSO4水解的化学方程式:______ 。
(5)该生产过程中产生的尾气SO2、SO3的处理方法是______ 。

(1)钛铁矿与硫酸反应时可表示为FeTiO3+H2SO4→TiOSO4+X+H2O,其中X的化学式为
(2)某钛铁矿中FeTiO3的含量为76%,该钛铁矿与硫酸反应时Ti转化率为92%,操作I到操作IV的过程中Ti的转化率为96%,则1t该钛铁矿可生产钛白粉
(3)操作I的名称是
(4)写出操作III中TiOSO4水解的化学方程式:
(5)该生产过程中产生的尾气SO2、SO3的处理方法是
您最近一年使用:0次
2018高一上·全国·专题练习
10 . 二氧化氯是一种广谱杀菌消毒剂,有众多的用途,工业上制取二氧化氯的化学方程式如下:2NaClO3+ 2NaCl+2H2SO4 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。
(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为__________ L(标准状况)。
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为__________ mol/L。
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)。
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)。__________
 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2
 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)。
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)。
您最近一年使用:0次



