1 . 硫酸肼(N2H4·H2SO4)又名硫酸联氨,在医药、染料、农业上用途广泛。
已知:①Cl2与NaOH溶液的反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3
②利用尿素法生产水合肼的原理:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl
③硫酸肼的制备原理:N2H4·H2O+H2SO4=N2H4·H2SO4+H2O
回答下列问题:
Ⅰ.制备NaClO溶液
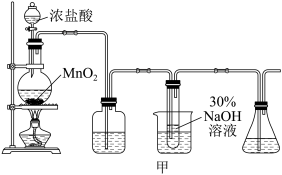
实验制备装置如图甲所示:
(1)欲配制220mL6mol/L的盐酸,则需要密度为1.2g/mL,质量分数为36.5%的浓盐酸体积为____ mL,此过程所需玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管和____ 。
(2)甲图装置C试管内发生主要化学反应的离子方程式为____ 。
Ⅱ.乙图是尿素法生产水合肼的装置
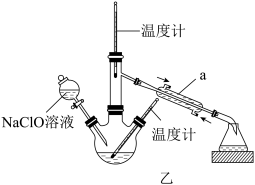
(3)把Ⅰ制得的NaClO溶液注入到图乙装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液,应采用____ 的方式降温,并控制低温(低于20℃)进行反应。温度高时水合肼会被氧化成无色无味的气体,该气体在标准状况下的密度为1.25g·L-1,其反应的化学方程式为_____ 。反应结束后,收集108~1149℃馏分。
(4)测定馏分中水合肼的含量。称取馏分5.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。实验测得消耗I2溶液体积的平均值为20.00mL,则馏分中水合肼(N2H4H2O)的质量分数为____ 。(保留两位有效数字)
Ⅲ.硫酸肼的性质、制备
已知:硫酸肼(又可以表示为:N2H6SO4)是一种重要的化工原料,硫酸肼属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
(5)将水合肼转移到烧杯中,滴加一定量浓硫酸,控制温度,得硫酸肼沉淀。洗涤硫酸肼时用无水乙醇而不用水洗涤的原因是____ 。
(6)①写出硫酸肼第二步水解反应的离子方程式:____ 。
②硫酸肼水溶液中离子浓度关系表达正确的是____ (填英文字母)。
A.c(SO )=c(N2H
)=c(N2H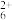 )+c(N2H
)+c(N2H )+c(N2H4·H2O)
)+c(N2H4·H2O)
B.c(SO )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)
C.2c(N2H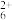 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)
D.c(SO )>c(N2H
)>c(N2H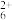 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
已知:①Cl2与NaOH溶液的反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3
②利用尿素法生产水合肼的原理:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl
③硫酸肼的制备原理:N2H4·H2O+H2SO4=N2H4·H2SO4+H2O
回答下列问题:
Ⅰ.制备NaClO溶液
实验制备装置如图甲所示:
(1)欲配制220mL6mol/L的盐酸,则需要密度为1.2g/mL,质量分数为36.5%的浓盐酸体积为
(2)甲图装置C试管内发生主要化学反应的离子方程式为

Ⅱ.乙图是尿素法生产水合肼的装置

(3)把Ⅰ制得的NaClO溶液注入到图乙装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液,应采用
(4)测定馏分中水合肼的含量。称取馏分5.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。实验测得消耗I2溶液体积的平均值为20.00mL,则馏分中水合肼(N2H4H2O)的质量分数为
Ⅲ.硫酸肼的性质、制备
已知:硫酸肼(又可以表示为:N2H6SO4)是一种重要的化工原料,硫酸肼属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
(5)将水合肼转移到烧杯中,滴加一定量浓硫酸,控制温度,得硫酸肼沉淀。洗涤硫酸肼时用无水乙醇而不用水洗涤的原因是
(6)①写出硫酸肼第二步水解反应的离子方程式:
②硫酸肼水溶液中离子浓度关系表达正确的是
A.c(SO
 )=c(N2H
)=c(N2H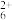 )+c(N2H
)+c(N2H )+c(N2H4·H2O)
)+c(N2H4·H2O)B.c(SO
 )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)C.2c(N2H
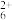 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)D.c(SO
 )>c(N2H
)>c(N2H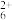 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
您最近一年使用:0次
名校
2 . 已知 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是
 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是A.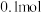 环氧乙烷( 环氧乙烷( )中含有的共价键数为 )中含有的共价键数为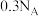 |
B. 的 的 溶液中所含碳原子总数为 溶液中所含碳原子总数为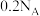 |
C.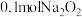 与足量潮湿的二氧化碳反应转移的电子数为 与足量潮湿的二氧化碳反应转移的电子数为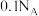 |
D.电解精炼铜时,若阴极得电子数为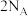 ,则阳极质量一定减少 ,则阳极质量一定减少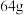 |
您最近一年使用:0次
2021-04-16更新
|
397次组卷
|
6卷引用:吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期第三次摸底测试化学试题
3 . 用NA表示阿伏伽德罗常数的数值。下列说法正确的是
| A.1.0molCH4与3.0molCl2光照下反应生成的CHCl3分子数为1.0NA |
| B.1.0mol·L-1的(NH4)3PO4溶液中阳离子数为3.0NA |
| C.5.6gFe与过量浓盐酸完全反应转移的电子数为0.2NA |
| D.常温下2.24LSO3中含有的质子数为4.0NA |
您最近一年使用:0次
2019-03-13更新
|
578次组卷
|
2卷引用:【校级联考】吉林省名校2019届高三下学期第一次联合模拟考试化学试题
名校
4 . 三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
(1)氯化水解法生产三氯氧磷的化学方程式为_____________________________________ 。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用10 mL H3PO3溶液与同浓度的NaOH溶液20 mL恰好完全反应,生成的盐化学式为___________ ,属于________ (填“正盐”或“酸式盐”)。
②H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________ 。
③用含有Ca2+的溶液处理含磷废水,若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________ mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
④某温度下,0.1mol/L的H3PO3溶液中c(H+)=2.5×10ˉ2 mol/L,则该温度下H3PO3的第一步电离的平衡常数Kal=___________ (H3PO3的第二步电离忽略不计,保留两位有效数字)。
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,进一步可以计算产品的纯度,
实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入b mol·Lˉ1的AgNO3溶液V1 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,振荡,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,所用体积V2 mL。
①滴定选用的指示剂是________ (选填字母)。
a.Fe2(SO4)3 b.(NH4)2Fe(SO4)2 c.淀粉 d.酚酞
②实验所测产品中三氯氧磷的纯度为_____________ 。(用含相关字母的表达式表示)

(1)氯化水解法生产三氯氧磷的化学方程式为
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用10 mL H3PO3溶液与同浓度的NaOH溶液20 mL恰好完全反应,生成的盐化学式为
②H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式
③用含有Ca2+的溶液处理含磷废水,若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=
④某温度下,0.1mol/L的H3PO3溶液中c(H+)=2.5×10ˉ2 mol/L,则该温度下H3PO3的第一步电离的平衡常数Kal=
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,进一步可以计算产品的纯度,
实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入b mol·Lˉ1的AgNO3溶液V1 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,振荡,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,所用体积V2 mL。
①滴定选用的指示剂是
a.Fe2(SO4)3 b.(NH4)2Fe(SO4)2 c.淀粉 d.酚酞
②实验所测产品中三氯氧磷的纯度为
您最近一年使用:0次
5 . 一定体积的酸性KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.2000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为( )
| A.0.0176 | B.0.1600 | C.0.1200 | D.0.2400 |
您最近一年使用:0次
2016-12-09更新
|
114次组卷
|
3卷引用:2016届吉林省东北师大附属中学高三上第二次模拟化学试卷
6 . 下列有关溶液的说法正确的是
| A.要配制浓度为0.25mol·L-1的NaOH溶液480mL,应称量4.8g NaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 |
| B.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低 |
| C.配制一定物质的量浓度的溶液定容时,俯视刻度线导致所配浓度偏高 |
| D.配制20g密度为ρg·cm-3的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为5ρ/41mol·L-1 |
您最近一年使用:0次
7 . 下列溶液中氯离子的物质的量浓度与50mL 1mol•L-1氯化铝溶液中氯离子的物质的量浓度相等的是
| A.150mL 1mol•L-1氯化钠溶液 |
| B.75mL 1.5mol•L-1氯化钙溶液 |
| C.150mL 3mol•L-1氯酸钾溶液 |
| D.50mL 1mol•L-1氯化镁溶液 |
您最近一年使用:0次



