2019·四川攀枝花·一模
名校
解题方法
1 . 海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
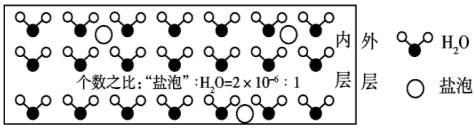

| A.海冰内层“盐泡”越多,密度越小 |
| B.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在 |
C.海冰内层NaCl的浓度约为 (设海冰的密度为0.9 (设海冰的密度为0.9 ) ) |
| D.海冰冰龄越长,内层的“盐泡”越多 |
您最近一年使用:0次
2022-11-26更新
|
620次组卷
|
15卷引用:《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(六)
(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(六)【市级联考】四川省攀枝花市2019—2020学年高三上学期第一次统考化学试题(已下线)2020届超级全能生24省高三9月联考丙(A)卷 理综化学 福建省漳平市第一中学2020届高三上学期第二次月考化学试题江西省宜春市丰城九中2020届高三12月月考化学试题2020届高三化学二轮冲刺新题专练——化学与STSE考查2020届高三《新题速递·化学》12月第01期(考点01-06)2020届高三化学知识点强化训练-----化学与资源开发福建省莆田市仙游县枫亭中学2020届高三上学期第二次月考化学试题山西省芮城市2020届高三3月月考化学试题河北省枣强中学2019-2020学年高三第四次月考化学试题安徽省合肥市第一中学2022-2023学年高三上学期11月月考化学试题(已下线)热点情景汇编-专题九 物质结构与性质(已下线)专题04 电离方程式、电解质溶液的导电性-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)安徽省十校2022-2023学年高一下学期开学摸底联考化学试题
名校
解题方法
2 . 下列实验操作可达到预期目的的是
| 选项 | 目的 | 操作 |
| A | 测定硫酸铜晶体中结晶水含量 | 加热后的坩埚直接放在石棉网上冷却,称量 |
| B | 验证淀粉是否完全水解 | 向淀粉溶液中加入稀硫酸,加热、搅拌、冷却后,加过量氢氧化钠溶液中和稀硫酸,滴加几滴碘水 |
| C | 配制0.1mol/LNa2CO3溶液 | 称取5.3gNa2CO3∙10H2O固体于烧杯中,加入少量蒸馏水溶解,冷却后,转移至500mL容量瓶中定容 |
| D | 配制FeSO4溶液 | 先将FeSO4固体溶在稀硫酸中,然后稀释,并加入少量铁粉 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-06-02更新
|
484次组卷
|
2卷引用:山东师范大学附属中学2022届高三考前预测化学试题
解题方法
3 . 五氧化二钒常用于生产硫酸或石油精炼的催化剂。某化工厂从废钒催化剂中(含有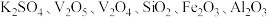 等)回收
等)回收 和
和 ,既能避免环境污染,又能节约资源。回收工艺流程如下:
,既能避免环境污染,又能节约资源。回收工艺流程如下:
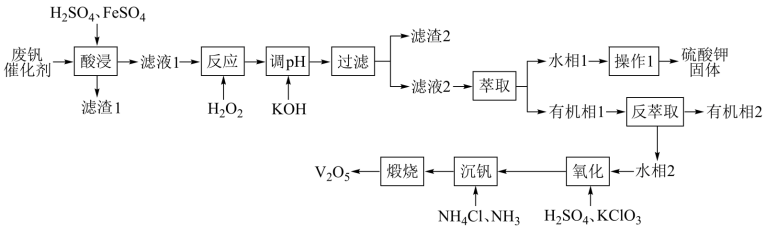
已知:1:①"酸浸”时, 和
和 先与稀硫酸反应分别生成
先与稀硫酸反应分别生成 和
和 ;
;
②有机萃取剂萃取 的能力比萃取
的能力比萃取 的能力强;
的能力强;
③ 微溶于冷水、易溶于热水、难溶于乙醇;
微溶于冷水、易溶于热水、难溶于乙醇;
④溶液中 与
与 可相互转化:
可相互转化: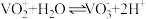 。
。
回答下列问题:
(1)滤渣2的成分主要有_______ (填化学式)。
(2)“酸浸”时, 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(3)“萃取”和“反萃取”时,将发生 (其中R表示
(其中R表示 ,
, 表示有机萃取剂)。
表示有机萃取剂)。
①“反萃取”操作加入的试剂是_______ (填化学式)。
②假设“滤液2”中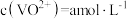 ,“萃取”和“反萃取”每进行一次,
,“萃取”和“反萃取”每进行一次, 萃取率为90%,5次操作后,“滤液2”中残留的
萃取率为90%,5次操作后,“滤液2”中残留的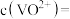
_______  【萃取率=
【萃取率=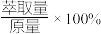 】。
】。
(4)“氧化”过程中发生反应的离子方程式为_______ 。
(5)①“沉钒”时生成 ,通入
,通入 的作用是
的作用是_______ 。
②实验发现,温度超过 以后沉钒率下降,可能的原因是
以后沉钒率下降,可能的原因是_______ 。
 等)回收
等)回收 和
和 ,既能避免环境污染,又能节约资源。回收工艺流程如下:
,既能避免环境污染,又能节约资源。回收工艺流程如下:
已知:1:①"酸浸”时,
 和
和 先与稀硫酸反应分别生成
先与稀硫酸反应分别生成 和
和 ;
;②有机萃取剂萃取
 的能力比萃取
的能力比萃取 的能力强;
的能力强;③
 微溶于冷水、易溶于热水、难溶于乙醇;
微溶于冷水、易溶于热水、难溶于乙醇;④溶液中
 与
与 可相互转化:
可相互转化: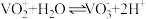 。
。回答下列问题:
(1)滤渣2的成分主要有
(2)“酸浸”时,
 参与反应的离子方程式为
参与反应的离子方程式为(3)“萃取”和“反萃取”时,将发生
 (其中R表示
(其中R表示 ,
, 表示有机萃取剂)。
表示有机萃取剂)。①“反萃取”操作加入的试剂是
②假设“滤液2”中
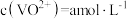 ,“萃取”和“反萃取”每进行一次,
,“萃取”和“反萃取”每进行一次, 萃取率为90%,5次操作后,“滤液2”中残留的
萃取率为90%,5次操作后,“滤液2”中残留的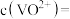
 【萃取率=
【萃取率=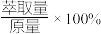 】。
】。(4)“氧化”过程中发生反应的离子方程式为
(5)①“沉钒”时生成
 ,通入
,通入 的作用是
的作用是②实验发现,温度超过
 以后沉钒率下降,可能的原因是
以后沉钒率下降,可能的原因是
您最近一年使用:0次
4 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.36g40Ar中含有的质子总数为18NA |
| B.0.4gN2H4与6gCH3OH的混合物中含有的共价键总数为NA |
| C.0.1mol·L-1的H2S溶液中H2S、HS-和S2-的总数为0.1NA |
| D.标准状况下,22.4LH2O2催化分解产生的O2的分子数为0.5NA |
您最近一年使用:0次
5 . NA是阿伏加 德罗常数的值,下列说法正确的是( )
| A.7.8g苯含σ键的数目为0.6NA |
| B.将Cl2通入FeBr2溶液中,有1molBr2生成时,转移的电子数为2NA |
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH 的数目为NA 的数目为NA |
| D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA |
您最近一年使用:0次
2020-06-14更新
|
343次组卷
|
3卷引用:山东省济宁市2020届高三第三次模拟化学试题
6 . 设NA为阿伏加 德罗常数的值。下列叙述正确的是
| A.标准状况下,11.2LCHCl3中含有的氯原子数目为1.5NA |
| B.10.0g质量分数为46%的乙醇溶液与足量钠反应产生的H2数目为0.05NA |
| C.常温常压下,124gP4中含σ键数目为4NA |
D.向1L1mol·L-1NH4Cl溶液中加入氨水至中性,溶液中 数目为NA 数目为NA |
您最近一年使用:0次
2020-05-01更新
|
238次组卷
|
2卷引用:山东省临沂市2020届高三下学期4月一模考试化学试题
7 . 下列叙述正确的是
A.含 个离子的固体 个离子的固体 溶于水配成1 L溶液,所得溶液中 溶于水配成1 L溶液,所得溶液中 的物质的量浓度为2 的物质的量浓度为2  |
B. 在空气中长期放置变浑浊的离子方程式为: 在空气中长期放置变浑浊的离子方程式为: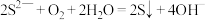 |
C.可以用澄清石灰水鉴别 和 和 |
D.滴加KSCN显红色的溶液中存在: 、 、 、 、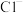 、 、 |
您最近一年使用:0次
2020-02-17更新
|
118次组卷
|
3卷引用:2015届山东省德州市高三第二次模拟理综化学试卷
名校
8 . 用NA表示阿伏伽德罗常数的值。下列叙述中正确的是
| A.100g 9%的葡萄糖水溶液中氧原子数为0.3NA |
| B.标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2 |
| C.工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡 |
| D.常温下l LpH=7的1mol/LCH3COONH4溶液中CH3COO-与NH4+数目均为NA |
您最近一年使用:0次
2019-05-10更新
|
1259次组卷
|
5卷引用:【市级联考】山东省青岛市2019届高三下学期5月第二次模考理科综合化学试题
【市级联考】山东省青岛市2019届高三下学期5月第二次模考理科综合化学试题(已下线)专题02 化学计量与化学计算——2019年高考真题和模拟题化学分项汇编吉林省长春外国语学校2018-2019学年高二下学期期末考试化学试题2020届人教版高三化学二轮复习选择题专攻练——阿伏加德罗常数(已下线)专题讲座(一) 阿伏加德罗常数的突破(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)
名校
9 . 氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
(1)过程Ⅰ:加NaOH溶液,调节pH至11后,并鼓入大量空气。用离子方程式表示加NaOH溶液的作用是______________ ;用化学平衡理论解释鼓入大置空气的目的__________________ 。
(2) II中加入适量NaClO溶液,控制pH在3~4,将NH4+转化为无毒物质。则反应的离子方程式是__________________ 。
(3)分别称取2.39 g (NH4)2SO4和NH4Cl固体混合物两份。
①将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为__________ 。
②另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=_______ (溶液体积变化忽略不计)。
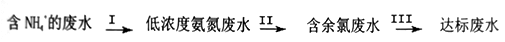
(1)过程Ⅰ:加NaOH溶液,调节pH至11后,并鼓入大量空气。用离子方程式表示加NaOH溶液的作用是
(2) II中加入适量NaClO溶液,控制pH在3~4,将NH4+转化为无毒物质。则反应的离子方程式是
(3)分别称取2.39 g (NH4)2SO4和NH4Cl固体混合物两份。
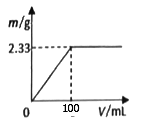
①将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为
②另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=
您最近一年使用:0次
名校
10 . 下列实验操作正确的是
| A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
| B.将1mol CuSO4·5H2O溶解在1 L水中,配制1 mol/L的CuSO4溶液 |
| C.洗净的量筒和容置瓶不能放进烘箱中烘干 |
| D.C12能与Ca(OH)2反应,可以用澄清石灰水吸收尾气中的Cl2 |
您最近一年使用:0次



