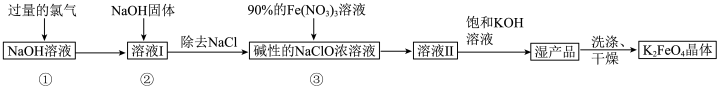
1 . 高铁酸钾 是新型多功能水处理剂,其生产工艺如图所示:
是新型多功能水处理剂,其生产工艺如图所示:
已知:① 与
与 溶液反应的产物与反应温度有关,温度较低时产物为
溶液反应的产物与反应温度有关,温度较低时产物为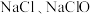 和
和 ;温度较高时产物为
;温度较高时产物为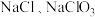 和
和 。
。
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出 与
与 溶液在较高温度下反应的离子方程式:
溶液在较高温度下反应的离子方程式:___________ 。
(2)向“溶液Ⅰ”中加入 固体起到的作用有降低
固体起到的作用有降低 的溶解度、
的溶解度、___________ 、___________ ;
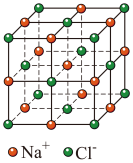
(3) 晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的
晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的 间的距离为
间的距离为___________  ,该晶体的密度为
,该晶体的密度为___________  。(列出计算式)
。(列出计算式)
(4)配制 溶液时,将
溶液时,将 固体溶解在
固体溶解在 水中(水的密度近似为
水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为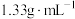 ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为___________  。(保留3位有效数字)
。(保留3位有效数字)
(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)
___________ 。对“湿产品”进行“洗涤、干燥”时,洗涤剂最好选用___________ (填标号)溶液和异丙醇。
A. B.
B. C.
C.
 是新型多功能水处理剂,其生产工艺如图所示:
是新型多功能水处理剂,其生产工艺如图所示:
已知:①
 与
与 溶液反应的产物与反应温度有关,温度较低时产物为
溶液反应的产物与反应温度有关,温度较低时产物为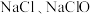 和
和 ;温度较高时产物为
;温度较高时产物为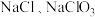 和
和 。
。②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出
 与
与 溶液在较高温度下反应的离子方程式:
溶液在较高温度下反应的离子方程式:(2)向“溶液Ⅰ”中加入
 固体起到的作用有降低
固体起到的作用有降低 的溶解度、
的溶解度、(3)
 晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的
晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的 间的距离为
间的距离为 ,该晶体的密度为
,该晶体的密度为 。(列出计算式)
。(列出计算式)
(4)配制
 溶液时,将
溶液时,将 固体溶解在
固体溶解在 水中(水的密度近似为
水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为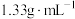 ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为 。(保留3位有效数字)
。(保留3位有效数字)(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)

A.
 B.
B. C.
C.
您最近一年使用:0次
2023-09-09更新
|
282次组卷
|
2卷引用:黑龙江省大庆市2023-2024学年高三上学期第一次教学质量检测化学试题
名校
2 . 工业烟气含有 ,可以用
,可以用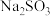 溶液进行绿色化处理后再排放。设
溶液进行绿色化处理后再排放。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 ,可以用
,可以用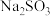 溶液进行绿色化处理后再排放。设
溶液进行绿色化处理后再排放。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.6.4 g  含有的电子数目为0.3 含有的电子数目为0.3 |
B.1 L 1  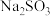 溶液中 溶液中 的数目为2 的数目为2 |
C.22.4 L (标准状况)与足量氧气反应,转移电子数目为2 (标准状况)与足量氧气反应,转移电子数目为2 |
D.1 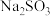 溶液最多能吸收 溶液最多能吸收 的数目为0.1 的数目为0.1 |
您最近一年使用:0次
2023-02-27更新
|
1536次组卷
|
7卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试卷(二)
2011·黑龙江·三模
名校
3 . 在80g密度为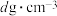 的硫酸铁溶液中,含有2.8g
的硫酸铁溶液中,含有2.8g ,则此溶液中
,则此溶液中 的物质的量浓度数值为
的物质的量浓度数值为
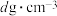 的硫酸铁溶液中,含有2.8g
的硫酸铁溶液中,含有2.8g ,则此溶液中
,则此溶液中 的物质的量浓度数值为
的物质的量浓度数值为A.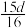 | B.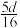 | C.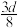 | D.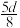 |
您最近一年使用:0次
2022-12-16更新
|
339次组卷
|
19卷引用:2011届黑龙江哈三中高三第三次模拟考试(理综)化学部分
(已下线)2011届黑龙江哈三中高三第三次模拟考试(理综)化学部分(已下线)2014高考名师推荐化学CB计算法(已下线)2013-2014河北石家庄二中上学期10月月考高一化学试卷(已下线)2013-2014河北省石家庄一中上学期开学考试高二化学试卷(已下线)2015届福建省三明一中高三学年度上学期第一次月考化学试卷(已下线)2015届浙江省台州中学高三上学期第一次统练化学试卷(已下线)2015届福建省三明一中高三上学期第一次月考化学试卷(已下线)2013-2014学年河北石家庄二中高一上第一次月考化学试卷2016届江西省靖安中学高三上学期第一次月考化学试卷广西河池市高级中学2017-2018学年高一上学期第一次月考化学试题(已下线)2019年高考化学一轮复习讲练测1.2 物质的量浓度 练山西省忻州市第二中学2019届高三上学期期中考试化学试题(已下线)河北省保定一中2018-2019学年高一上学期期末测试化学试题河南省开封市五县2020-2021学年高一上学期期中联考化学试题河南省滑县实验学校2020-2021学年高一上学期11月半月考试化学试题四川省南充高级中学2017-2018学年高一上学期期中考试化学试题内蒙古呼和浩特市第一中学 2022-2023学 年高一上学期阶段性考试化学试题云南省玉溪市通海县第一中学2022-2023学年高一上学期期中考试化学试题作业(十六) 物质的量浓度的有关计算
名校
解题方法
4 . 海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包裹在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,则融化后的水为淡水。下列叙述正确的是
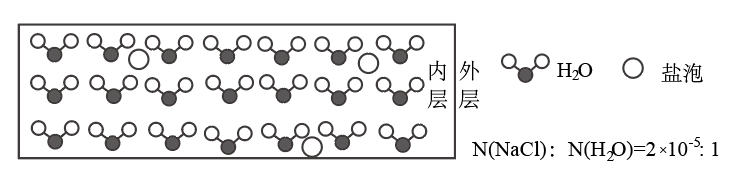

| A.海冰内层“盐泡”越少,密度越大 |
| B.海冰冰龄越短,内层的“盐泡”越少 |
C.每含1molH2O的海冰内就有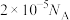 个NaCl分子(NA为阿伏加德罗常数) 个NaCl分子(NA为阿伏加德罗常数) |
D.海冰内层NaCl的浓度约为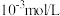 (设冰的密度为0.9g/cm3) (设冰的密度为0.9g/cm3) |
您最近一年使用:0次
2021-05-30更新
|
723次组卷
|
16卷引用:黑龙江省部分学校2020届高三5月联考理综化学试题
黑龙江省部分学校2020届高三5月联考理综化学试题浙江省五校2021届高三下学期5月联考化学试题广东福建等省2020届高三下学期4月联考(全国I卷)理综化学试题(已下线)第2讲 物质的量浓度-2021年高考化学一轮复习名师精讲练(已下线)小题必刷11 物质的量浓度与溶液的配制——2021年高考化学一轮复习小题必刷(通用版)山西省太原市第五中学2021届高三上学期9月阶段性考试化学试题湖南省长沙市第一中学2021届高三上学期第二次月考化学试题河南省安阳市实验中学2020-2021学年高一上学期阶段性考试化学试题(已下线)【南昌新东方】12. 南大附中 项金辉 袁斌.河南省商丘市第一高级中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】【2021.5.19】【SX】【高三下】【高中化学】【SX00128】(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点07 物质的量浓度(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
5 . 设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.6g SiO2晶体中含有的硅氧键数目为0.2NA |
| B.1L 0.1mol/ LNa2S溶液中含阴离子数目大于0.1NA |
C.lmol/L的NH4Br溶液中通入适量氨气呈中性,此时溶液中NH 的数目为NA 的数目为NA |
| D.60g分子式为C3H8O的有机物中含有C-H键数目为7NA |
您最近一年使用:0次
2021-05-02更新
|
658次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2021届高三下学期第二次模拟考试理科综合化学试题
10-11高一上·山西太原·期中
名校
解题方法
6 . 实验室里需用480mL0.1mol·L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是
| A.称取7.68g硫酸铜,加入500mL水 |
| B.称取12.0g胆矾配成500mL溶液 |
| C.称取12.5g胆矾配成500mL溶液 |
| D..称取8.0g硫酸铜,加入500mL水 |
您最近一年使用:0次
2020-10-31更新
|
420次组卷
|
57卷引用:2011届黑龙江省鸡西市第一中学高三第二次模拟考试化学试卷
(已下线)2011届黑龙江省鸡西市第一中学高三第二次模拟考试化学试卷(已下线)2011-2012学年黑龙江省鹤岗一中高二下学期期末考试化学试卷2016-2017学年黑龙江大庆铁人中学高一上期中化学卷(已下线)2010年山西省太原五中高一上学期期中考试化学试卷(已下线)2012届陕西省长安一中高三开学第一次考试化学试卷(已下线)2012届甘肃省张掖二中高三9月月考化学试卷(已下线)2012-2013学年海南省洋浦中学高一上学期期末考试化学试卷(已下线)2012-2013学年广东省汕头四中高一上学期期末考试化学试卷(已下线)2013-2014学年河南省漯河市五校高一上学期期中联考化学试卷(已下线)2014届浙江省苍南县巨人中学高三上学期第三次月考化学试卷(已下线)2014高考名师推荐化学CB计算法(已下线)2014秋江苏省东台市三仓中学高一第一学期期中考试化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2016届江西省靖安中学高三上学期第一次月考化学试卷2015-2016学年辽宁师大附中高一上10月月考化学试卷 2015-2016学年江苏省海安实验中学高一上学期期中测试化学试卷2017届广西桂林十八中高三上第一次月考化学试卷2017届河北省邯郸市大名一中高三上学期第一次月考化学试卷2016-2017学年河北省邯郸一中高一上入学考试化学试卷2016-2017学年宁夏育才中学高一上第一次月考化学试卷2016-2017学年湖北省部分重点中学高一上学期期中化学试卷2016-2017学年广西桂林中学高二上模拟考试化学卷2015-2016学年上海市同济中学高一下学期期中考试化学试卷陕西省黄陵中学2018届高三(普通班)上学期开学考试化学试题河南省长葛市第一高级中学2017-2018学年高一9月质量检测化学试题山西省怀仁县第一中学2018届高三上学期第二次月考化学试题河南省周口市郸城县第一高级中学2017-2018学年高一10月月考化学试题新疆呼图壁县一中2017-2018学年高一上学期期中考试化学试卷北京市衡中清大教育集团2017-2018学年高一上学期期中考试化学试题内蒙古鄂尔多斯市第一中学2017-2018学年高一上学期第三次月考化学试题广东省汕头市金山中学2017-2018学年高一上学期期末考试化学试题2018--2019高中化学《物质的量浓度》专项训练题江苏省东台市创新学校2019届高三上学期9月月考化学试题吉林省白城市第一中学2018-2019学年高一上学期第一次月考化学试题【校级联考】湖南省醴陵二中、醴陵四中2018-2019学年高一上学期期中联考化学试题【校级联考】湖南省浏阳市六校联考2018-2019学年高一上学期期中考试化学试题【全国百强校】吉林省延边市第二中学2018-2019学年高一下学期开学考试化学试题河南省长葛市第一高级中学2019-2020学年高一上学期第一次(9月)月考化学试题2019年10月18日《每日一题》2019-2020学年高一化学人教必修1——一定物质的量浓度溶液的配制甘肃省天水市天水一中2019-2020学年高一上学期第一次月考化学试题湖南省邵东县第一中学2019-2020学年高一上学期第一次月考化学试题福建省建瓯市芝华中学2019-2020学年高一上学期期中考试化学试题辽宁省大连市第八中学2019-2020学年高一上学期12月月考化学试题湖北省恩施州清江外国语学校2019-2020学年高一上学期期末考试化学试题广东省广州市天河区华南师范大学附属中学2020届高三化学专题训练(5)内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题(已下线)【南昌新东方】2019 南师附中 高一上第一次月考安徽省阜阳市颍上二中2019-2020学年高一下学期分班考试化学试卷(已下线)1.3.3物质的量浓度练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)【南昌新东方】14. 豫章中学 刘惠文(已下线)【南昌新东方】15. 莲塘二中 曹永康.内蒙古自治区通辽市科左后旗甘旗卡第二高级中学2020-2021学年高一上学期期中考试化学试题湖南省新宁县崀山培英学校2020-2021学年高一上学期期中考试化学试题河南省南阳市邓州市第一高级中学校2021-2022学年高一上学期第一次月考化学试题四川省仁寿第—中学校北校区2021-2022学年高一上学期9月月考化学试题浙江省嘉兴市南湖片区2021-2022学年高一上学期期中检测化学试题湖南省邵阳市邵东县第三中学2021--2022届高三上学期期中考试化学试题
名校
7 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]易溶于水,在定量分析中常用来配制亚铁离子的标准溶液。某化学课外小组同学设计并完成下列实验。
I.(NH4)2Fe(SO4)2·6H2O的制取
实验步骤:
①称取4.2g碎铁屑于锥形瓶中,加入10mL30%的NaOH溶液,加热煮沸-段时间。倾去碱液,水洗至中性。
②向处理过的铁屑中加入25mL3mol/LH2SO4,水浴加热至反应完全,趁热过滤。
③向滤液中加入-定体积的饱和(NH4)2SO4溶液,加热浓缩,冷却,抽滤,洗涤,干燥得产品。
(1)步骤①中加入NaOH溶液的目的是___ 。
(2)步骤②趁热过滤的目的是___ 。
(3)步骤③加热浓缩溶液时,需要的仪器有酒精灯、___ 、___ (固定、夹持仪器除外)。
Ⅱ.(NH4)2Fe(SO4)2·6H2O和FeSO4·7H2O稳定性的对比研究
如图,在2支相同的注射器中分别装入等物质的量的两种晶体,调整2支注射器活塞使空气体积相等,用针头及胶塞封好注射器(气密性良好)。较长时间后,取出两种晶体,分别滴加2滴0.01mol/LKSCN溶液。整个过程中实验现象记录如下:

(4)判断a___ b(填“>”、“<”或“=”),出现此结果的原因可能是___ 。
(5)判断此条件下(NH4)2Fe(SO4)2·6H2O的稳定性___ (填“大于”或“小于”)FeSO4·7H2O。
Ⅲ.配制(NH4)2Fe(SO4)2溶液并标定浓度
配制(NH4)2Fe(SO4)2溶液100mL,准确量取20.00mL,置于锥形瓶中,加10mLH2SO4和邻二氮菲指示剂3~4滴,用cmol/LK2Cr2O7标准液滴定至溶液变成棕红色。消耗K2Cr2O7溶液的体积为VmL。
(6)计算(NH4)2Fe(SO4)2溶液的浓度为___ mol/L。
(7)下列操作会使所测溶液浓度偏大的是___ (填标号)。
A.锥形瓶用待测溶液润洗
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
C.滴定过程中剧烈摇晃锥形瓶,溶液溅出
D.滴定前平视读数,滴定后俯视读数
I.(NH4)2Fe(SO4)2·6H2O的制取
实验步骤:
①称取4.2g碎铁屑于锥形瓶中,加入10mL30%的NaOH溶液,加热煮沸-段时间。倾去碱液,水洗至中性。
②向处理过的铁屑中加入25mL3mol/LH2SO4,水浴加热至反应完全,趁热过滤。
③向滤液中加入-定体积的饱和(NH4)2SO4溶液,加热浓缩,冷却,抽滤,洗涤,干燥得产品。
(1)步骤①中加入NaOH溶液的目的是
(2)步骤②趁热过滤的目的是
(3)步骤③加热浓缩溶液时,需要的仪器有酒精灯、
Ⅱ.(NH4)2Fe(SO4)2·6H2O和FeSO4·7H2O稳定性的对比研究
如图,在2支相同的注射器中分别装入等物质的量的两种晶体,调整2支注射器活塞使空气体积相等,用针头及胶塞封好注射器(气密性良好)。较长时间后,取出两种晶体,分别滴加2滴0.01mol/LKSCN溶液。整个过程中实验现象记录如下:

编号 | 活塞向右运动的距离(cm) | 滴加KSCN溶液后颜色变化 |
① | a | 较深的黄色 |
② | b | 淡淡的黄色 |
(5)判断此条件下(NH4)2Fe(SO4)2·6H2O的稳定性
Ⅲ.配制(NH4)2Fe(SO4)2溶液并标定浓度
配制(NH4)2Fe(SO4)2溶液100mL,准确量取20.00mL,置于锥形瓶中,加10mLH2SO4和邻二氮菲指示剂3~4滴,用cmol/LK2Cr2O7标准液滴定至溶液变成棕红色。消耗K2Cr2O7溶液的体积为VmL。
(6)计算(NH4)2Fe(SO4)2溶液的浓度为
(7)下列操作会使所测溶液浓度偏大的是
A.锥形瓶用待测溶液润洗
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
C.滴定过程中剧烈摇晃锥形瓶,溶液溅出
D.滴定前平视读数,滴定后俯视读数
您最近一年使用:0次
名校
8 . 设NA为阿伏加 德罗常数的值。下列说法错误的是( )
| A.100 g溶质质量分数为46%的乙醇水溶液中,含有4NA个氧原子 |
| B.1 mol Cl2溶于水,溶液中Cl-、HClO、ClO-粒子数之和小于2NA |
| C.2.24 L(标准状况)2H2中含有0.2NA个中子 |
| D.25 ℃时Ksp(CaSO4)=9×10-6,则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+ |
您最近一年使用:0次
2020-01-04更新
|
337次组卷
|
8卷引用:黑龙江省齐齐哈尔市2018届高三第一次模拟理综化学试题
2010·全国·高考真题
9 . 把500 有BaCl2和KCl的混合溶液分成5等份,取一份加入含
有BaCl2和KCl的混合溶液分成5等份,取一份加入含
 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
 有BaCl2和KCl的混合溶液分成5等份,取一份加入含
有BaCl2和KCl的混合溶液分成5等份,取一份加入含
 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为A.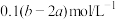 | B. |
C.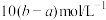 | D.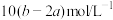 |
您最近一年使用:0次
2019-01-30更新
|
3746次组卷
|
94卷引用:2011届黑龙江省鸡西市第一中学高三第二次模拟考试化学试卷
(已下线)2011届黑龙江省鸡西市第一中学高三第二次模拟考试化学试卷(已下线)2011-2012学年黑龙江省哈三中高一上学期期中考试化学试卷2016-2017学年黑龙江大庆一中高一上开学考试化学卷2016-2017学年黑龙江省鹤岗一中高一上期中化学试卷黑龙江省大庆市第一中学2017-2018学年高一第一次阶段考试化学试题黑龙江省大庆市第一中学2019-2020学年高一上学期第一次月考化学试题黑龙江嫩江市高级中学2021届高三上学期第二次月考化学试题黑龙江省鹤岗市第一中学2020-2021学年高二下学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三9月月考化学试题2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)2010年普通高等学校招生全国统一考试(课标Ⅰ卷)理综化学部分全解全析2010年普通高等学校招生全国统一考试(湖南卷)理综化学部分全解全析2010年高考化学试题分项专题三 物质的量2010年高考化学试题分项专题十四 化学计算(已下线)09~10年宝鸡中学高二下学期期末考试化学卷(已下线)2010年宁夏银川一中高一上学期期中考试化学卷(已下线)2010年湖南师大附中高一上学期期中考试化学试卷(已下线)2010年四川省成都七中高一上学期期中考试化学试卷(已下线)2010—2011学年上海交通大学附属中学高二第二学期期末化学试卷(已下线)2011-2012学年云南省昆明一中高一上学期期中考试化学试卷(已下线)2011-2012学年吉林省长春外国语学校高二上学期期中考试化学(理)试卷(已下线)2013-2014学年山东济宁曲阜师大附中高一上学期期中考试化学试卷(已下线)2013-2014学年河南省洛阳市高一上学期期中考试化学试卷(A卷)(已下线)2015届山东省济宁市微山县第一中学高三10月阶段测试化学试卷2014-2015辽宁省实验中学分校高一上学期期中化学试卷2014-2015湖南省益阳六中高一上学期期中考试化学试卷2014-2015学年湖南省益阳市第六中学高一上学期期中考试化学卷2014-2015学年湖北省襄阳市老河口高级中学高二下学期期末化学试卷2016届湖北省仙桃中学高三8月月考(开学摸底)化学试卷2015-2016学年江西省新余一中高一上第一次段考化学试卷2015-2016学年湖南省衡阳一中高一上学期期中测试化学试卷2016届湖北省枣阳二中高三上学期期中考试化学试卷2015-2016学年四川省三台中学高一上第三次月考化学试卷2015-2016学年河南省三门峡市陕州一中高二下第三次月考化学试卷2016-2017学年河南省漯河中学高一上第一次月考化学卷2016-2017学年湖南省双峰县第一中学高一上第一次月考化学试卷2016-2017学年山西省太原五中高一上10月月考化学试卷2016-2017学年安徽省师大附中高一上期中化学试卷贵州省铜仁市一中2016-2017学年高一上期中化学试卷河北省故城县高级中学2018届高三9月月考化学试题湖南省长沙市实验中学2017-2018学年高一上学期第一次月考化学试题山西省怀仁县第一中学2018届高三上学期第二次月考化学试题河南省鹤壁市淇滨高级中学2017-2018学年高一上学期第二次月考化学试题江西省宜春九中2017-2018学年高一上学期第一次月考化学试卷山西省祁县中学2017-2018学年高一12月月考化学试题(已下线)二轮复习 专题16 化学计算方法与技巧 押题专练【全国百强校】江西省南昌市第十中学2017-2018学年高二5月月考化学试题吉林省白城市第一中学2018-2019学年高一上学期第一次月考化学试题山西省长治二中2018-2019学年高一上学期第一次月考化学试题【市级联考】河北省遵化市2018-2019学年高一上学期期中考试化学试题【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题贵州省黔西县一中2018-2019学年高一第一学期12月考试化学试题贵州省织金县第一中学2018-2019学年高一上学期期中考试化学试题河南省鹤壁市淇县第一中学2018-2019学年高一上学期第三次月考化学试题百所名校联考-从实验学化学云南省文山州广南县第二中学2019-2020学年高二上学期9月份考试化学试题湖北省黄冈市麻城实验高中2019-2020学年高一10月月考试化学试题宁夏石嘴山市第三中学2019-2020学年高一10月月考化学试题湖北省荆州开发区滩桥高级中学2019-2020学年高一上学期期中考试化学试题江苏省南通市海安市南莫中学2019-2020学年高一上学期期中考试化学试题湖南省邵东县创新实验学校2019-2020学年高一上学期期中考试化学试题安徽省萧城一中2020届高三第一次月考化学试题四川省达州市宣汉中学2019—2020学年高一上学期月考化学试题(已下线)【新东方】2019新中心五地018高中化学湖北省荆州市沙市区沙市中学2019-2020学年高一化学过关训练10(物质的分类和离子反应)内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题(已下线)【新东方】2002-36河南省焦作市沁阳市第一中学2019-2020学年高一上学期12月月考化学试题甘肃省兰州市第五十九中学2019-2020学年高一上学期期中考试化学试题湖南省邵东县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)小题必刷11 物质的量浓度与溶液的配制——2021年高考化学一轮复习小题必刷(通用版)人教版(2019)高一必修第一册 第二章 海水中的重要元素 第三节 物质的量吉林省大安市第一中学校2021届高三上学期第二次月考化学试题(已下线)【浙江新东方】11高一必修第一册(苏教2019)专题2 第二单元 溶液组成的定量研究2湖北省利川市第五中学2019年-2020学年高一上学期期中考试化学试题新疆北屯高级中学2020-2021学年高一上学期10月月考化学试题(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)吉林省长春外国语学校2019-2020学年高二下学期期末考试化学(理)试题吉林省白城市第一中学2021-2022学年高一上学期期中考试化学试题吉林省长春市希望高中2021-2022学年高一上学期期中考试化学试题吉林省长春市第二十九中学2021-2022学年高一上学期第二学程考试化学(理)试题四川省成都市石室中学2020-2021学年高一上学期10月阶段性测试化学试题(已下线)专题讲座(一) 化学计算的常用方法(练)-2023年高考化学一轮复习讲练测(全国通用)辽宁省锦州市锦州中学2023届高三上学期9月月考化学试题山东省烟台市第二中学2022-2023学年高一上学期10月月考化学试题河南省信阳市2022-2023学年普通高中高三上学期第一次教学质量检测化学试题福建省晋江市第一中学2021-2022学年高一上学期期中考试化学试题四川省宜宾市第四中学校2022-2023学年高一上学期期中考试化学试题四川省达州天立学校2022-2023学年高一上学期11月月考化学试题(已下线)题型8 利用守恒关系的计算-高考必备50个题型作业(十六) 物质的量浓度的有关计算浙江省杭州市缙云中学等4校2022-2023学年高一上学期12月月考化学试题河南省郑州市第四高级中学2023-2024学年高一上学期第一次月考化学试题
名校
10 . 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是( )
硫酸 化学纯 CP 500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
硫酸 化学纯 CP 500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
| A.该硫酸的物质的量浓度为9.2 mol/L |
| B.1 mol Fe与足量的该硫酸反应产生2 g氢气 |
| C.配制200 mL 4.6 mol/L的硫酸需取该硫酸50 mL |
| D.等质量的水与该硫酸混合后所得溶液的物质的量浓度大于9.2 mol/L |
您最近一年使用:0次
2017-07-13更新
|
262次组卷
|
2卷引用:【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第一次调研考试化学试题



