解题方法
1 . 为探究固体化合物X(含四种短周期元素)的组成和性质,设计并完成如下实验 :

已知 :白色固体A是一种优质的耐高温材料;无色溶液D只含一种溶质且为正盐。
请回答:
(1)白色沉淀C的化学式是_________________ 。
(2)白色固体 A →无色溶液 B 的离子方程式是_____________ 。
(3)X 的化学式是______________ 。

已知 :白色固体A是一种优质的耐高温材料;无色溶液D只含一种溶质且为正盐。
请回答:
(1)白色沉淀C的化学式是
(2)白色固体 A →无色溶液 B 的离子方程式是
(3)X 的化学式是
您最近一年使用:0次
2020-07-24更新
|
567次组卷
|
3卷引用:浙江省2020年7月普通高中学业水平考试化学试题
2 . 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如图:

(1)为提高溶解速率,可以采取的措施有__ (写一条)。
(2)检验碱式碳酸镁是否洗净的操作为___ 。
(3)预氨化过程中有Mg(OH)2沉淀生成,该过程发生反应的离子方程式为___ 。

(1)为提高溶解速率,可以采取的措施有
(2)检验碱式碳酸镁是否洗净的操作为
(3)预氨化过程中有Mg(OH)2沉淀生成,该过程发生反应的离子方程式为
您最近一年使用:0次
2020-03-09更新
|
159次组卷
|
2卷引用:江苏省连云港市2019-2020学年高二学业水平合格性考试模拟试卷(12月) 化学试题
名校
解题方法
3 . 有关物质的转化关系如下图所示。A是生石灰的主要成分,B是一种具有漂白性的无色气体,D是一种常见的无色液体,F是某种补血剂的有效成分,G是一种常见的强酸,H的摩尔质量为72 g·mol-1。

(1)A的化学式为____________ 。
(2)D的电子式为____________ 。
(3)写出反应①的化学方程式:________________________ 。
(4)写出反应②的离子方程式:________________________ 。

(1)A的化学式为
(2)D的电子式为
(3)写出反应①的化学方程式:
(4)写出反应②的离子方程式:
您最近一年使用:0次
2018-04-07更新
|
398次组卷
|
2卷引用:江苏省2018届高三普通高中学业水平测试(必修科目)化学试题
解题方法
4 . A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:

请回答下列问题:
(1)写出A、B和C的化学式:
A____________ ,B____________ ,C____________ 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:____________________________________________________ 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:___________________________________________________ 。
(4)写出由F→H的化学方程式:______________________________ 。

请回答下列问题:
(1)写出A、B和C的化学式:
A
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式:
您最近一年使用:0次
解题方法
5 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。

(1)①的原子结构示意图为_________ 。
(2)③和④两种元素金属性强弱关系是:③______ (填“>”或“<”)④
(3)③和⑥两种元素形成的化合物中含有的化学键为_______ (填“离子键”或“共价键”) 。
(4)④和⑥组成的化合物的水溶液与AgNO3溶液反应的离子方程式为____________ 。

(1)①的原子结构示意图为
(2)③和④两种元素金属性强弱关系是:③
(3)③和⑥两种元素形成的化合物中含有的化学键为
(4)④和⑥组成的化合物的水溶液与AgNO3溶液反应的离子方程式为
您最近一年使用:0次
解题方法
6 . Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和Mn3O4的工艺流程如下:
请回答下列问题:
(1) 几种盐的溶解度见下如图。化肥X的化学式为________ ;为获得固体X,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应________ (填操作名称),再洗涤、干燥晶体。
(2) 检验X样品是否含有氯化物杂质的实验操作是________ 。
(3) 如图是隔绝空气条件煅烧MnSO4·H2O时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:____________________ 。
(4) 为了测定产品中Mn3O4的纯度,取2.500 g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉碘化钾溶液中,稀释至250 mL,从中取25.00 mL用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点时,消耗20.00 mL标准溶液(2Na2S2O3 +I2===2NaI+Na2S4O6)。
① 样品与浓盐酸发生反应的离子方程式为________ 。
② 该样品的纯度为________ 。

请回答下列问题:
(1) 几种盐的溶解度见下如图。化肥X的化学式为
(2) 检验X样品是否含有氯化物杂质的实验操作是
(3) 如图是隔绝空气条件煅烧MnSO4·H2O时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:

(4) 为了测定产品中Mn3O4的纯度,取2.500 g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉碘化钾溶液中,稀释至250 mL,从中取25.00 mL用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点时,消耗20.00 mL标准溶液(2Na2S2O3 +I2===2NaI+Na2S4O6)。
① 样品与浓盐酸发生反应的离子方程式为
② 该样品的纯度为
您最近一年使用:0次
2017-03-16更新
|
371次组卷
|
2卷引用:2016-2017学年江苏省无锡市高二学业水平模拟(十四)化学试卷
解题方法
7 . 下图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全。已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有 效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。
效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。

根据以上信息,回答下列问题:
(1)H的化学式为____________________________ 。
(2)A的电子式___________________________________________ 。
(3)G→J的离子方程式为________________________________________________________________ 。
(4)M是含氧酸盐,化学式为Na2FeO4,则反应①的化学方程式为____________________________________________ 。
 效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。
效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。
根据以上信息,回答下列问题:
(1)H的化学式为
(2)A的电子式
(3)G→J的离子方程式为
(4)M是含氧酸盐,化学式为Na2FeO4,则反应①的化学方程式为
您最近一年使用:0次
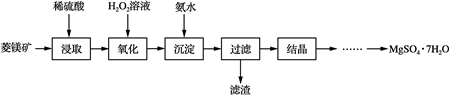
8 . 硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1) “氧化”步骤中,加入H2O2溶液的目的是________ (用离子方程式表示)。“沉淀”步骤中,用氨水调节pH的范围是________ 。
(2) “过滤”所得滤液中含有的阳离子为Mg2+、________ 。
(3) “结晶”步骤中需蒸发浓缩滤液,使用的实验仪器有铁架台(含铁圈)、酒精灯、玻璃棒、____________________ 。
(4) 测定硫酸镁晶体样品中MgSO4·7H2O的含量常采用下列实验方法:
Ⅰ. 称取待测硫酸镁晶体样品1.500 g加入过量的EDTA,配成100 mL pH在9~10之间的溶液A。
Ⅱ. 移取25.00 mL溶液A于锥形瓶中,用0.1000 mol·L-1 Zn2+标准溶液与过量的EDTA反应,消耗Zn2+标准溶液20.00 mL。
Ⅲ. 另移取25.00 mL溶液A于另一只锥形瓶中,调节pH为5~6,用0.100 0 mol·L-1 Zn2+标准溶液与之充分反应,消耗Zn2+标准溶液35.00 mL。
已知:①pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)反应:Mg2++H2Y2-===MgH2Y Zn2++H2Y2-===ZnH2Y
②pH为5~6时,Zn2+除与EDTA反应,还能与MgH2Y反应:Zn2++MgH2Y===ZnH2Y+Mg2+
③样品中杂质不参与反应。
计算硫酸镁晶体样品中MgSO4·7H2O的质量分数________ 。(写出计算过程)。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Mg2+ | Fe2+ | Fe3+ |
| 开始沉淀 | 9.1 | 7.6 | 1.9 |
| 完全沉淀 | 11.1 | 9.7 | 3.2 |
(1) “氧化”步骤中,加入H2O2溶液的目的是
(2) “过滤”所得滤液中含有的阳离子为Mg2+、
(3) “结晶”步骤中需蒸发浓缩滤液,使用的实验仪器有铁架台(含铁圈)、酒精灯、玻璃棒、
(4) 测定硫酸镁晶体样品中MgSO4·7H2O的含量常采用下列实验方法:
Ⅰ. 称取待测硫酸镁晶体样品1.500 g加入过量的EDTA,配成100 mL pH在9~10之间的溶液A。
Ⅱ. 移取25.00 mL溶液A于锥形瓶中,用0.1000 mol·L-1 Zn2+标准溶液与过量的EDTA反应,消耗Zn2+标准溶液20.00 mL。
Ⅲ. 另移取25.00 mL溶液A于另一只锥形瓶中,调节pH为5~6,用0.100 0 mol·L-1 Zn2+标准溶液与之充分反应,消耗Zn2+标准溶液35.00 mL。
已知:①pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)反应:Mg2++H2Y2-===MgH2Y Zn2++H2Y2-===ZnH2Y
②pH为5~6时,Zn2+除与EDTA反应,还能与MgH2Y反应:Zn2++MgH2Y===ZnH2Y+Mg2+
③样品中杂质不参与反应。
计算硫酸镁晶体样品中MgSO4·7H2O的质量分数
您最近一年使用:0次
解题方法
9 . 化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,化学实验室产生的废液必须经处理后才能排放。某化学实验室产生的酸性废液中含有Fe3+、Cu2+、Ba2+三种金属阳离子和Cl-一种阴离子,实验室设计了下述方案对废液进行处理,以回收金属并测定含量,保护环境。
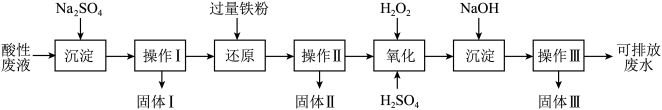
已知实验中处理的酸性废液的体积为1L,用pH计测定出其中H+物质的量浓度为0.10mol/L。
请回答下列问题:
(1)实验中操作I、Ⅱ、Ⅲ的方法相同,操作步骤依次为过滤、_________ 、干燥。
(2)“氧化”步骤所得溶液颜色为棕黄色,该反应的离子方程式为:__________ 。
(3)实验中称量固体I 的质量为4.66g,固体II 的质量为15.2g,用足量的稀硝酸溶解固体Ⅱ后产生了标准状况下的无色气体4.48L,则固体Ⅱ中金属铜的质量为________ g。
(4)实验中将固体Ⅲ进行充分灼烧,使用仪器除了酒精灯、三脚架、泥三角、玻璃棒外,还有_____ (填名称)。最后得到的红棕色固体质量为40.0g,则原溶液中氯离子的物质的量浓度为________ (写出计算过程)。

已知实验中处理的酸性废液的体积为1L,用pH计测定出其中H+物质的量浓度为0.10mol/L。
请回答下列问题:
(1)实验中操作I、Ⅱ、Ⅲ的方法相同,操作步骤依次为过滤、
(2)“氧化”步骤所得溶液颜色为棕黄色,该反应的离子方程式为:
(3)实验中称量固体I 的质量为4.66g,固体II 的质量为15.2g,用足量的稀硝酸溶解固体Ⅱ后产生了标准状况下的无色气体4.48L,则固体Ⅱ中金属铜的质量为
(4)实验中将固体Ⅲ进行充分灼烧,使用仪器除了酒精灯、三脚架、泥三角、玻璃棒外,还有
您最近一年使用:0次
10 . 某学习小组进行了如下课外活动,邀请你参与:
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:
①写出II实验中发生反应的离子方式:________________________ 。
②根据实验发现只要有_________________________ 等物质生成,水溶液中复分解型离子反应就可以发生。
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些______________ 的方向进行(与溶液混合的瞬间相比)。
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对③中的结论作出合理解释:___________________ 。
(2)如何研究H2SO4、KC1、NaHSO4、NaNO3、Na2CO3、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。具体如下:
①根据方案进行分类时,经实验测得KC1、NaNO,溶液的pH=7;H2SO4、NaHSO4、NH4Cl溶液的pH<7; Na2CO3、NaOH溶液的pH>7。由此有的同学按分类法思想把H2SO4、NaHSO4、NH4Cl都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由。_______________ 、___________________ 。
②向NaHSO4、NaNO3的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:_____________________________ 。反应中若生成标准状况下的无色气体1.12L,则被氧化的物质为_____________ mol,转移电子的物质的量为____________ mol。
③某同学在用H2SO4鉴别NaNO3、Na2CO3、NaOH溶液时,Na2CO3很容易鉴别,但鉴别NaNO3和NaOH时却陷入了困境。限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题:_____________________
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:
| 实验设计及操作 | 离子方程式 |
| Ⅰ.向盛有2mLCuSO4溶液的试管里加入2mLNaOH溶液, 观察现象。 |  |
| Ⅱ.向盛有2moLpH=1的HCl溶液的试管里慢慢滴入18mL (已足量)CH3CHHNH4溶液(查资料知CH3COONH4溶液 呈中性)振荡摇匀,测得pH≈3.7 | |
| Ⅲ.向盛有2mLNaHCO3溶液的试管里加入2mLH2SO4溶液, 观察现象 | 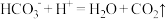 |
| Ⅳ.向盛有2mL稀Na2SO4溶液的事官禄计入2mL稀KCl 溶液,观察无明显现象 |
②根据实验发现只要有
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对③中的结论作出合理解释:
(2)如何研究H2SO4、KC1、NaHSO4、NaNO3、Na2CO3、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。具体如下:
①根据方案进行分类时,经实验测得KC1、NaNO,溶液的pH=7;H2SO4、NaHSO4、NH4Cl溶液的pH<7; Na2CO3、NaOH溶液的pH>7。由此有的同学按分类法思想把H2SO4、NaHSO4、NH4Cl都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由。
②向NaHSO4、NaNO3的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:
③某同学在用H2SO4鉴别NaNO3、Na2CO3、NaOH溶液时,Na2CO3很容易鉴别,但鉴别NaNO3和NaOH时却陷入了困境。限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题:
您最近一年使用:0次
2016-12-09更新
|
427次组卷
|
2卷引用:2016届贵州省遵义市高三上学期第一次联考化学试卷



