1 . 我国C919大飞机制造过程中用到的某些新型材料是以 作催化剂制备的。
作催化剂制备的。 是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用
是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用 溶液与
溶液与 气体制备
气体制备 。回答下列问题:
。回答下列问题:
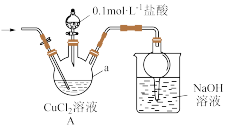
(1)检查装置气密性并加入药品,①打开止水夹先氮气通一段时间,后关闭止水夹;②打开分液漏斗旋塞,向仪器a中加盐酸调pH至2~3,关闭分液漏斗旋塞;③……,溶液中产生白色沉淀;④待反应完全后,再通一段时间。装置A中发生反应的离子方程式为_______ ;仪器a的名称是_______ ;操作③是_______ 。
(2)将装置A中的混合物过滤、洗涤、干燥后密封保存,洗涤时选择的最佳洗涤液是___ (填标号);判断沉淀洗涤干净的实验操作是___ 。
A.蒸馏水 B.稀硫酸 C.95%的乙醇 D.饱和食盐水
(3)测定产品纯度:称取所制备的CuCl产品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用cmol/L的Ce(SO4)2标准溶液滴定至终点,再重复滴定2次,三次平均消耗Ce(SO4)2标准溶液VmL,反应中Ce4+被还原为Ce3+,则样品中CuCl (摩尔质量为Mg/mol)的质量分数为___ 。滴定时Ce(SO4)2标准溶液应盛放在_______ (填“酸式”或“碱式”)滴定管中;下列操作会导致质量分数的测定值偏大的是_______ (填标号)。
A.滴定终点时,仰视读数
B.滴定前锥形瓶用蒸馏水洗净后没有干燥
C.滴定管在滴定前有气泡,滴定后气泡消失
D.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
 作催化剂制备的。
作催化剂制备的。 是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用
是白色粉末,微溶于水、难溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色。某实验小组设计如下装置(夹持装置略),利用 溶液与
溶液与 气体制备
气体制备 。回答下列问题:
。回答下列问题:
(1)检查装置气密性并加入药品,①打开止水夹先氮气通一段时间,后关闭止水夹;②打开分液漏斗旋塞,向仪器a中加盐酸调pH至2~3,关闭分液漏斗旋塞;③……,溶液中产生白色沉淀;④待反应完全后,再通一段时间。装置A中发生反应的离子方程式为
(2)将装置A中的混合物过滤、洗涤、干燥后密封保存,洗涤时选择的最佳洗涤液是
A.蒸馏水 B.稀硫酸 C.95%的乙醇 D.饱和食盐水
(3)测定产品纯度:称取所制备的CuCl产品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,配成250mL溶液。移取25.00mL溶液于锥形瓶中,用cmol/L的Ce(SO4)2标准溶液滴定至终点,再重复滴定2次,三次平均消耗Ce(SO4)2标准溶液VmL,反应中Ce4+被还原为Ce3+,则样品中CuCl (摩尔质量为Mg/mol)的质量分数为
A.滴定终点时,仰视读数
B.滴定前锥形瓶用蒸馏水洗净后没有干燥
C.滴定管在滴定前有气泡,滴定后气泡消失
D.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
您最近一年使用:0次
2 . 从含钴余液(含 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下:
(1)在去除钙、镁时,选择适当加热条件的理由是___________ ;该步骤控制pH是影响除钙镁效果的重要因素,下图是不同pH条件下硫化钴含量和钴收率图,根据图中信息选择最适宜的pH为___________ ;___________ ;
(3)已知P507萃取剂 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大 的萃取率,原因是
的萃取率,原因是___________ ;
(4)反萃取时加入的试剂a应为___________(填代号);
(5)沉钴的离子方程式为___________ ;
(6)系列操作中如何检验 是否洗涤干净
是否洗涤干净___________ ;
(7)空气中煅烧 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下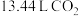 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为___________ 。
 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下: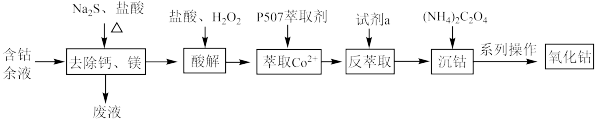
(1)在去除钙、镁时,选择适当加热条件的理由是

(3)已知P507萃取剂
 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大
 的萃取率,原因是
的萃取率,原因是(4)反萃取时加入的试剂a应为___________(填代号);
A. | B.HCl | C.NaOH | D. |
(5)沉钴的离子方程式为
(6)系列操作中如何检验
 是否洗涤干净
是否洗涤干净(7)空气中煅烧
 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下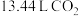 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为
您最近一年使用:0次
解题方法
3 . 碲(Te)广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为Cu2Te,还含有金、银、铂等)回收碲的工艺流程如下:
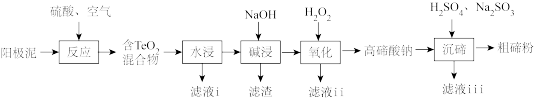
已知:TeO2有强还原性,且TeO2、Cu2TeO4难溶于水;高碲酸钠的化学式:Na2TeO4
回答下列问题:
(1)为提高“反应”效率,可采取的措施为_______ (任答一条)。
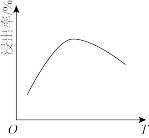
(2)滤液i的主要成分是_______ (写化学式)。滤液i中溶质的浸出率与温度关系如图所示,解释铜的浸出率随温度变化的可能原因_______ 。
(3)“氧化”过程中发生反应的离子方程式为_______ 。滤液ii可循环使用,应将其导入到_______ (写操作单元名称)操作中。
(4)“沉碲”过程中发生反应的离子方程式为_______ 。
(5)粗碲粉中碲质量分数的测定步骤如下:取mg粗碲粉,加入酸使其转化为亚碲酸(H2TeO3),配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入V1mLc1mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。用c2mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,消耗V2mL硫酸亚铁铵标准溶液。该粗碲粉中碲的质量分数为_______ 。

已知:TeO2有强还原性,且TeO2、Cu2TeO4难溶于水;高碲酸钠的化学式:Na2TeO4
回答下列问题:
(1)为提高“反应”效率,可采取的措施为
(2)滤液i的主要成分是

(3)“氧化”过程中发生反应的离子方程式为
(4)“沉碲”过程中发生反应的离子方程式为
(5)粗碲粉中碲质量分数的测定步骤如下:取mg粗碲粉,加入酸使其转化为亚碲酸(H2TeO3),配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入V1mLc1mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。用c2mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,消耗V2mL硫酸亚铁铵标准溶液。该粗碲粉中碲的质量分数为
您最近一年使用:0次
解题方法
4 . 金属钌在电子制造、化学工业及催化剂生产等行业中有关键作用,六氯钌酸铵[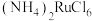 ]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
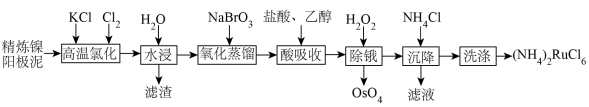
已知:六氯钌酸铵在冷水、乙醇中的溶解度较小。
回答下列问题:
(1)“高温氯化”后得到 、
、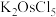 ,
,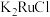 。
。 中Ru元素的化合价为
中Ru元素的化合价为___________ ,生成 的化学方程式为
的化学方程式为___________ 。
(2)“氧化蒸馏”过程中蒸出 、
、 ,生成
,生成 的离子方程式为
的离子方程式为___________ 。
(3)“酸吸收”过程中加入乙醇的作用是___________ 。
(4)“除锇”过程中元素钌化合价不变,溶液的主要成分为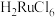 ,溶液中存在
,溶液中存在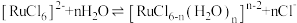
 ,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有
,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有___________ 。
(5)检验滤液中主要阴离子的实验方法是___________ ,“洗涤”时最合适的试剂为___________ 。
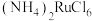 ]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
已知:六氯钌酸铵在冷水、乙醇中的溶解度较小。
回答下列问题:
(1)“高温氯化”后得到
 、
、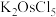 ,
,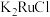 。
。 中Ru元素的化合价为
中Ru元素的化合价为 的化学方程式为
的化学方程式为(2)“氧化蒸馏”过程中蒸出
 、
、 ,生成
,生成 的离子方程式为
的离子方程式为(3)“酸吸收”过程中加入乙醇的作用是
(4)“除锇”过程中元素钌化合价不变,溶液的主要成分为
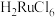 ,溶液中存在
,溶液中存在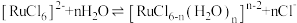
 ,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有
,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有(5)检验滤液中主要阴离子的实验方法是
您最近一年使用:0次
名校
解题方法
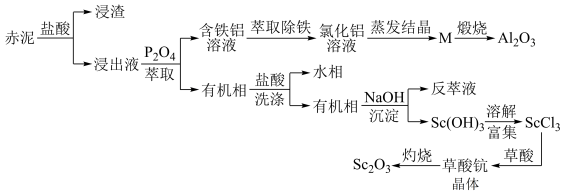
5 . 工业上以赤泥[主要成分是Sc2O3,另含有少量Fe2O3、SiO2(不溶于酸)、Al2O3等]为主要原料提取氧化钪,其工艺流程如图所示(P2O4是一种磷酸酯萃取剂,草酸化学式为H2C2O4)。
回答下列问题:
(1)赤泥经盐酸处理后所得“浸渣”主要成分为____ (化学式)。
(2)赤泥“盐酸酸浸”时不宜温度过高,原因是____ 。
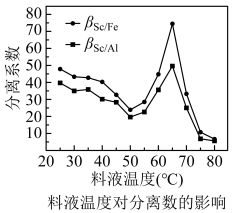
(3)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如表所示,萃取时P2O4最佳浓度及料液温度分别为____ 、____ ;
P2O4浓度对萃取率的影响如表:
料液温度对分离系数的影响如图:
(4)M经煅烧后可得到Al2O3,则M成分为____ 。
(5)为探究所得草酸钪晶体Sc2(C2O4)3·xH2O中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69gSc2O3固体,则x=____ 。
(6)草酸钪晶体在空气中灼烧分解反应方程式为____ 。

回答下列问题:
(1)赤泥经盐酸处理后所得“浸渣”主要成分为
(2)赤泥“盐酸酸浸”时不宜温度过高,原因是
(3)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如表所示,萃取时P2O4最佳浓度及料液温度分别为
P2O4浓度对萃取率的影响如表:
试验编号 | P2O4浓度/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
1-1 | 1 | 分相快 | 90.76 | 15.82 |
1-2 | 2 | 分相容易 | 91.53 | 19.23 |
1-3 | 3 | 分相容易 | 92.98 | 13.56 |
1-4 | 4 | 有第三相 | 90.69 | 30.12 |
1-5 | 5 | 轻微乳化 | 91.74 | 39.79 |
料液温度对分离系数的影响如图:

(4)M经煅烧后可得到Al2O3,则M成分为
(5)为探究所得草酸钪晶体Sc2(C2O4)3·xH2O中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69gSc2O3固体,则x=
(6)草酸钪晶体在空气中灼烧分解反应方程式为
您最近一年使用:0次
解题方法
6 . 碳酸锶( )常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量
)常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量 、
、 、
、 、
、 等)制备高纯碳酸锶的工艺流程如下:
等)制备高纯碳酸锶的工艺流程如下:
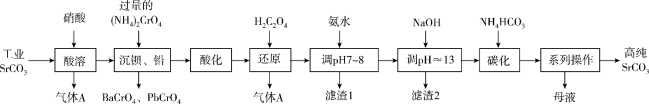
已知:I. 为两性氢氧化物;
为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的化学式为_______ ;基态Cr原子的价层电子排布图为_______ 。
(2)酸溶时为了加快酸溶速率,可适当升高温度,但升温度又不能过高的原因是_______ 。
(3)“系列操作”是煮沸并趁热过滤、_______ 。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ (用化学方程式回答)。
(5)“调pH≈13”后,需对溶液进行煮沸并趁热过滤出“滤渣2”,“滤渣2”的主要成分为_______ (填化学式);要煮沸并趁热过滤的目的是_______ 。
(6)“还原”时含Cr微粒发生反应的离子方程式为_______ 。
(7)“碳化”时,实际所用 的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
_______ t(保留到小数点后两位)。
 )常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量
)常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量 、
、 、
、 、
、 等)制备高纯碳酸锶的工艺流程如下:
等)制备高纯碳酸锶的工艺流程如下:
已知:I.
 为两性氢氧化物;
为两性氢氧化物;II.常温下,各物质的溶度积常数如下表所示。
| 化合物 |  |  |  |  |
 近似值 近似值 | 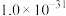 | 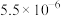 | 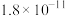 | 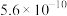 |
(1)气体A的化学式为
(2)酸溶时为了加快酸溶速率,可适当升高温度,但升温度又不能过高的原因是
(3)“系列操作”是煮沸并趁热过滤、
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH≈13”后,需对溶液进行煮沸并趁热过滤出“滤渣2”,“滤渣2”的主要成分为
(6)“还原”时含Cr微粒发生反应的离子方程式为
(7)“碳化”时,实际所用
 的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
您最近一年使用:0次
解题方法
7 . 化学正在走向精准。当代化学的三大支柱是:理论、实验和计算。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。______
Ⅱ.某硫铜矿的主要成分为 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):
步骤1:在1.00g试样中加入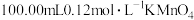 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用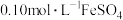 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数______ 。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为
 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。Ⅱ.某硫铜矿的主要成分为
 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):步骤1:在1.00g试样中加入
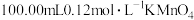 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用
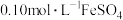 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数
您最近一年使用:0次
名校
解题方法
8 . 位于3个不同短周期的6种主族元素W、R、Q、X、Y、Z,原子序数依次增大,R为地壳中含量最丰富的元素,W与Q、R与Y分别同主族,X为同周期的简单离子中半径最小的元素。回答下列问题:
(1)请写出元素符号:W为_______ 、R为_______ 、Q为_______ 。
(2)Q、X的最高价氧化物对应水化物之间能发生反应,其离子方程式为_______ 。
(3)实验室制备Z单质的化学方程式:_______ 。
(4)常见化合物甲、乙均含W、R、Q、Y四种元素,则甲、乙两溶液反应的离子方程式为:_______ 。
(5) 和
和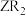 均可作自来水消毒剂,且消毒时还原产物均为Z-,则与8.7g
均可作自来水消毒剂,且消毒时还原产物均为Z-,则与8.7g 的氧化能力相当的
的氧化能力相当的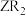 的质量为
的质量为_______ g。
(6)溶液丙 与溶液丁(QRW),两种溶液等体积混合后,沉淀物中含X元素的质量是溶液中含X元素的质量的一半,则丙、丁两种溶液物质的量浓度之比可能为
与溶液丁(QRW),两种溶液等体积混合后,沉淀物中含X元素的质量是溶液中含X元素的质量的一半,则丙、丁两种溶液物质的量浓度之比可能为_______ 。
①1∶1 ②2∶3 ③3∶10 ④3∶11
(1)请写出元素符号:W为
(2)Q、X的最高价氧化物对应水化物之间能发生反应,其离子方程式为
(3)实验室制备Z单质的化学方程式:
(4)常见化合物甲、乙均含W、R、Q、Y四种元素,则甲、乙两溶液反应的离子方程式为:
(5)
 和
和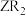 均可作自来水消毒剂,且消毒时还原产物均为Z-,则与8.7g
均可作自来水消毒剂,且消毒时还原产物均为Z-,则与8.7g 的氧化能力相当的
的氧化能力相当的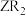 的质量为
的质量为(6)溶液丙
 与溶液丁(QRW),两种溶液等体积混合后,沉淀物中含X元素的质量是溶液中含X元素的质量的一半,则丙、丁两种溶液物质的量浓度之比可能为
与溶液丁(QRW),两种溶液等体积混合后,沉淀物中含X元素的质量是溶液中含X元素的质量的一半,则丙、丁两种溶液物质的量浓度之比可能为①1∶1 ②2∶3 ③3∶10 ④3∶11
您最近一年使用:0次
2022-03-17更新
|
761次组卷
|
2卷引用:福建省龙岩第一中学2021-2022学年高一下学期第二次月考化学试题
解题方法
9 . 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4。回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为___ 。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为___ 。
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少___ ?
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值___ 、___ 。
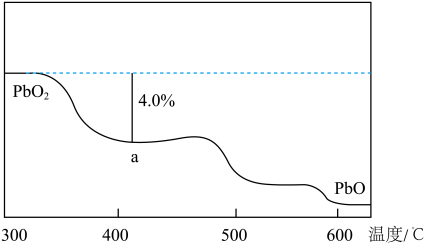
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值

您最近一年使用:0次
解题方法
10 . 卡尔-费休(Karl-Fischer) 法是测定有机溶剂中的微量水含量的经典方法。所用试剂由碘、二氧化硫、吡啶(C5H5N,有机碱,与H+反应生成C5H5NH+)和无水甲醇按一定比例配制而成。该试剂与待测溶剂中的水反应后,产物的含量用库仑滴定法来测定。
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为___________ 。
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是___________ 。
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:___________ 。。
(4)测定20.0 mL有机溶剂含水量____ 。库仑滴定时,以24.8 mA恒定电流通电302s时达到反应终点(电极反应: 2I-- 2e = I2)。求该有机溶剂的含水量(mg·L-1) ____ 。已知: 1 mol电子的电量为9.65× 104C,电量计算公式Q=It
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:
(4)测定20.0 mL有机溶剂含水量
您最近一年使用:0次



