解题方法
1 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
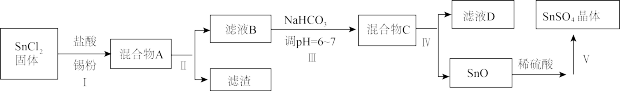
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
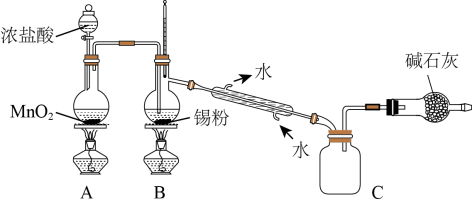
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
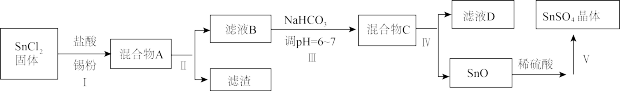
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近一年使用:0次
2016-12-09更新
|
257次组卷
|
4卷引用:2015届天津市河西区高三下学期总复习质量调查(二)化学试卷
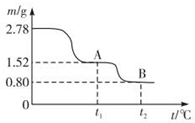
2 . 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中煅烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
(1)绿矾油主要成份的化学式为_________ .t1~t2.发生反应的化学方程式为_________________ .
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为_________ .
(3)以下是FeSO4•7H2O的实验室制备流理图.
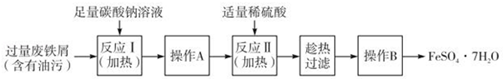
根据题意完成下列填空:
①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及____________ .
②操作A的名称为_____________ .
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为_______________ ,计算上述样品中FeSO4•7H2O的质量分数为_________ (保留两位有效数字).
(1)绿矾油主要成份的化学式为
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为
(3)以下是FeSO4•7H2O的实验室制备流理图.

根据题意完成下列填空:

①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及
②操作A的名称为
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为
您最近一年使用:0次
3 . 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3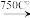 2NaAlO2 +CO2↑;
2NaAlO2 +CO2↑;
③Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是_____ 。
(2)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr207 + 2KCl=K2Cr2O7 ↓+ 2NaCl,该反应在溶液中能发生的理由是_____
(3)操作III有多步组成,获得K2Cr2O7晶体的操作依次是:加入KC1固体、蒸发浓缩、_____ 、过滤、_____ 、干燥。
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量_____ (填写试剂)、溶解、过滤、再通入足量_____ 气体.......灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为_____ (用含m、n的代数式表示)。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min。然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2SO3标准溶液滴定若实验中共用去Na2S2O3标准溶液47.40mL,则所得产品中重铬酸钾的纯度为_____ 。(保留3位有效数字)
已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O +6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O =2I-+S4O
=2I-+S4O
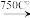 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;②Na2CO3+Al2O3
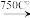 2NaAlO2 +CO2↑;
2NaAlO2 +CO2↑;③Cr2O72-+H2O
 2CrO42-+2H+
2CrO42-+2H+根据题意回答下列问题:
(1)操作I的名称是
(2)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr207 + 2KCl=K2Cr2O7 ↓+ 2NaCl,该反应在溶液中能发生的理由是
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g 水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
(3)操作III有多步组成,获得K2Cr2O7晶体的操作依次是:加入KC1固体、蒸发浓缩、
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min。然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2SO3标准溶液滴定若实验中共用去Na2S2O3标准溶液47.40mL,则所得产品中重铬酸钾的纯度为
已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O =2I-+S4O
=2I-+S4O
您最近一年使用:0次
2016-12-09更新
|
801次组卷
|
3卷引用:2014-2015江苏省宿迁市高二下学期学业水平模拟化学试卷
2014-2015江苏省宿迁市高二下学期学业水平模拟化学试卷江苏省常州市联盟学校2022-2023学年高一下学期期末考试化学试题(已下线)综合期末压轴85+18题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)
13-14高三上·上海·期中
4 . 闪锌矿(主要成分为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是_________ 。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是________ 。
(3)若将ZnS溶于强酸可产生硫化氢气体。在120℃、1 atm下,将100 mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70 mL,求原混合气体中硫化氢的体积分数_________ 。(不考虑硫化氢气体自身受热分解)
(4)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量________ 。
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是
(3)若将ZnS溶于强酸可产生硫化氢气体。在120℃、1 atm下,将100 mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70 mL,求原混合气体中硫化氢的体积分数
(4)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量
您最近一年使用:0次
名校
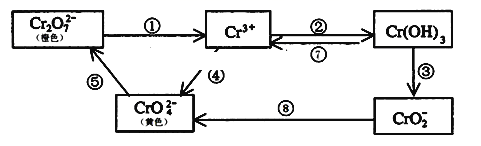
5 . 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
完成下列填空:
(1)溶液配制:称取一定量纯净的K2Cr2O7晶体配制100ml标准溶液,用蒸馏水完全溶解后,全部转移至_____ 中,加蒸馏水离刻度线1---2厘米处,改用__________ 加水至刻度线。
(2)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
___ Cr2O72-+___ Fe3O4 +__ H+ →__ Cr3+ +__ Fe3+ +__ H2O
(3)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极___________ ,阴极_______________________ ;用铁做阳极的目的是:_____________________ 。
(4)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:____________ 。
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________ (保留四位有效数字)。
完成下列填空:
(1)溶液配制:称取一定量纯净的K2Cr2O7晶体配制100ml标准溶液,用蒸馏水完全溶解后,全部转移至
(2)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
(3)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极
(4)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为
您最近一年使用:0次
2017-11-02更新
|
640次组卷
|
3卷引用:四川省绵阳市2018届高三一诊模拟(四)化学试题
解题方法
6 . 一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)nC16-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
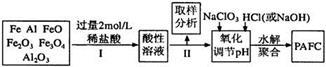
请回答下列问题:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有_________ 。
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)下列关于PAFC的说法中正确的有( )
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水电离出OH—,是碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是( )
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式为______________________ 。
(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有_______________ 。
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6)在测定过程中的操作顺序是: 过滤、___________ 、灼烧、_________ 、称量。(写操作名称)。
(7)测定时,直接称量的是____________ 和_____________ 的质量(填化学式)。

请回答下列问题:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)下列关于PAFC的说法中正确的有
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水电离出OH—,是碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式为
(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6)在测定过程中的操作顺序是: 过滤、
(7)测定时,直接称量的是
您最近一年使用:0次
解题方法
7 . 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质。以铬铁矿为原料制备重铬酸钾(K2Cr2O7)、重铬酸钠(Na2Cr2O7)的过程如下图所示。
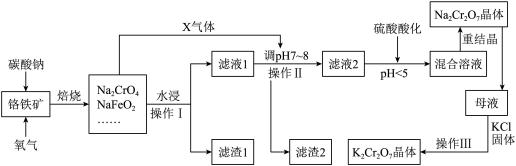
已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O 2CrO42- + 2H+。
2CrO42- + 2H+。
请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有__________ (填化学式)
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式_____________________ 。
(2)“焙烧”过程中,所产生X气体的电子式为_________________________ 。
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):_____ ;_____ 。
(4)滤渣1的主要成分是_______________ 。若要进一步分离滤渣2 中的可酸溶成分,请写出酸溶时发生反应的离子方程式_________________________________________ 。
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质__________ (填化学式)的含量。
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是____________ 、__________ 、过滤、75%乙醇水溶液洗涤、干燥。

已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O
 2CrO42- + 2H+。
2CrO42- + 2H+。请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式
(2)“焙烧”过程中,所产生X气体的电子式为
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):
(4)滤渣1的主要成分是
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是
您最近一年使用:0次
13-14高三下·浙江·阶段练习
解题方法
8 . 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置_______ 。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为_________ 。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______________ 。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器_____ (填“能”或“不能”)用来腌制咸菜,原因是__________ 。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________ 。关于该电池的下列说法,正确的是_______

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:_________________

X | Y | Z | |
W |
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:

您最近一年使用:0次
9 . 碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1) 实验室中制取少量碘可采用如下方法:KI + CuSO4 → A (白色)↓+ K2SO4 + I2。16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式:_______ 。工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3反应后生成碘,写出此反应的离子方程式:_______ 。
(2)单质碘与氟气反应可得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O⇌H3O++ OH-),生成的阳离子为_______ ;阴离子为_______ 。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体,此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出上述实验过程中发生的化学反应方程式:_______ ,_______ 。
(4) 某化学课外小组用海带为原料制得少量含碘离子的溶液。现用0.10 mol·L-1的酸性高锰酸钾溶液滴定20.00 mL该溶液需10.25 mL,则该溶液中碘离子的浓度为_______ mol·L-1(精确到0.01)。
(5) I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HCl等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式:_______ 。
(1) 实验室中制取少量碘可采用如下方法:KI + CuSO4 → A (白色)↓+ K2SO4 + I2。16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式:
(2)单质碘与氟气反应可得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O⇌H3O++ OH-),生成的阳离子为
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体,此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出上述实验过程中发生的化学反应方程式:
(4) 某化学课外小组用海带为原料制得少量含碘离子的溶液。现用0.10 mol·L-1的酸性高锰酸钾溶液滴定20.00 mL该溶液需10.25 mL,则该溶液中碘离子的浓度为
(5) I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HCl等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式:
您最近一年使用:0次
10 . 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
写出由磷酸钙矿制取白磷总的反应方程式____________ 。
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体________ (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在________ 之间(已知磷酸的各级电离常数为:K1 = 7.1×10−3 K2 = 6.3×10−8 K3 =4.2×10−13 lg7.1≈0.9 lg6.3≈0.8 lg4.2≈0.6) 。Na2HPO4溶液显碱性,若向其溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________________ (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O= 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是_________ 。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
写出由磷酸钙矿制取白磷总的反应方程式
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O= 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是
您最近一年使用:0次



