解题方法
1 . 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4。回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为___ 。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为___ 。
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少___ ?
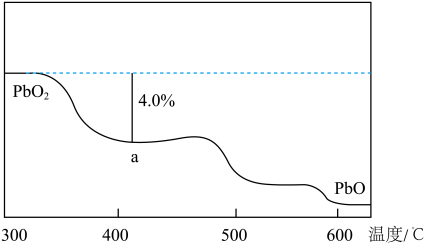
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值___ 、___ 。
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值

您最近一年使用:0次
2014·上海杨浦·三模
2 . 氯、磷的化合物广泛用于农药、医药、染料等领域。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是___ ;已知X的相对分子质量为153.5,则X的化学式为___ 。
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2___ mol,气体的体积将变为___ mL。
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数___ (保留4位有效数字)。
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量___ ;
②滤液中溶质的物质的量浓度___ 。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量
②滤液中溶质的物质的量浓度
您最近一年使用:0次
解题方法
3 . 向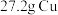 和
和 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸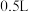 ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下 和
和 的混合气体及
的混合气体及 。在所得溶液中加入
。在所得溶液中加入 的NaOH溶液
的NaOH溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列有关说法正确的是
。下列有关说法正确的是
①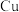 与
与 的物质的量之比为
的物质的量之比为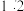
②硝酸的物质的量浓度为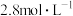
③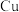 、
、 与硝酸反应后剩余
与硝酸反应后剩余 为
为
④产生的 的体积为
的体积为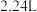
⑤原混合物中Cu的质量分数为
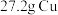 和
和 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸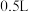 ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下 和
和 的混合气体及
的混合气体及 。在所得溶液中加入
。在所得溶液中加入 的NaOH溶液
的NaOH溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列有关说法正确的是
。下列有关说法正确的是①
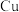 与
与 的物质的量之比为
的物质的量之比为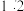
②硝酸的物质的量浓度为
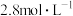
③
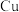 、
、 与硝酸反应后剩余
与硝酸反应后剩余 为
为
④产生的
 的体积为
的体积为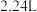
⑤原混合物中Cu的质量分数为

| A.①⑤ | B.②④ | C.①④ | D.②③ |
您最近一年使用:0次
2020-01-26更新
|
3131次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——硝酸的性质及应用(强化练)
4 . 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:
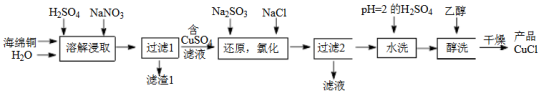
(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是___________ 。
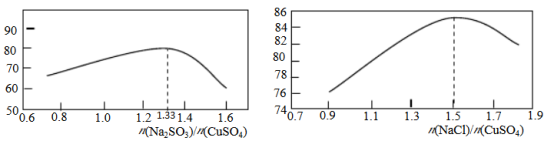
(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___________ 。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___________ 。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是___________ 。
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响___________ 。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为______________________ 。
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为______________________ 。

(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是

(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为
您最近一年使用:0次
5 . [化学-选修2:化学与技术]
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:

A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E.净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______ ,循环使用的|原料是______ ,配制工作液时采用有机溶剂而不采用水的原因是______ 。
(2)氢化釜A中反应的化学方程式为_______ ,进入氧化塔C的反应混合液中的主要溶质为_______ 。
(3)萃取塔D中的萃取剂是____ ,选择其作萃取剂的原因是______ 。
(4)工作液再生装置F中要除净残留的H2O2,原因是______ 。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______ 。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______ mol/L。
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:

A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E.净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是
(2)氢化釜A中反应的化学方程式为
(3)萃取塔D中的萃取剂是
(4)工作液再生装置F中要除净残留的H2O2,原因是
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
2857次组卷
|
5卷引用:2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)
6 . 用磷铁渣(含Fe、FeP、Fe2P及少量杂质)制备FePO4·2H2O(磷酸铁)的工艺流程如下:
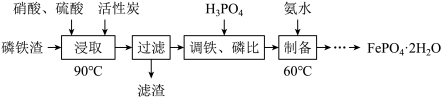
(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为__________ 。
②加入硫酸的目的是__________ ;加入活性炭能降低有害气体的产生,这是因为__________ 。
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是__________
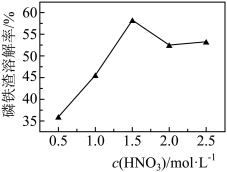 图-1
图-1
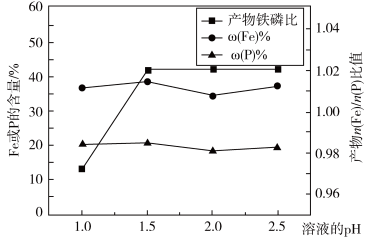 图-2
图-2
(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是___________ ;写出生成FePO4·2H2O的离子方程式:__________________________ 。

(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为
②加入硫酸的目的是
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是
 图-1
图-1 图-2
图-2(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是
您最近一年使用:0次
7 . I.在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中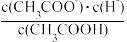
_______ (填“增大”、“减小”或“不变”);溶液中各微粒浓度由大到小的顺序为:_______
(2)常温下,向20 ml0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液40 mL,溶液中含碳元素的微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如下:
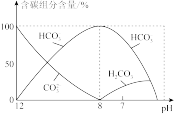
回答下列问题:
①所得溶液中含量最多的三种微粒的物质的量浓度的大小关系为_______
②已知在25℃时,CO 水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO
水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=_______ 。
Ⅱ.金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O 废水的方法如下:
废水的方法如下:
(1)向含Cr2O 的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:
的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:_______ 。
(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为_______ mol/L(已知25℃时,Ksp[Cr(OH) 3]=6.3×10-31)。
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O ,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度
,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度_______ (单位:mg/L,写出计算过程)。 已知测定过程中发生的反应如下:
①2Cr3++3S2O +7H2O= Cr2O
+7H2O= Cr2O +6SO
+6SO +14H+
+14H+
②Cr2O +6I-+14H+=2Cr3++3I2+7H2O
+6I-+14H+=2Cr3++3I2+7H2O
③I2+ S2O = 2I-+ S4O
= 2I-+ S4O
(1)一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中
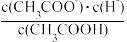
(2)常温下,向20 ml0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液40 mL,溶液中含碳元素的微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如下:

回答下列问题:
①所得溶液中含量最多的三种微粒的物质的量浓度的大小关系为
②已知在25℃时,CO
 水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO
水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=Ⅱ.金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O
 废水的方法如下:
废水的方法如下:(1)向含Cr2O
 的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:
的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O
 ,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度
,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度①2Cr3++3S2O
 +7H2O= Cr2O
+7H2O= Cr2O +6SO
+6SO +14H+
+14H+②Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O
+6I-+14H+=2Cr3++3I2+7H2O③I2+ S2O
 = 2I-+ S4O
= 2I-+ S4O
您最近一年使用:0次
名校
8 . 5.76 g部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO),经如下处理,下列说法正确的是
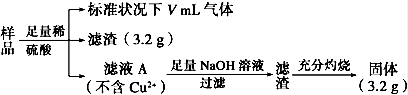

| A.V=224 |
| B.样品中Fe的质量为2.14 g |
| C.未氧化前Fe元素的质量分数约为41.2% |
| D.样品中CuO的质量为3.52 g |
您最近一年使用:0次
解题方法
9 . 某废水中含有 和
和 等离子,需经污水处理达标后才能排放,污水处理拟采用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理拟采用下列流程进行处理:

回答下列问题:
(1)步骤②中, 被
被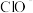 氧化为
氧化为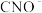 的离子方程式为
的离子方程式为________________ 。
(2)步骤③的反应的离子方程式为 (未配平),每消耗0.4mol
(未配平),每消耗0.4mol  时,反应中
时,反应中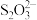 失去
失去_________ mol电子。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是________________ 。
(4)在25℃下,将amol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示 的水解常数Kh=
的水解常数Kh=_______ mol·L-1。若25℃时将浓度均为0.1mol·L-1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是_______ (填代号)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)利用 测定某SnCl2的纯度(杂质不参与反应,溶液中Sn4+较为稳定):将
测定某SnCl2的纯度(杂质不参与反应,溶液中Sn4+较为稳定):将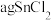 样品制成溶液的操作为
样品制成溶液的操作为________________ ,向得到的SnCl2溶液中加入过量的FeCl3溶液,用bmol·L-l 滴定生成的Fe2+(已知酸性环境下,
滴定生成的Fe2+(已知酸性环境下, 可被还原为Cr3+),共用去
可被还原为Cr3+),共用去 溶液xmL.则样品中SnCl2的的质量分数是
溶液xmL.则样品中SnCl2的的质量分数是_________ 。(SnCl2的摩尔质量为M g·mol-1,用含a、b、x、M的代数式表示)
 和
和 等离子,需经污水处理达标后才能排放,污水处理拟采用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理拟采用下列流程进行处理:
回答下列问题:
(1)步骤②中,
 被
被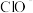 氧化为
氧化为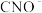 的离子方程式为
的离子方程式为(2)步骤③的反应的离子方程式为
 (未配平),每消耗0.4mol
(未配平),每消耗0.4mol  时,反应中
时,反应中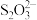 失去
失去(3)含Cr3+废水可以加入熟石灰进一步处理,目的是
(4)在25℃下,将amol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示
 的水解常数Kh=
的水解常数Kh=a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)利用
 测定某SnCl2的纯度(杂质不参与反应,溶液中Sn4+较为稳定):将
测定某SnCl2的纯度(杂质不参与反应,溶液中Sn4+较为稳定):将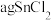 样品制成溶液的操作为
样品制成溶液的操作为 滴定生成的Fe2+(已知酸性环境下,
滴定生成的Fe2+(已知酸性环境下, 可被还原为Cr3+),共用去
可被还原为Cr3+),共用去 溶液xmL.则样品中SnCl2的的质量分数是
溶液xmL.则样品中SnCl2的的质量分数是
您最近一年使用:0次
10 . 将23.9 g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100 mL一定浓度的硝酸中,充分反应后,硝酸被还原成NO2和NO,反应后溶液中H+的物质的量为0.160 mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4 g蓝色固体。
(1)铜片中单质铜的质量分数为__________。
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前后溶液的体积不变)为_______。
(1)铜片中单质铜的质量分数为__________。
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前后溶液的体积不变)为_______。
您最近一年使用:0次



