名校
1 . 某工厂废渣的主要成分为ZnO、PbO、 、CuO、
、CuO、 等(
等( 与
与 性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
(1)“焙烧”产生的气体是___________ (填分子式),该气体的用途是___________ (填一条),若 发生反应,则转移
发生反应,则转移___________  (Bi元素转化为
(Bi元素转化为 )。
)。
(2)“氨浸”所得滤液1中的阳离子主要成分为 、
、 ,该步骤温度不宜过高,其原因是
,该步骤温度不宜过高,其原因是___________ ,“沉铜”时发生反应的离子方程式为___________ 。
(3)“滤渣4”的主要成分为___________ (填化学式)。
(4)“滤液3”的主要溶质为 ,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为
,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为___________ 。
(5)“转化”时生成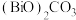 的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为
的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为___________ 。
(6)铁酸铋具有铁电性和反铁磁性,其晶胞结构如图所示,晶胞参数为apm。___________ 。
②该晶体的密度=___________  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、CuO、
、CuO、 等(
等( 与
与 性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
(1)“焙烧”产生的气体是
 发生反应,则转移
发生反应,则转移 (Bi元素转化为
(Bi元素转化为 )。
)。(2)“氨浸”所得滤液1中的阳离子主要成分为
 、
、 ,该步骤温度不宜过高,其原因是
,该步骤温度不宜过高,其原因是(3)“滤渣4”的主要成分为
(4)“滤液3”的主要溶质为
 ,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为
,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为(5)“转化”时生成
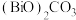 的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为
的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为(6)铁酸铋具有铁电性和反铁磁性,其晶胞结构如图所示,晶胞参数为apm。

②该晶体的密度=
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
23-24高三下·陕西西安·阶段练习
2 . SrCO3可用于生产纳米材料,常温下,以天青石矿(主要成分为SrSO4,含少量CaCO3、MgCO3、ZnCO3、Al2O3、Fe2O3及FeO等杂质)为原料制备SrCO3的流程如下: 、
、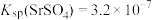 。
。
②该工艺条件下,有关金属离子开始沉淀和完全沉淀以及部分离子的氢氧化物开始溶解的pH见下表:
(1)“盐浸”时,为了提高锶的浸取率可以采取的措施是_______ (写一条即可),采用适当浓度Na2CO3溶液盐浸的目的是_______ (用离子方程式表示)。
(2)“酸浸”时加入H2O2的目的是_______ (用离子方程式表示)。
(3)“第一次调pH”时,需要调pH的范围是_______ ,当Al3+刚好完全沉淀时,溶液中Fe3+的浓度为_______ mol·L-1。
(4)“第三次调pH至12.5”后,需对反应液在95℃水浴中加热,并趁热过滤出“滤渣3”,趁热过滤的目的是_______ 。
(5)“沉锶”时,主要反应的离子方程式为_______ 。
(6)“系列操作”包括_______ (填操作名称)。

 、
、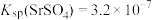 。
。②该工艺条件下,有关金属离子开始沉淀和完全沉淀以及部分离子的氢氧化物开始溶解的pH见下表:
| 金属离子 | Fe3+ | Al3+ | Zn2+ | Mg2+ |
| 开始沉淀的pH(c=1×10-2mol·L-1) | 2.1 | 4.2 | 6.0 | 10.4 |
| 完全沉淀的pH(c=1×10-5mol·L-1) | 4.1 | 5.2 | 8.0 | 12.4 |
| 氢氧化物沉淀开始溶解的pH | - | 7.8 | 10.05 | - |
(1)“盐浸”时,为了提高锶的浸取率可以采取的措施是
(2)“酸浸”时加入H2O2的目的是
(3)“第一次调pH”时,需要调pH的范围是
(4)“第三次调pH至12.5”后,需对反应液在95℃水浴中加热,并趁热过滤出“滤渣3”,趁热过滤的目的是
(5)“沉锶”时,主要反应的离子方程式为
(6)“系列操作”包括
您最近一年使用:0次
3 . 锰是生产各种合金的重要元素。工业上以含锰矿石(主要成分为 ,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
表一
表二
回答下列问题:
(1)用硫酸浸取含锰矿石时,提高浸取速率的方法有_______ (写两种)。
(2)“氧化”步骤发生反应的离子方程式为_______ 。
(3)滤渣1的主要成分是_______ ,实验室中为了加快固液混合物的分离,常采用的操作是_______ 。
(4)有同学提出,加入(NH4)2S除钴、除镍的步骤可以放在“除杂1”之前,你是否赞同?请说明理由:_______ 。
(5)由 晶体制备CuCl2的方法是
晶体制备CuCl2的方法是_______ 。
(6)25℃时,分离出滤渣3所得的滤液中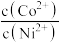 =
=_______ ,欲使沉钴后的溶液中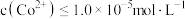 ,需要控制溶液的pH至少为
,需要控制溶液的pH至少为_______ 。(已知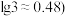
(7)电解废液中还含有少量Mn2+,向其中加入饱和N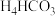 溶液,有沉淀和气体生成,该反应的离子方程式为
溶液,有沉淀和气体生成,该反应的离子方程式为_______ 。
 ,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
表一
| 物质 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 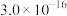 | 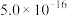 |  | 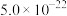 | 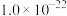 |
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)用硫酸浸取含锰矿石时,提高浸取速率的方法有
(2)“氧化”步骤发生反应的离子方程式为
(3)滤渣1的主要成分是
(4)有同学提出,加入(NH4)2S除钴、除镍的步骤可以放在“除杂1”之前,你是否赞同?请说明理由:
(5)由
 晶体制备CuCl2的方法是
晶体制备CuCl2的方法是(6)25℃时,分离出滤渣3所得的滤液中
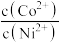 =
=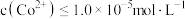 ,需要控制溶液的pH至少为
,需要控制溶液的pH至少为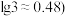
(7)电解废液中还含有少量Mn2+,向其中加入饱和N
 溶液,有沉淀和气体生成,该反应的离子方程式为
溶液,有沉淀和气体生成,该反应的离子方程式为
您最近一年使用:0次
2024-05-07更新
|
67次组卷
|
2卷引用:湖北省普通高中2024届高三下学期高考押题预测卷化学试题
名校
解题方法
4 . 铅酸蓄电池由于其技术成熟、安全性高、电压稳定及价格低廉等优势,在电池市场占据主导地位。以方铅可矿(PbS,含少量 )为原料制取
)为原料制取 的流程如图所示:
的流程如图所示:
(1)“酸浸”时温度一般控制在65~90℃,理由是___________ ,酸浸时发生反应的离子方程式为___________ 。
(2)从“酸浸”所得滤渣中回收的 ,可用于
,可用于___________ (任写两种)。
(3)“氧化”时参加反应的氧化剂与还原剂的物质的量之比为___________ 。
(4)若以100kg方铅矿(PbS的质量分数为70%)为原料,最终制得 59.75kg(假设反应过程中Pb无损失),则
59.75kg(假设反应过程中Pb无损失),则 的产率(产率
的产率(产率 )为
)为___________ (保留一位小数)。
(5)铅酸蓄电池为可充电电池,充放电时反应为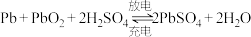 。
。
①放电时 电极的电极反应式为
电极的电极反应式为___________ 。
②充电时 电极发生
电极发生___________ (填“氧化”或“还原”)反应。
 )为原料制取
)为原料制取 的流程如图所示:
的流程如图所示: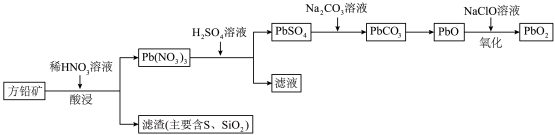
(1)“酸浸”时温度一般控制在65~90℃,理由是
(2)从“酸浸”所得滤渣中回收的
 ,可用于
,可用于(3)“氧化”时参加反应的氧化剂与还原剂的物质的量之比为
(4)若以100kg方铅矿(PbS的质量分数为70%)为原料,最终制得
 59.75kg(假设反应过程中Pb无损失),则
59.75kg(假设反应过程中Pb无损失),则 的产率(产率
的产率(产率 )为
)为(5)铅酸蓄电池为可充电电池,充放电时反应为
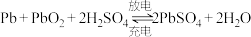 。
。①放电时
 电极的电极反应式为
电极的电极反应式为②充电时
 电极发生
电极发生
您最近一年使用:0次
2024-05-07更新
|
111次组卷
|
2卷引用:安徽省太和中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
5 .  俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:
俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:
(1)亚硫酸钠法:
①需用除氧蒸馏水配制亚硫酸钠溶液。研细硫粉,用___________ 润湿后加入 溶液中,水浴加热后再经重结晶精制。
溶液中,水浴加热后再经重结晶精制。
②若未用除氧蒸馏水配制亚硫酸钠溶液,导致产品中存在的杂质为___________ ,证明含有该杂质的方法是___________ 。
(2)硫化钠法:选用以下必要的装置,利用 与
与 、
、 的混合溶液反应制备
的混合溶液反应制备 。
。___________ 。
②丁装置中 与
与 、
、 混合液反应生成
混合液反应生成 的化学方程式:
的化学方程式:___________ 。
③实验过程中,丁中的澄清溶液先变浑浊后变澄清,此时生成大量的 ,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入
,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入 ,用离子方程式解释立刻停止通入
,用离子方程式解释立刻停止通入 的原因:
的原因:___________ 。
④简述检验丁装置中导出气体中含有 的方法:
的方法:___________ 。
(3) 的用途:做冶金工业络合剂。
的用途:做冶金工业络合剂。
黄金(Au)浸取工艺:将金矿石浸泡在 、
、 的混合溶液中,并通入
的混合溶液中,并通入 。其中
。其中 作为催化剂参与反应,方程式为:
作为催化剂参与反应,方程式为: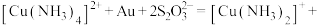
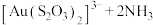 ,则浸金总反应的离子方程式为:
,则浸金总反应的离子方程式为:___________ 。
 俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:
俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:(1)亚硫酸钠法:
①需用除氧蒸馏水配制亚硫酸钠溶液。研细硫粉,用
 溶液中,水浴加热后再经重结晶精制。
溶液中,水浴加热后再经重结晶精制。②若未用除氧蒸馏水配制亚硫酸钠溶液,导致产品中存在的杂质为
(2)硫化钠法:选用以下必要的装置,利用
 与
与 、
、 的混合溶液反应制备
的混合溶液反应制备 。
。
②丁装置中
 与
与 、
、 混合液反应生成
混合液反应生成 的化学方程式:
的化学方程式:③实验过程中,丁中的澄清溶液先变浑浊后变澄清,此时生成大量的
 ,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入
,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入 ,用离子方程式解释立刻停止通入
,用离子方程式解释立刻停止通入 的原因:
的原因:④简述检验丁装置中导出气体中含有
 的方法:
的方法:(3)
 的用途:做冶金工业络合剂。
的用途:做冶金工业络合剂。黄金(Au)浸取工艺:将金矿石浸泡在
 、
、 的混合溶液中,并通入
的混合溶液中,并通入 。其中
。其中 作为催化剂参与反应,方程式为:
作为催化剂参与反应,方程式为: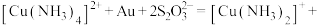
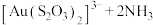 ,则浸金总反应的离子方程式为:
,则浸金总反应的离子方程式为:
您最近一年使用:0次
名校
6 . 利用元素的化合价物质类别的坐标系,可以对含某元素的各物质性质有整体的认识。如图是硫元素的常见化合价与部分物质类别的对应关系。______ ;检验其阴离子的方法是______ 。
(2)化石燃料的燃烧可产生 ,在上述图表中它是
,在上述图表中它是______ (图中的字母),为避免过多 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为______ 。
②氧化的目的是将硫元素全部转化为 ,该过程中溶液pH
,该过程中溶液pH______ (填“升高”“不变”或“降低”)。
③排放海水与原海水相比,减少的 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为______ 。
(3)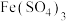 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为______ ;每脱除170kg X,消耗标准状况下 的体积为
的体积为______ L。
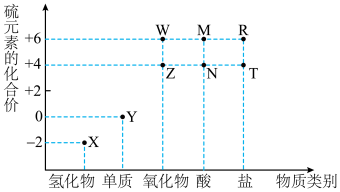
(2)化石燃料的燃烧可产生
 ,在上述图表中它是
,在上述图表中它是 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。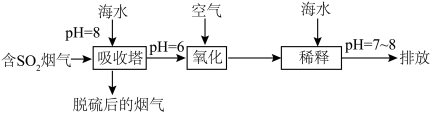
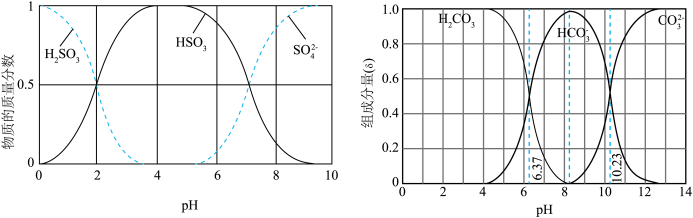
 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为②氧化的目的是将硫元素全部转化为
 ,该过程中溶液pH
,该过程中溶液pH③排放海水与原海水相比,减少的
 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为(3)
 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为 的体积为
的体积为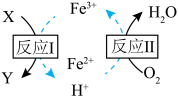
您最近一年使用:0次
名校
7 . 下列有关推理中得到的结论与事实不相符合的是
A.Cu可以还原 得到 得到 ,所以Fe也可以还原 ,所以Fe也可以还原 生成 生成 |
B.常温条件下,Cu与浓硝酸剧烈反应放出 气体,所以Fe和浓硝酸反应将更加剧烈 气体,所以Fe和浓硝酸反应将更加剧烈 |
C. 与NaOH溶液反应生成碳酸盐, 与NaOH溶液反应生成碳酸盐, 也与NaOH溶液反应生成亚硫酸盐 也与NaOH溶液反应生成亚硫酸盐 |
| D.亚硫酸的酸性强于碳酸,所以硫酸的酸性也强于碳酸 |
您最近一年使用:0次
名校
解题方法
8 . 已知反应: ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是
 ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是A.转移电子数为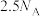 |
B.断裂的 键数为 键数为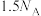 |
| C.还原产物比氧化产物多0.5mol |
D.将生成物配制成1L水溶液,溶液中 |
您最近一年使用:0次
名校
9 . SO2、NOx为常见的空气污染物,会引起酸雨、光化学烟雾等污染问题。研究者以多种方法进行“脱硫”“脱硝”。
(1)利用工业废碱渣(主要成分为Na2CO3)来吸收含SO2的烟气,同时得到Na2SO3粗品。其流程如图所示:___________ ;
②SO2被Na2CO3溶液吸收时,会释放出一种无色无味气体,该反应的离子方程式为___________ 。
(2)利用含有SO2的烟气制备NaClO2。其流程如图所示:___________ 。
②反应b中的氧化剂和还原剂的物质的量之比为___________ 。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”。控制溶液的pH=5.5,一定时间内,温度对SO2、NO脱除率的影响如图所示: 、NO
、NO 。
。
①NO在吸收过程中,反应的离子方程式是___________ 。
②50℃时,吸收液中烟气转化生成的Cl‒和NO 的物质的量之比为
的物质的量之比为___________ 。
③烟气中NOx含量的测定:将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO ,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为___________ mg·L‒1。
(1)利用工业废碱渣(主要成分为Na2CO3)来吸收含SO2的烟气,同时得到Na2SO3粗品。其流程如图所示:
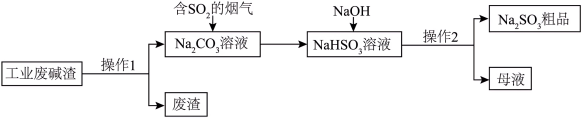
②SO2被Na2CO3溶液吸收时,会释放出一种无色无味气体,该反应的离子方程式为
(2)利用含有SO2的烟气制备NaClO2。其流程如图所示:
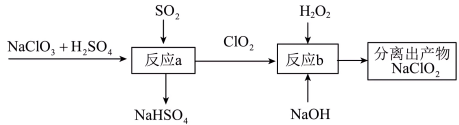
②反应b中的氧化剂和还原剂的物质的量之比为
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”。控制溶液的pH=5.5,一定时间内,温度对SO2、NO脱除率的影响如图所示:
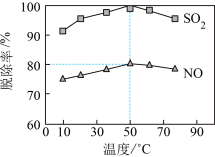
 、NO
、NO 。
。①NO在吸收过程中,反应的离子方程式是
②50℃时,吸收液中烟气转化生成的Cl‒和NO
 的物质的量之比为
的物质的量之比为③烟气中NOx含量的测定:将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO
 ,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
您最近一年使用:0次
2024-04-27更新
|
325次组卷
|
3卷引用:北师大附属实验中学2023-2024学年度第二学期期中试卷
北师大附属实验中学2023-2024学年度第二学期期中试卷北京师范大学附属实验中学2023-2024学年高一下学期期中考试化学试题(已下线)期末押题卷02-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
解题方法
10 . 铬酰氯( )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:
某小组设计如图装置利用 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。
(1)装浓盐酸的仪器名称是___________ ,B装置作用是___________ 。
(2)A中可能看到的现象是___________ ,利用浓硫酸的性质是___________ 。
(3)C中反应的化学方程式是___________ 。
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:___________ (填“是”或“否”),请解释原因:___________ 。
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用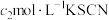 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。
该样品中氯元素质量分数为___________ 。如果滴定管没有润洗,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
已知:常温下, ,
,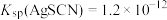 ,
,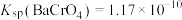 。
。
 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:| 物理性质 | 化学性质 |
| 熔点:-96.5℃,沸点:117℃ | 放置在空气中会迅速挥发并水解 |
 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。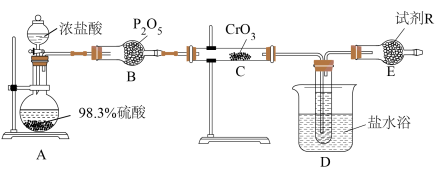
(1)装浓盐酸的仪器名称是
(2)A中可能看到的现象是
(3)C中反应的化学方程式是
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。
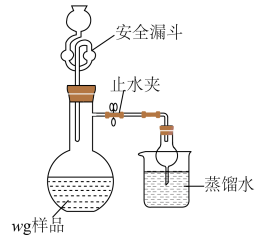
 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用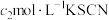 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。该样品中氯元素质量分数为
已知:常温下,
 ,
,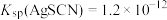 ,
,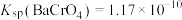 。
。
您最近一年使用:0次



