1 . 钪在国防、航天、光电等多领域有重要应用。由钛白水解母液(含Sc3+,H+、Fe2+、Mn2+、 等)制备Sc2O3的工艺流程如下:
等)制备Sc2O3的工艺流程如下: 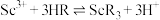 ,其中 HR表示 P204。
,其中 HR表示 P204。
下列说法错误的是
 等)制备Sc2O3的工艺流程如下:
等)制备Sc2O3的工艺流程如下: 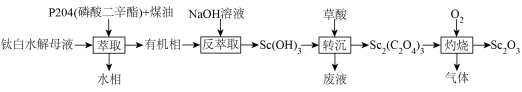
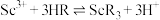 ,其中 HR表示 P204。
,其中 HR表示 P204。下列说法错误的是
A.分批加入萃取剂进行多次萃取可提高  的萃取率 的萃取率 |
B.水相中  的物质的量浓度小于钛白水解母液中的 的物质的量浓度小于钛白水解母液中的 |
C.同一温度下,由“转沉”原理可推知溶度积常数: 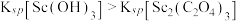 |
| D.“灼烧”反应生成1molSc2O3时,理论上有1.5molO2参加反应 |
您最近一年使用:0次
解题方法
2 . 硫代硫酸钠( ,
,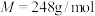 )是重要的化工原料,可用制作定影液等。其易溶于水,酸性条件不稳定。某兴趣小组在实验室开展了硫代硫酸钠制备、纯度检测和结构研究。
)是重要的化工原料,可用制作定影液等。其易溶于水,酸性条件不稳定。某兴趣小组在实验室开展了硫代硫酸钠制备、纯度检测和结构研究。
Ⅰ.制备__________ (填“仪器名称”,下同)和__________ 中的气压,使硫酸顺利流下。
(2)C装置用于观察通气速率和判断是否堵塞,其中可装入的的试剂为__________(填字母)。
(3)制备反应进行时,三通阀应调节为__________(填字母)。
(4)向 溶液通入过量
溶液通入过量 出现淡黄色沉淀,反应的离子方程式
出现淡黄色沉淀,反应的离子方程式_____________ 。
Ⅱ.纯度检测
准确称取6.200g产品,配制成100mL溶液。取20.00mL于锥形瓶中,注入缓冲溶液保证溶液为弱酸性,滴入淀粉溶液作指示剂,用 标准碘水溶液滴定到终点。已知:
标准碘水溶液滴定到终点。已知: 。
。
(5)第一次滴定开始读数为0.00mL,结束时滴定管中的液面如图所示,则第一次消耗碘水标准溶液的体积为__________ mL。重复操作,数据如下表,则产品中 的质量分数为
的质量分数为__________ 。
Ⅲ.结构研究
查阅资料知,可看成 中的一个
中的一个 被
被 代替,结构式如图。
代替,结构式如图。 的空间结构为
的空间结构为__________ 。一定条件下, 中的
中的__________ (填字母)可和金属离子配位。
A.O原子 B.中心S原子 C.端基S原子
 ,
,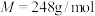 )是重要的化工原料,可用制作定影液等。其易溶于水,酸性条件不稳定。某兴趣小组在实验室开展了硫代硫酸钠制备、纯度检测和结构研究。
)是重要的化工原料,可用制作定影液等。其易溶于水,酸性条件不稳定。某兴趣小组在实验室开展了硫代硫酸钠制备、纯度检测和结构研究。Ⅰ.制备
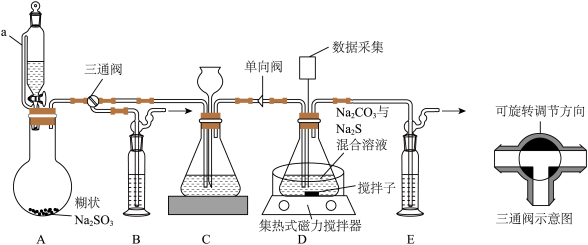
(2)C装置用于观察通气速率和判断是否堵塞,其中可装入的的试剂为__________(填字母)。
| A.浓硫酸 | B.澄清石灰水 |
C.饱和 溶液 溶液 | D.饱和NaCl溶液 |
(3)制备反应进行时,三通阀应调节为__________(填字母)。
A. | B.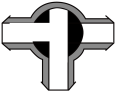 | C.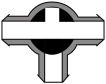 | D.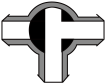 |
(4)向
 溶液通入过量
溶液通入过量 出现淡黄色沉淀,反应的离子方程式
出现淡黄色沉淀,反应的离子方程式Ⅱ.纯度检测
准确称取6.200g产品,配制成100mL溶液。取20.00mL于锥形瓶中,注入缓冲溶液保证溶液为弱酸性,滴入淀粉溶液作指示剂,用
 标准碘水溶液滴定到终点。已知:
标准碘水溶液滴定到终点。已知: 。
。(5)第一次滴定开始读数为0.00mL,结束时滴定管中的液面如图所示,则第一次消耗碘水标准溶液的体积为
 的质量分数为
的质量分数为
滴定次数 | 滴定前刻度/mL | 滴定后刻度/mL |
第二次 | 0.05 | 20.05 |
第三次 | 0.10 | 20.15 |
Ⅲ.结构研究
查阅资料知,可看成
 中的一个
中的一个 被
被 代替,结构式如图。
代替,结构式如图。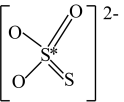
 的空间结构为
的空间结构为 中的
中的A.O原子 B.中心S原子 C.端基S原子
您最近一年使用:0次
3 .  电化学循环氧化法将酸性废水中的苯酚降解为
电化学循环氧化法将酸性废水中的苯酚降解为 ,加入
,加入 可加快苯酚的降解,原理如图。已知:
可加快苯酚的降解,原理如图。已知: ,
, 有强氧化性。下列说法错误的是
有强氧化性。下列说法错误的是
 电化学循环氧化法将酸性废水中的苯酚降解为
电化学循环氧化法将酸性废水中的苯酚降解为 ,加入
,加入 可加快苯酚的降解,原理如图。已知:
可加快苯酚的降解,原理如图。已知: ,
, 有强氧化性。下列说法错误的是
有强氧化性。下列说法错误的是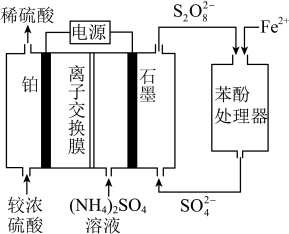
| A.铂连接电源负极,发生还原反应 |
B.石墨上的电极反应: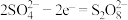 |
C.苯酚降解时发生反应: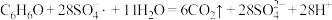 |
D.处理1mol苯酚,有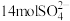 从左向右通过离子交换膜 从左向右通过离子交换膜 |
您最近一年使用:0次
2024-05-12更新
|
285次组卷
|
2卷引用:山东省德州市2024届高三下学期高考适应性练习(二)化学试题
4 . 以铝土矿(主要成分为 、
、 和
和 )为原料制备冶金级氧化铝流程如图所示。
)为原料制备冶金级氧化铝流程如图所示。___________ ,铝土矿中部分铁元素以针铁矿(FeOOH)形式存在,写出针铁矿在焙烧过程发生的化学反应方程式___________ 。
(2)“滤渣”的主要成分是___________ 。
(3)实验发现,焙烧温度为325℃时,铝和铁的提取率最高。焙烧温度进一步升高,提取率下降,原因是___________ 。(提取率:某组分浸出后在溶液中的质量与样品中的质量百分比)
(4)将“滤液”进行蒸发浓缩,冷却结晶,析出水合硫酸铝[ ],实验测得,蒸发浓缩液密度与析出晶体中的含水量的关系如图所示。
],实验测得,蒸发浓缩液密度与析出晶体中的含水量的关系如图所示。___________ (选填“多”或“少”)的水合硫酸铝晶体。
②当蒸发浓缩液密度为 ,测得析出晶体中的含水量为34.26%,折合成水合硫酸铝的结晶水系数
,测得析出晶体中的含水量为34.26%,折合成水合硫酸铝的结晶水系数
___________ (结果取整数)。
(5)还原焙烧过程加入碳,除氧化铝外,还生成 、
、 两种气体,该化学反应方程式为
两种气体,该化学反应方程式为___________ 。
(6)还原焙烧得到的粗氧化铝采用低温碱浸,过滤,对滤液进行系列操作得到氢氧化铝固体,在1200℃下进行煅烧分解得冶金级氧化铝。低温碱浸目的是___________ 。
 、
、 和
和 )为原料制备冶金级氧化铝流程如图所示。
)为原料制备冶金级氧化铝流程如图所示。
(2)“滤渣”的主要成分是
(3)实验发现,焙烧温度为325℃时,铝和铁的提取率最高。焙烧温度进一步升高,提取率下降,原因是
(4)将“滤液”进行蒸发浓缩,冷却结晶,析出水合硫酸铝[
 ],实验测得,蒸发浓缩液密度与析出晶体中的含水量的关系如图所示。
],实验测得,蒸发浓缩液密度与析出晶体中的含水量的关系如图所示。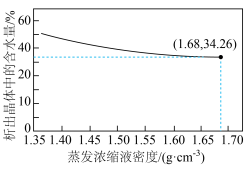
②当蒸发浓缩液密度为
 ,测得析出晶体中的含水量为34.26%,折合成水合硫酸铝的结晶水系数
,测得析出晶体中的含水量为34.26%,折合成水合硫酸铝的结晶水系数
(5)还原焙烧过程加入碳,除氧化铝外,还生成
 、
、 两种气体,该化学反应方程式为
两种气体,该化学反应方程式为(6)还原焙烧得到的粗氧化铝采用低温碱浸,过滤,对滤液进行系列操作得到氢氧化铝固体,在1200℃下进行煅烧分解得冶金级氧化铝。低温碱浸目的是
您最近一年使用:0次
5 . 连二亚硫酸钠 俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
 俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下: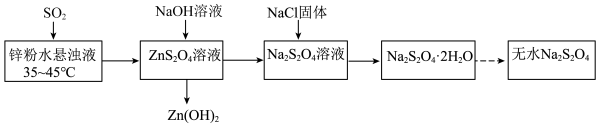
| A.将锌粉溶于水形成悬浊液可以提高反应速率 |
B.生成 的反应中氧化剂和还原剂物质的量之比为 的反应中氧化剂和还原剂物质的量之比为 |
C.温度超过 会导致 会导致 溶解度降低 溶解度降低 |
D.加入 有利于 有利于 析出,提高产率 析出,提高产率 |
您最近一年使用:0次
名校
解题方法
6 . 2023 年诺贝尔化学奖授予发现量子点的三位科学家,量子点的尺寸一般在1 nm~10 nm之间,是一种纳米级别的半导体。量子点的尺寸不同,则发光颜色不同,吸收光谱波长不同。实验室一种制备CdSe量子点的方法如下:
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为___________ 。
(2)步骤Ⅱ中N2的作用为___________ ,油酸与镉配位的原子为___________ 。
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为___________ ;此方法获得Se单质过程中无需使用的仪器是___________ (填名称)。___________ 现象时,证明CdSe量子点生长基本停止,制备完成。除此方法外,还可利用___________ 物理现象初步鉴定CdSe量子点制备成功。
(5)步骤Ⅳ中加入20 mL乙醇的作用是___________ 。
(6)CdSe洗涤干净的标志是___________ 。
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
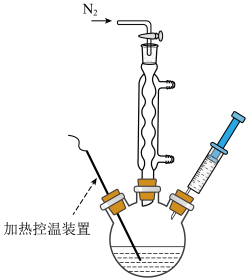
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为
(2)步骤Ⅱ中N2的作用为
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入
 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
(5)步骤Ⅳ中加入20 mL乙醇的作用是
(6)CdSe洗涤干净的标志是
您最近一年使用:0次
2024-05-11更新
|
142次组卷
|
3卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
名校
解题方法
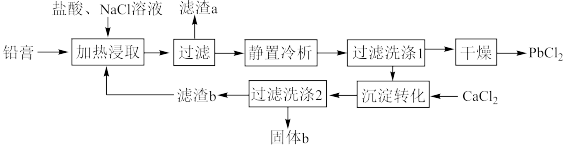
7 . 铅酸蓄电池是全球使用最广泛的化学电源,废铅酸蓄电池铅膏湿法回收铅的工艺研究是当前再生铅回收的重要研究方向,一种利用铅酸蓄电池中铅膏(主要成分为PbSO4、PbO,还含有一些不与流程中试剂反应的物质)制备PbCl2的工艺流程如图所示。请回答下列问题:
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为___________ (填“Pb”或“PbO2”),正极的电极反应式为___________ ;写出提高“加热浸取”速率的一种方法:___________ 。
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为___________ ;盐酸配比(盐酸配比是指盐酸实际用量与理论用量之比)对铅浸出率的影响如图所示,则工业上一般选择的盐酸配比为___________ ,选择该配比的原因是___________ 。___________ ;“过滤洗涤1”时,可以用___________ (填标号)检验PbCl2是否洗涤干净;“沉淀转化”的目的是降低滤液b中 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为___________ (填化学式)。
A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为
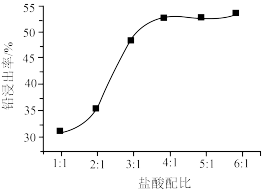
 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
您最近一年使用:0次
8 . 三氯异氰尿酸( )可在水中缓慢释放出
)可在水中缓慢释放出 ,是一种高效、低毒、安全的杀菌消毒漂白剂。实验室利用潮湿
,是一种高效、低毒、安全的杀菌消毒漂白剂。实验室利用潮湿 与
与 反应制取
反应制取 ,再与氰尿酸(
,再与氰尿酸( )悬浮液在20~25℃发生取代反应获得三氯异氰尿酸,实验装置(夹持装置省略)如下图:
)悬浮液在20~25℃发生取代反应获得三氯异氰尿酸,实验装置(夹持装置省略)如下图:
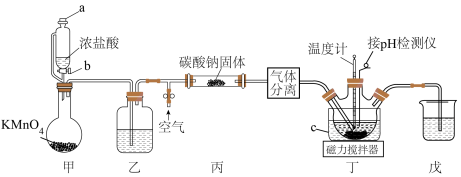
 在温度较高时易分解,浓度较高时易爆炸
在温度较高时易分解,浓度较高时易爆炸(1)制
 时,需打开活塞b,
时,需打开活塞b,(2)乙中盛放的试剂为
(3)实验时,通入空气(不参与反应)的目的为
(4)设计“气体分离”方案时,分析
 的空间构型为
的空间构型为 为弱极性分子,
为弱极性分子, 除去
除去 中的
中的 。
。(5)丁中c装置的作用为
(6)制取三氯异氰尿酸的化学方程式为
(7)三氯异氰尿酸有效氯含量测定:称取
 样品,加入适量碘化钾和稀硫酸,充分反应后用
样品,加入适量碘化钾和稀硫酸,充分反应后用
 溶液滴定,平均消耗
溶液滴定,平均消耗 溶液
溶液 。
。已知: +3H2O=
+3H2O= +3HClO
+3HClO 
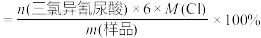
①滴定时加入的最佳指示剂是
②样品有效氯为
您最近一年使用:0次
9 . 工业废气、汽车尾气排放的氮氧化物、二氧化硫等是形成雾霾的主要物质,需要进行综合治理。
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目___________ 。
处理汽车尾气的反应为: △H
△H
2.已知:CO的燃烧热△H1=-283.0kJ·mol-1
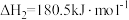
则△H=___________ 。该反应的△S___________ 0(填“>”或“<”)。
3.上述反应自发进行的条件是
工业上对二氧化硫的处理有多种方法。I:用NaOH溶液或氨水吸收废气中少量SO2气体,以防污染环境。4.若用0.1mol·L-1的NaOH溶液或同浓度的氨水处理相同量的废气,两种方法所需吸收液的体积关系是___________
5.用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化如下表所示。
根据以上信息推断NaHSO3溶液的酸碱性,结合方程式解释其原因:___________ 。
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO ]的值将
]的值将___________ 。
A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:___________ 。
己知: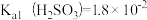 ,
,
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目
处理汽车尾气的反应为:
 △H
△H2.已知:CO的燃烧热△H1=-283.0kJ·mol-1

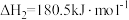
则△H=
3.上述反应自发进行的条件是
| A.任何温度 | B.任何温度都不能 | C.高温 | D.低温 |
| A.NaOH溶液的体积大于氨水 | B.NaOH溶液的体积等于氨水 |
| C.NaOH溶液的体积小于氨水 | D.无法判断 |
n(SO ):n(HSO ):n(HSO ) ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,溶液中c(HSO )增大 )增大 |
B.加入少量Na2SO3固体,则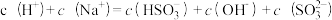 |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
D.加入氨水至中性,则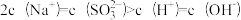 |
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO
 ]的值将
]的值将A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO
 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:己知:
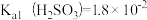 ,
,
您最近一年使用:0次
解题方法
10 . 澳大利亚昆士兰大学的王连洲教授团队设计了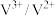 离子对作为氧化还原电子对提升
离子对作为氧化还原电子对提升 和
和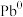 之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是
之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是
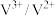 离子对作为氧化还原电子对提升
离子对作为氧化还原电子对提升 和
和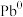 之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是
之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是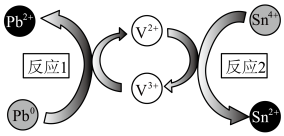
A.总反应为 | B.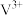 为中间产物, 为中间产物, 为催化剂 为催化剂 |
C.氧化性: | D.反应2中负极反应: |
您最近一年使用:0次



