1 . 几种含碘粒子之间的转化关系如图所示,下列说法正确的是

A. 、 、 和 和 的氧化性强弱: 的氧化性强弱: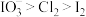 |
B.为增大 的产量,反应②可以加过量NaHSO3 的产量,反应②可以加过量NaHSO3 |
| C.将淀粉KI溶液逐滴滴入新制氯水中,溶液颜色先变浅后变蓝 |
| D.产生等量的I2,反应④消耗的H+与反应②产生的H+的量相等 |
您最近一年使用:0次
名校
解题方法
2 . 电化学中,常用电极电势表示一定条件下微粒得失电子能力,电极电势越高氧化性越强。标准状态下,氧化型电极反应 ,
,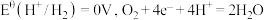 ,
,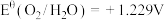 ,则
,则 的氧化性比
的氧化性比 强。含钴微粒的电极电势随
强。含钴微粒的电极电势随 的变化如图所示,两条虚线分别表示“氧线”和“氢线”。下列说法错误的是
的变化如图所示,两条虚线分别表示“氧线”和“氢线”。下列说法错误的是
 ,
,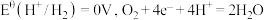 ,
,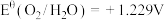 ,则
,则 的氧化性比
的氧化性比 强。含钴微粒的电极电势随
强。含钴微粒的电极电势随 的变化如图所示,两条虚线分别表示“氧线”和“氢线”。下列说法错误的是
的变化如图所示,两条虚线分别表示“氧线”和“氢线”。下列说法错误的是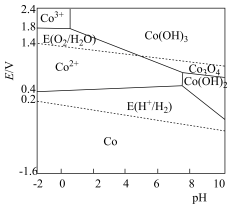
A.单质 溶于稀硫酸能置换出 溶于稀硫酸能置换出 |
| B.氧气的氧化性与溶液的酸碱性有关 |
C.一定条件下 转化为 转化为 ,氧化能力减弱 ,氧化能力减弱 |
D.酸性条件下,反应 难以进行 难以进行 |
您最近一年使用:0次
7日内更新
|
234次组卷
|
5卷引用:2024届山东省高三下学期联合模拟考试模拟预测化学试题
2024届山东省高三下学期联合模拟考试模拟预测化学试题2024届山东省潍坊市四县联考高三下学期三模化学试题山东省德州市第一中学2024届下学期三模化学试题湖南省雅礼中学2024届高三下学期热身训练(三模)化学试题(已下线)第04讲 氧化还原反应的基本概念和规律(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
3 . 海水是巨大的资源宝库,以下是人类从海水中提取某些重要化工原料的简单流程示意图。下列说法错误的是
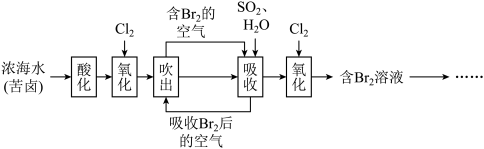
| A.“吹出”时,常采用热空气吹出溴,利用了溴单质的易挥发性 |
B.用 水溶液吸收 水溶液吸收 的离子方程式为 的离子方程式为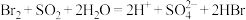 |
| C.流程中氧化→吸收→氧化的目的是富集溴单质 |
D.工业上也可用 溶液代替二氧化硫吸收 溶液代替二氧化硫吸收 ,会生成无色无味气体和 ,会生成无色无味气体和 ,则反应的化学方程式为 ,则反应的化学方程式为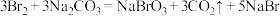 |
您最近一年使用:0次
7日内更新
|
62次组卷
|
2卷引用:河南省名校联盟2023-2024学年高一下学期5月联考化学试题
名校
4 . 二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。回答下列问题:
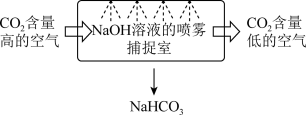
(1)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图。_______ ;
②“碳捕获”技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量之比为1∶1,则反应的离子方程式为_______ ;
③下列溶液中,同样能用于“捕捉”二氧化碳的是_______ (填选项字母);
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
(2) 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图所示。
排放并实现资源利用,原理如图所示。_______ ;
②若产生等物质的量CO、 ,写出反应Ⅱ的化学方程式:
,写出反应Ⅱ的化学方程式:_______ 。
(3)从空气中捕获 直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。
直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。_______ ;
②如图所示转化总反应的化学方程式是_______ 。
(1)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图。
②“碳捕获”技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量之比为1∶1,则反应的离子方程式为
③下列溶液中,同样能用于“捕捉”二氧化碳的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液(2)
 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图所示。
排放并实现资源利用,原理如图所示。
②若产生等物质的量CO、
 ,写出反应Ⅱ的化学方程式:
,写出反应Ⅱ的化学方程式:(3)从空气中捕获
 直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。
直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。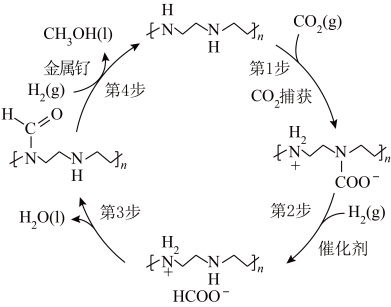
②如图所示转化总反应的化学方程式是
您最近一年使用:0次
名校
5 . 下围是以氮气和氢气为原料合成氨,并以氨为原料生产硝酸的工艺流程(其中空气等基础原料已略去).________________ .
(2)若条件控制不当,氨氧化装置中可能发生副反应, 与
与 生成
生成 ,该副反应中氧化剂与还原剂的物质的量之比为
,该副反应中氧化剂与还原剂的物质的量之比为________ .
(3)下列离子能在溶液中共存,但加入适量 溶液后无法大量共存的是________.
溶液后无法大量共存的是________.
(4)将25.6g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为8.96L(标准状况,不考虑
和NO混合气体的体积为8.96L(标准状况,不考虑 二聚).待产生的气体全部释放后,向溶液加入100mL
二聚).待产生的气体全部释放后,向溶液加入100mL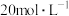 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为________  .
.
(5)可以用 还原
还原 生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的
生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的 与
与 的物质的量之比是
的物质的量之比是________ .

(2)若条件控制不当,氨氧化装置中可能发生副反应,
 与
与 生成
生成 ,该副反应中氧化剂与还原剂的物质的量之比为
,该副反应中氧化剂与还原剂的物质的量之比为(3)下列离子能在溶液中共存,但加入适量
 溶液后无法大量共存的是________.
溶液后无法大量共存的是________.A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
(4)将25.6g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生
 和NO混合气体的体积为8.96L(标准状况,不考虑
和NO混合气体的体积为8.96L(标准状况,不考虑 二聚).待产生的气体全部释放后,向溶液加入100mL
二聚).待产生的气体全部释放后,向溶液加入100mL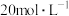 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 .
.(5)可以用
 还原
还原 生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的
生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的 与
与 的物质的量之比是
的物质的量之比是
您最近一年使用:0次
名校
6 . 环境保护与绿色发展是新时代人们关心的共同话题。NO、 是大气主要污染物,因此对工业烟气(主要成分为
是大气主要污染物,因此对工业烟气(主要成分为 ,
, 、
、 )脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
)脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
(1)碱液吸收:NaOH溶液可吸收工业烟气,获得副产品 。
。
①等物质的量的NO与 被NaOH溶液吸收,反应的离子方程式为
被NaOH溶液吸收,反应的离子方程式为____________ 。
②若吸收时NO与 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是______ (填化学式)。
(2)目前常见方法是采用酸化处理的NaClO溶液液相氧化法脱除烟气中的 ,其主要过程如下:
,其主要过程如下:
Ⅰ.
 kJ/mol
kJ/mol
Ⅱ.
 kJ/mol
kJ/mol
①写出 转化为
转化为 的热化学方程式:
的热化学方程式:____________ 。
②研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是______ 。
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为______ 。
方法1:直接使用尿素 溶液吸收烟气中的
溶液吸收烟气中的 。
。
方法2:先用合适的氧化剂将 中的NO氧化为
中的NO氧化为 ,再用
,再用 溶液还原吸收。
溶液还原吸收。
还原吸收等量的 ,消耗尿素较少的是
,消耗尿素较少的是______ (填“方法1”或“方法2”)。工业上选择方法2处理 的原因是
的原因是____________ 。
 是大气主要污染物,因此对工业烟气(主要成分为
是大气主要污染物,因此对工业烟气(主要成分为 ,
, 、
、 )脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
)脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。(1)碱液吸收:NaOH溶液可吸收工业烟气,获得副产品
 。
。①等物质的量的NO与
 被NaOH溶液吸收,反应的离子方程式为
被NaOH溶液吸收,反应的离子方程式为②若吸收时NO与
 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是(2)目前常见方法是采用酸化处理的NaClO溶液液相氧化法脱除烟气中的
 ,其主要过程如下:
,其主要过程如下:Ⅰ.

 kJ/mol
kJ/molⅡ.

 kJ/mol
kJ/mol①写出
 转化为
转化为 的热化学方程式:
的热化学方程式:②研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和
 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为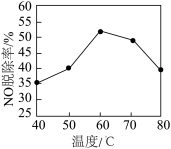
方法1:直接使用尿素
 溶液吸收烟气中的
溶液吸收烟气中的 。
。方法2:先用合适的氧化剂将
 中的NO氧化为
中的NO氧化为 ,再用
,再用 溶液还原吸收。
溶液还原吸收。还原吸收等量的
 ,消耗尿素较少的是
,消耗尿素较少的是 的原因是
的原因是
您最近一年使用:0次
名校
7 . 自然界中的含硫物质通过各种化学过程建立起硫循环,其循环过程如下图所示:
1.下列说法错误的是___________。
2.空气中粉尘可能在过程①中起到___________ 作用,收集一定量的酸雨,发现短时间内样品的 值一直在
值一直在___________ (填“变大”或“变小”),说明其溶质不仅仅是 。
。
Ⅱ.过程②
微生物的厌氧活动可产生 并将其排向大气中,
并将其排向大气中, 可在空气中被氧化为
可在空气中被氧化为
3.实验室产生多余 ,可用
,可用 溶液进行吸收,当
溶液进行吸收,当 吸收了过量
吸收了过量 时,其溶质的电离方程式为:
时,其溶质的电离方程式为:___________ 。
4.还可用硫酸铜溶液吸收 ,现象是溶液中产生黑色沉淀,写出反应的离子方程式:
,现象是溶液中产生黑色沉淀,写出反应的离子方程式:___________ 。
5. 还是工业制硫酸的重要中间物质,它可以通过硫酸厂的沸腾炉中
还是工业制硫酸的重要中间物质,它可以通过硫酸厂的沸腾炉中 (过硫化亚铁)与氧气的反应得到,用单线桥法标明电子转移:
(过硫化亚铁)与氧气的反应得到,用单线桥法标明电子转移:___________ 。

6. 与酸反应时生成
与酸反应时生成 与
与 相似,易分解。实验室用过量稀硫酸与
相似,易分解。实验室用过量稀硫酸与 颗粒混合,不可能生成的物质是___________。
颗粒混合,不可能生成的物质是___________。
Ⅲ.过程③7.海水中硫酸根离子含量大约为 ,会干扰海水中
,会干扰海水中 的检验,写出检验海水中
的检验,写出检验海水中 的实验方法
的实验方法___________ 。IV.过程④生物体内少量的和 反应生成
反应生成 和S,说明
和S,说明 具有还原性8.某种卤离子也能与
具有还原性8.某种卤离子也能与 在溶液中作用生成亚铁盐与卤素单质,它应该是___________。
在溶液中作用生成亚铁盐与卤素单质,它应该是___________。
9.由于化石能源的开采与使用量的不断增长,直接导致硫循环中的过程___________加剧,对环境造成了一定程度的破坏,请提出减缓这一过程的措施。
10.措施:___________ 。

1.下列说法错误的是___________。
A.工厂废气中的 与 与 可能来自于煤炭中的含硫物质。 可能来自于煤炭中的含硫物质。 |
| B.火山口产生的气体可以使酸性高锰酸钾溶液褪色,说明其具有漂白性 |
C. 有毒,其含量是空气污染程度指标之一 有毒,其含量是空气污染程度指标之一 |
D. 可添加到红酒中,起到一定的杀菌、抗氧化作用 可添加到红酒中,起到一定的杀菌、抗氧化作用 |
 值一直在
值一直在 。
。Ⅱ.过程②
微生物的厌氧活动可产生
 并将其排向大气中,
并将其排向大气中, 可在空气中被氧化为
可在空气中被氧化为
3.实验室产生多余
 ,可用
,可用 溶液进行吸收,当
溶液进行吸收,当 吸收了过量
吸收了过量 时,其溶质的电离方程式为:
时,其溶质的电离方程式为:4.还可用硫酸铜溶液吸收
 ,现象是溶液中产生黑色沉淀,写出反应的离子方程式:
,现象是溶液中产生黑色沉淀,写出反应的离子方程式:5.
 还是工业制硫酸的重要中间物质,它可以通过硫酸厂的沸腾炉中
还是工业制硫酸的重要中间物质,它可以通过硫酸厂的沸腾炉中 (过硫化亚铁)与氧气的反应得到,用单线桥法标明电子转移:
(过硫化亚铁)与氧气的反应得到,用单线桥法标明电子转移:
6.
 与酸反应时生成
与酸反应时生成 与
与 相似,易分解。实验室用过量稀硫酸与
相似,易分解。实验室用过量稀硫酸与 颗粒混合,不可能生成的物质是___________。
颗粒混合,不可能生成的物质是___________。A. | B.S | C. | D. |
 ,会干扰海水中
,会干扰海水中 的检验,写出检验海水中
的检验,写出检验海水中 的实验方法
的实验方法 反应生成
反应生成 和S,说明
和S,说明 具有还原性8.某种卤离子也能与
具有还原性8.某种卤离子也能与 在溶液中作用生成亚铁盐与卤素单质,它应该是___________。
在溶液中作用生成亚铁盐与卤素单质,它应该是___________。A. | B. | C. | D. |
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
名校
解题方法
8 . 一种制备 的方法如下:将铜与足量的浓硫酸加热,接着有两步操作
的方法如下:将铜与足量的浓硫酸加热,接着有两步操作
Ⅰ:将生成的气体用适量 溶液吸收得到单一组分的正盐溶液X
溶液吸收得到单一组分的正盐溶液X
Ⅱ:除去余酸,将硫酸铜配成溶液,并加入溶液X,反应过滤即得
已知第Ⅱ步反应需及时补加 以保持反应在
以保持反应在 条件下进行.下列有关说法不正确的是
条件下进行.下列有关说法不正确的是
 的方法如下:将铜与足量的浓硫酸加热,接着有两步操作
的方法如下:将铜与足量的浓硫酸加热,接着有两步操作Ⅰ:将生成的气体用适量
 溶液吸收得到单一组分的正盐溶液X
溶液吸收得到单一组分的正盐溶液XⅡ:除去余酸,将硫酸铜配成溶液,并加入溶液X,反应过滤即得

已知第Ⅱ步反应需及时补加
 以保持反应在
以保持反应在 条件下进行.下列有关说法不正确的是
条件下进行.下列有关说法不正确的是| A.铜和浓硫酸的反应中,浓硫酸表现为氧化性和酸性 |
| B.若从溶液X获得固体X,可将X溶液蒸发浓缩,冷却结晶 |
| C.硫酸铜和石灰乳混合可以制备波尔多液 |
D.若 产量不变,参与反应Ⅱ的X与 产量不变,参与反应Ⅱ的X与 物质的量之比 物质的量之比 增大时,需补加 增大时,需补加 的量减少 的量减少 |
您最近一年使用:0次
名校
9 . FeOOH在生产生活中有广泛应用。
I.用硫酸渣(主要成分为 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。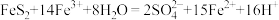 ;
; 、
、 均与
均与 不反应。
不反应。
(1)基态 价层电子排布式为
价层电子排布式为___________ 。
(2)“还原”时还原产物与氧化产物的物质的量之比为___________ 。
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为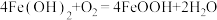 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:___________ 。
II. 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(4)在80℃下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备1mol 理论上需要
理论上需要 的物质的量为
的物质的量为___________ mol;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(5) 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。 分子中的共价键的物质的量为
分子中的共价键的物质的量为___________ mol。
②写出反应II的化学方程式:___________ 。
I.用硫酸渣(主要成分为
 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。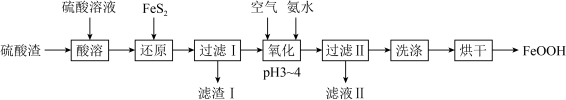
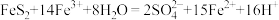 ;
; 、
、 均与
均与 不反应。
不反应。(1)基态
 价层电子排布式为
价层电子排布式为(2)“还原”时还原产物与氧化产物的物质的量之比为
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。
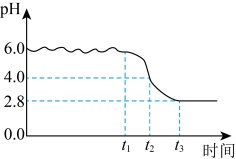
 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为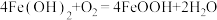 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:II.
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(4)在80℃下,向
 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备1mol
 理论上需要
理论上需要 的物质的量为
的物质的量为 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(5)
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。
 分子中的共价键的物质的量为
分子中的共价键的物质的量为②写出反应II的化学方程式:
您最近一年使用:0次
2024-06-16更新
|
53次组卷
|
2卷引用:江苏省南通市海安高级中学2023-2024学年高一下学期期中考试化学试题
10 . 自然界的氮循环如图所示
(2)施用化肥可有效提高粮食产量.化肥氯化铵施用时需要注意避免烈日曝晒,因为(写出对应的化学方程式)______________________________ .此类铵态氮肥不宜和草木灰等碱性肥料混合使用,原因是________________ .
(3)海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应).________ 种价态.过程②中氮元素被________ .(填“氧化”或“还原”)
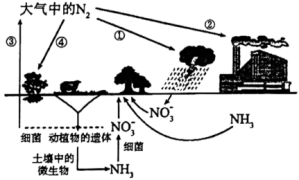
| A.图中表示了三种不同的固氮方式 | B.②中合成氨属于人工固氮 |
C.除 外,①和④中均需还原剂参与 外,①和④中均需还原剂参与 | D.含氮有机物和含氮无机物可相互转化 |
(3)海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应).

您最近一年使用:0次



