解题方法
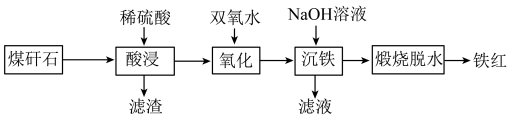
1 . 由煤矸石(主要成分为SiO2及铁铝的氧化物,还含有少量CaO)制备铁红的工艺流程如图。___________ (任写两条)。
(2)滤渣的主要成分是___________ 。
(3)“氧化”过程中发生反应的离子方程式为___________ 。
(4)“沉铁”过程中加入过量NaOH溶液,发生反应的离子方程式为Fe3++3OH-=Fe(OH)3↓和___________ 。
(5)关于“煅烧脱水”制得的铁红,下列说法正确的是___________。
(2)滤渣的主要成分是
(3)“氧化”过程中发生反应的离子方程式为
(4)“沉铁”过程中加入过量NaOH溶液,发生反应的离子方程式为Fe3++3OH-=Fe(OH)3↓和
(5)关于“煅烧脱水”制得的铁红,下列说法正确的是___________。
A.铁红的化学式为 | B.铁红是具有磁性的晶体 |
| C.铁红属于碱性氧化物 | D.铁红常用作油漆、涂料的红色颜料 |
您最近一年使用:0次
名校
解题方法
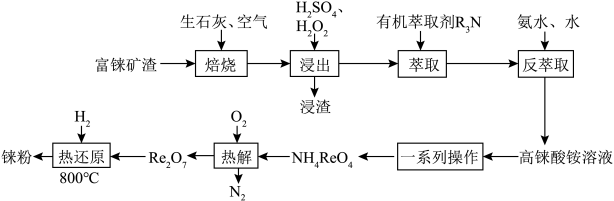
2 . 铼是一种稀有贵重金属,广泛用于制造飞机、卫星和火箭的外壳等。工业上一种利用富铼矿渣(主要成分ReS2)提取铼的工艺流程如图所示:
②Re2O7是酸性氧化物,HReO4的性质与HClO4的性质相似;高铼酸铵( )微溶于冷水,易溶于热水;
)微溶于冷水,易溶于热水;
③室温下, 。
。
回答下列问题:
(1)Re2O7与水反应的离子方程式为___________ ;室温下,加入氨水后,测得溶液pH约为11,则溶液中
___________ (填“>”“<”或“=”)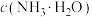 。
。
(2)“焙烧”时,空气从焙烧炉底部通入,粉碎后的矿渣从顶部加入,目的是___________ 。
(3)写出“热解”时发生反应的主要化学方程式:___________ 。
(4)测得制得的铼粉(含少量Re2O7)中Re与O的原子个数比为1∶0.35,则该产品的纯度为___________ %(保留三位有效数字)。
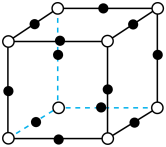
(5)已知ReO3的立方晶胞结构如图所示,则Re在晶胞中的位置为___________ ;晶体中一个Re周围与其最近的O的个数为___________ 。
②Re2O7是酸性氧化物,HReO4的性质与HClO4的性质相似;高铼酸铵(
 )微溶于冷水,易溶于热水;
)微溶于冷水,易溶于热水;③室温下,
 。
。回答下列问题:
(1)Re2O7与水反应的离子方程式为

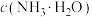 。
。(2)“焙烧”时,空气从焙烧炉底部通入,粉碎后的矿渣从顶部加入,目的是
(3)写出“热解”时发生反应的主要化学方程式:
(4)测得制得的铼粉(含少量Re2O7)中Re与O的原子个数比为1∶0.35,则该产品的纯度为
(5)已知ReO3的立方晶胞结构如图所示,则Re在晶胞中的位置为
您最近一年使用:0次
3 . 某科研团队设计了一种熔盐液相氧化法对铬铁矿[主要成分 ,含Al、Mg氧化物杂质]进行处理制备高价铬盐的工艺流程如图:
,含Al、Mg氧化物杂质]进行处理制备高价铬盐的工艺流程如图:
 ,含Al、Mg氧化物杂质]进行处理制备高价铬盐的工艺流程如图:
,含Al、Mg氧化物杂质]进行处理制备高价铬盐的工艺流程如图:
A.“滤渣1”主要成分是 、 、 |
B.“高温连续氧化”工序中可用 代替NaOH 代替NaOH |
| C.“工序2”中,含铬元素的粒子没有参与反应 |
D.参与反应的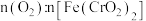 为7∶4 为7∶4 |
您最近一年使用:0次
名校
4 . 氮化铍可用于新型的耐火陶瓷材料和反应堆材料,可由铍粉和干燥氮气在无氧气氛中于700~1400℃的温度下加热制得。以绿柱石(主要组成是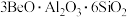 ,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。 如表所示。
如表所示。
回答下列问题:
(1)“酸浸”时绿柱石要进行粉碎,其目的是_______ 。
(2)“转化”时加入 的目的是
的目的是_______ (用离子方程式表示)。
(3)“调 ”时加入适量
”时加入适量 细粉除去
细粉除去 和
和 ,调节溶液
,调节溶液 的范围是
的范围是_______ ,其中沉淀 的离子方程式为
的离子方程式为_______ ,“滤渣2”的主要成分是_______ (填化学式)。
(4)“沉铍”时所加试剂 是
是_______ (填“氨水”或“ 溶液”)。
溶液”)。
(5)生成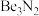 的化学方程式为
的化学方程式为_______ 。
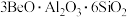 ,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
 如表所示。
如表所示。| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.3 | 1.8 | 3.1 | 5.6 | 12.4 |
| 沉淀完全pH | 8.3 | 3.2 | 4.8 | 8.5 | 13.8 |
(1)“酸浸”时绿柱石要进行粉碎,其目的是
(2)“转化”时加入
 的目的是
的目的是(3)“调
 ”时加入适量
”时加入适量 细粉除去
细粉除去 和
和 ,调节溶液
,调节溶液 的范围是
的范围是 的离子方程式为
的离子方程式为(4)“沉铍”时所加试剂
 是
是 溶液”)。
溶液”)。(5)生成
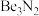 的化学方程式为
的化学方程式为
您最近一年使用:0次
2024-05-16更新
|
27次组卷
|
2卷引用:重庆市荣昌永荣中学校2024届高三下学期模拟预测化学试题2
5 . 已知:2H++2 (黄色)
(黄色) H2O+
H2O+ (橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:
(橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:
Ⅰ.将2.4gCr(NO3)3·9H2O(M=400g/mol)溶解,逐滴加入6mol/LNaOH溶液,至产生的沉淀变为亮绿色的NaCrO2溶液。
Ⅱ.加入15%H2O2溶液,小火加热,溶液由亮绿色变为黄色。
Ⅲ.继续煮沸溶液15min,除尽剩余的H2O2,再滴加6mol/L醋酸溶液,调溶液呈弱酸性,溶液由黄色变为橙色,再滴加8滴醋酸溶液。
Ⅳ.将溶液加热近沸,滴加足量0.5mol/LPb(NO3)2溶液,继续煮沸5min。冷却后抽滤、热水洗涤、烘干称重,得黄色沉淀1.26g。
回答下列有关问题:
(1)结合步骤Ⅰ中相关信息判断Cr(OH)3是否属于两性氢氧化物?_______ 。实验中需先配制6mol/LNaOH溶液,配制过程中的部分操作如图所示,仪器X的名称为_______ ,图中操作不规范之处为_______ 。_______ 性。
(3)步骤Ⅲ中,煮沸除尽剩余H2O2的目的是:防止在得到橙色溶液时_______ 。
(4)步骤Ⅲ在加入Pb(NO3)2溶液前需加醋酸溶液调节溶液呈酸性,其目的是_______ ,否则制得的PbCrO4不纯。从平衡角度解释不宜调节酸性过强的原因是_______ 。
(5)由步骤Ⅳ中数据计算本实验的产率为_______ %(保留一位小数)。
 (黄色)
(黄色) H2O+
H2O+ (橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:
(橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:Ⅰ.将2.4gCr(NO3)3·9H2O(M=400g/mol)溶解,逐滴加入6mol/LNaOH溶液,至产生的沉淀变为亮绿色的NaCrO2溶液。
Ⅱ.加入15%H2O2溶液,小火加热,溶液由亮绿色变为黄色。
Ⅲ.继续煮沸溶液15min,除尽剩余的H2O2,再滴加6mol/L醋酸溶液,调溶液呈弱酸性,溶液由黄色变为橙色,再滴加8滴醋酸溶液。
Ⅳ.将溶液加热近沸,滴加足量0.5mol/LPb(NO3)2溶液,继续煮沸5min。冷却后抽滤、热水洗涤、烘干称重,得黄色沉淀1.26g。
回答下列有关问题:
(1)结合步骤Ⅰ中相关信息判断Cr(OH)3是否属于两性氢氧化物?

(3)步骤Ⅲ中,煮沸除尽剩余H2O2的目的是:防止在得到橙色溶液时
(4)步骤Ⅲ在加入Pb(NO3)2溶液前需加醋酸溶液调节溶液呈酸性,其目的是
(5)由步骤Ⅳ中数据计算本实验的产率为
您最近一年使用:0次
名校
解题方法
6 . 过硫酸铵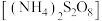 也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至
也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至 制备过硫酸铵的装置如图所示。
制备过硫酸铵的装置如图所示。
(1)每个过硫酸铵(S元素的化合价为+6价)中含有过氧键个数为___________ 。
(2)仪器的连接顺序为
___________ (用小写字母连接)。
(3)盛放浓硫酸的仪器名称为___________ 。装置A中 的作用是
的作用是___________ 。过硫酸铵保存在棕色试剂瓶中的原因是___________ 。
(4)A中制取过硫酸铵的反应的化学方程式为___________ 。充分反应后,将A中混合液经一系列操作得到晶体,然后用无水乙醇洗涤。选择用无水乙醇洗涤的目的是___________ 。
(5)过硫酸铵可用于测定锰钢中 元素的含量:取
元素的含量:取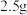 锰钢样品,加入过量浓硝酸,在加热条件下将
锰钢样品,加入过量浓硝酸,在加热条件下将 溶出形成
溶出形成 ,再用
,再用 过硫酸铵溶液恰好将溶出的
过硫酸铵溶液恰好将溶出的 全部转化为
全部转化为 ,通过检测
,通过检测 的浓度得出样品中
的浓度得出样品中 元素的质量分数为54%,则
元素的质量分数为54%,则
___________ (保留两位小数)。
(6)根据本实验可得出, 的氧化性从大到小的顺序为
的氧化性从大到小的顺序为___________ 。
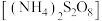 也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至
也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至 制备过硫酸铵的装置如图所示。
制备过硫酸铵的装置如图所示。
(1)每个过硫酸铵(S元素的化合价为+6价)中含有过氧键个数为
(2)仪器的连接顺序为

(3)盛放浓硫酸的仪器名称为
 的作用是
的作用是(4)A中制取过硫酸铵的反应的化学方程式为
(5)过硫酸铵可用于测定锰钢中
 元素的含量:取
元素的含量:取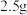 锰钢样品,加入过量浓硝酸,在加热条件下将
锰钢样品,加入过量浓硝酸,在加热条件下将 溶出形成
溶出形成 ,再用
,再用 过硫酸铵溶液恰好将溶出的
过硫酸铵溶液恰好将溶出的 全部转化为
全部转化为 ,通过检测
,通过检测 的浓度得出样品中
的浓度得出样品中 元素的质量分数为54%,则
元素的质量分数为54%,则
(6)根据本实验可得出,
 的氧化性从大到小的顺序为
的氧化性从大到小的顺序为
您最近一年使用:0次
解题方法
7 . 近年来,随着新能源汽车行业高速发展,市场对磷酸铁锂( )的需求量也随之增加。以硫铁矿(主要成分是
)的需求量也随之增加。以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 为原料制备)
为原料制备) 的流程如图所示:
的流程如图所示:
请回答下列问题:
(1)写出磷酸铁锂中相应价态基态铁离子的电子排布式:___________ 。
(2)“焙烧”生成 的化学方程式为
的化学方程式为___________ 。
(3)“还原”选用足量FeS的优点是___________ ;“除铝”时,溶液的pH应控制的范围是___________ 。
(4)“氧化”加入 的目的除了可以增强H2O2的氧化性外,还可以
的目的除了可以增强H2O2的氧化性外,还可以___________ 。
(5)“沉铁”后的滤液中阴离子除了 外,还检验出
外,还检验出 和
和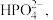 写出“沉铁”反应的离子方程式:
写出“沉铁”反应的离子方程式:___________ 。
(6)“高温煅烧”条件下,由 制备
制备 ,理论上
,理论上 和
和 的投料比为
的投料比为
___________ 。
(7) 的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时
的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时 脱出部分Li⁺形成
脱出部分Li⁺形成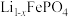 ,结构如图b所示,则
,结构如图b所示,则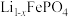 中
中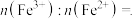
___________ (填最简整数比)。
 )的需求量也随之增加。以硫铁矿(主要成分是
)的需求量也随之增加。以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 为原料制备)
为原料制备) 的流程如图所示:
的流程如图所示:
| 金属氢氧化物 |  |  |  |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 |
(1)写出磷酸铁锂中相应价态基态铁离子的电子排布式:
(2)“焙烧”生成
 的化学方程式为
的化学方程式为(3)“还原”选用足量FeS的优点是
(4)“氧化”加入
 的目的除了可以增强H2O2的氧化性外,还可以
的目的除了可以增强H2O2的氧化性外,还可以(5)“沉铁”后的滤液中阴离子除了
 外,还检验出
外,还检验出 和
和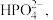 写出“沉铁”反应的离子方程式:
写出“沉铁”反应的离子方程式:(6)“高温煅烧”条件下,由
 制备
制备 ,理论上
,理论上 和
和 的投料比为
的投料比为
(7)
 的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时
的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时 脱出部分Li⁺形成
脱出部分Li⁺形成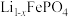 ,结构如图b所示,则
,结构如图b所示,则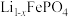 中
中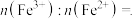

您最近一年使用:0次
解题方法
8 .  还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。
 还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。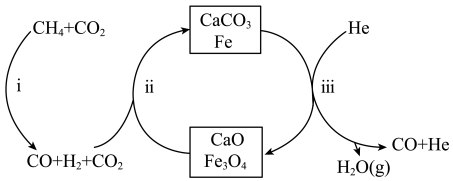
A.该反应的催化剂为 和 和 |
| B.过程iii在恒压条件下通入He,有利于增加CO的产量 |
| C.过程i、ii、iii均涉及置换反应 |
D.每生成4mol的CO,转移的电子数约为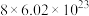 |
您最近一年使用:0次
9 . 钌(Ru)是地球上丰度最小的元素,钌的产品广泛应用于电子、航空航天、化工等领域。从某种失效的钌催化剂(主要成分为Ru、ZnO、 、有机物等)中回收钌的工艺流程如下:
、有机物等)中回收钌的工艺流程如下: 的沸点为40℃,温度高于108℃分解。②氧化性:
的沸点为40℃,温度高于108℃分解。②氧化性: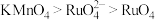
(1)“煅烧”的目的是___________ 。
(2)“氧化”过程需在650℃下熔融反应5小时。
①单质Ru被氧化为 的化学方程式为
的化学方程式为___________ 。
② 固体过量会导致钌的回收率降低,原因是
固体过量会导致钌的回收率降低,原因是___________ 。
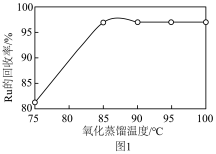
(3)“氧化蒸馏”时,测得钌的回收率随温度变化曲线如图1所示。工业上保证钌回收率较高的情况下,选择在95℃进行氧化蒸馏的原因是___________ 。___________ 。
(5)钌多活性位点催化剂(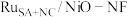 )可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
)可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。___________ 。
②催化剂的活性位点在催化过程中的主要作用是___________ 。
③分析图2-a推测 的“吸附解离”主要发生在
的“吸附解离”主要发生在___________ (填“钌原子”、“钌团簇”或“NiO”)位点上,若有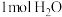 参与该过程,则变化的能量为
参与该过程,则变化的能量为___________ kJ(保留1位小数:已知: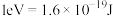 )。
)。
④分析图2-b并说明 的脱附主要发生在NiO表面的原因
的脱附主要发生在NiO表面的原因___________ 。
 、有机物等)中回收钌的工艺流程如下:
、有机物等)中回收钌的工艺流程如下: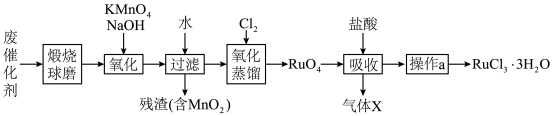
 的沸点为40℃,温度高于108℃分解。②氧化性:
的沸点为40℃,温度高于108℃分解。②氧化性: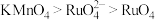
(1)“煅烧”的目的是
(2)“氧化”过程需在650℃下熔融反应5小时。
①单质Ru被氧化为
 的化学方程式为
的化学方程式为②
 固体过量会导致钌的回收率降低,原因是
固体过量会导致钌的回收率降低,原因是(3)“氧化蒸馏”时,测得钌的回收率随温度变化曲线如图1所示。工业上保证钌回收率较高的情况下,选择在95℃进行氧化蒸馏的原因是
(5)钌多活性位点催化剂(
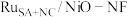 )可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
)可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
②催化剂的活性位点在催化过程中的主要作用是
③分析图2-a推测
 的“吸附解离”主要发生在
的“吸附解离”主要发生在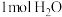 参与该过程,则变化的能量为
参与该过程,则变化的能量为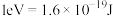 )。
)。④分析图2-b并说明
 的脱附主要发生在NiO表面的原因
的脱附主要发生在NiO表面的原因
您最近一年使用:0次
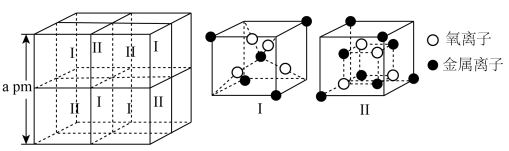
10 . 工业上采用铁氧体法处理某总铬含量约为1600 的废水(主要成分为
的废水(主要成分为 ,pH约为4.3),同时回收含铬复合铁氧体
,pH约为4.3),同时回收含铬复合铁氧体 ,工艺流程如下:
,工艺流程如下: 是两性氢氧化物。
是两性氢氧化物。
(1)“还原”时发生反应的离子方程式为_____ 。
(2)“共沉淀”时 太小或太大均不利于除铬,原因是
太小或太大均不利于除铬,原因是_____ 。
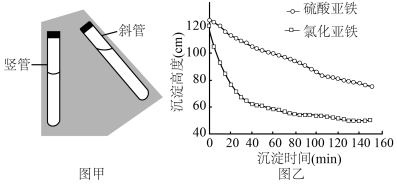
(3)研究不同工艺对沉降分离效率的影响_____ (填“竖管”或“斜管”)沉降池。
②铁源选择:其他条件不变,使用不同亚铁盐作铁源,“共沉淀”后的沉淀高度随沉淀时间的变化关系如图乙所示,理论上应选择作_____ 铁源,理由是_____ 。
(4)“加热氧化”时,通入压缩空气的作用是①将剩余 部分氧化为
部分氧化为 ;②
;②_____ 。
(5)已知国家《污水综合排放标准》中总铬污染物排放限值为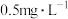 。废水经一次处理后的总铬去除率达
。废水经一次处理后的总铬去除率达 ,出水
,出水_____ (填“直接排放”或“循环处理”)。
(6)含铬复合铁氧体立方晶胞如图所示。 的核外电子排布式为
的核外电子排布式为_____ 。
②铬复合铁氧体中 数目与
数目与 、
、 数目之和的比值为
数目之和的比值为_____ 。
③铬复合铁氧体的密度为_____  (用含
(用含 、
、 的式子表示)。
的式子表示)。
 的废水(主要成分为
的废水(主要成分为 ,pH约为4.3),同时回收含铬复合铁氧体
,pH约为4.3),同时回收含铬复合铁氧体 ,工艺流程如下:
,工艺流程如下:
 是两性氢氧化物。
是两性氢氧化物。(1)“还原”时发生反应的离子方程式为
(2)“共沉淀”时
 太小或太大均不利于除铬,原因是
太小或太大均不利于除铬,原因是(3)研究不同工艺对沉降分离效率的影响
②铁源选择:其他条件不变,使用不同亚铁盐作铁源,“共沉淀”后的沉淀高度随沉淀时间的变化关系如图乙所示,理论上应选择作
(4)“加热氧化”时,通入压缩空气的作用是①将剩余
 部分氧化为
部分氧化为 ;②
;②(5)已知国家《污水综合排放标准》中总铬污染物排放限值为
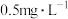 。废水经一次处理后的总铬去除率达
。废水经一次处理后的总铬去除率达 ,出水
,出水(6)含铬复合铁氧体立方晶胞如图所示。
 的核外电子排布式为
的核外电子排布式为②铬复合铁氧体中
 数目与
数目与 、
、 数目之和的比值为
数目之和的比值为③铬复合铁氧体的密度为
 (用含
(用含 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次



