解题方法
1 . 高铁酸钾 是一种暗紫色固体,在强碱性溶液中稳定,但在
是一种暗紫色固体,在强碱性溶液中稳定,但在 催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量
催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量 、
、 等)制备高铁酸钾的工艺流程如图所示:
等)制备高铁酸钾的工艺流程如图所示:
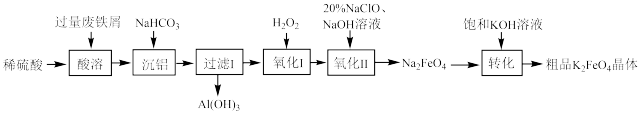
(1) 属于
属于___________ (填“酸”“碱”“盐”或“氧化物”),其中铁元素的化合价为___________ 价。
(2)加入 的目的是调节pH除铝,同时有气体生成,反应的离子方程式为
的目的是调节pH除铝,同时有气体生成,反应的离子方程式为________ 。
(3)“氧化I”发生反应的离子方程式为___________ 。
(4)“氧化Ⅱ”过程中每生成1mol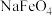 转移
转移___________ mol电子。
(5)水处理时,加入 作为净水消毒剂,发生反应的化学方程式为
作为净水消毒剂,发生反应的化学方程式为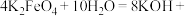
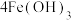 (胶体)
(胶体)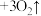 。
。 能用于消毒净水的原因是
能用于消毒净水的原因是___________ 。
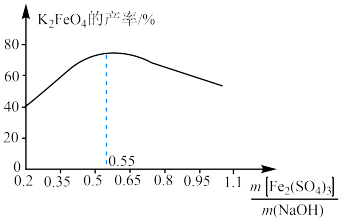
(6)在控制其他条件不变的情况下,改变 和NaOH的质量比对
和NaOH的质量比对 产率的影响如图所示,当二者质量比大于0.55时,随
产率的影响如图所示,当二者质量比大于0.55时,随 增大,
增大, 的产率下降的原因可能是
的产率下降的原因可能是___________ 。
(7)向 溶液中滴加
溶液中滴加 盐酸,产生黄绿色气体,说明
盐酸,产生黄绿色气体,说明 的氧化性
的氧化性________ (填“强”或“弱”)于 。另一种制备
。另一种制备 的反应原理为
的反应原理为 ,请分析
,请分析 和
和 的氧化性强弱关系相反的原因是
的氧化性强弱关系相反的原因是___________ 。
 是一种暗紫色固体,在强碱性溶液中稳定,但在
是一种暗紫色固体,在强碱性溶液中稳定,但在 催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量
催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量 、
、 等)制备高铁酸钾的工艺流程如图所示:
等)制备高铁酸钾的工艺流程如图所示:
(1)
 属于
属于(2)加入
 的目的是调节pH除铝,同时有气体生成,反应的离子方程式为
的目的是调节pH除铝,同时有气体生成,反应的离子方程式为(3)“氧化I”发生反应的离子方程式为
(4)“氧化Ⅱ”过程中每生成1mol
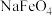 转移
转移(5)水处理时,加入
 作为净水消毒剂,发生反应的化学方程式为
作为净水消毒剂,发生反应的化学方程式为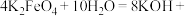
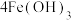 (胶体)
(胶体)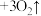 。
。 能用于消毒净水的原因是
能用于消毒净水的原因是(6)在控制其他条件不变的情况下,改变
 和NaOH的质量比对
和NaOH的质量比对 产率的影响如图所示,当二者质量比大于0.55时,随
产率的影响如图所示,当二者质量比大于0.55时,随 增大,
增大, 的产率下降的原因可能是
的产率下降的原因可能是
(7)向
 溶液中滴加
溶液中滴加 盐酸,产生黄绿色气体,说明
盐酸,产生黄绿色气体,说明 的氧化性
的氧化性 。另一种制备
。另一种制备 的反应原理为
的反应原理为 ,请分析
,请分析 和
和 的氧化性强弱关系相反的原因是
的氧化性强弱关系相反的原因是
您最近一年使用:0次
解题方法
2 . 硫代硫酸钠( )俗称大苏打,是化学常用试剂。回答下列问题:
)俗称大苏打,是化学常用试剂。回答下列问题:
(1) 中S的平均化合价为
中S的平均化合价为_______ 。从组成角度分类,它属于_______ (填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2) 在碱性条件下稳定存在,在酸性条件下不稳定。向
在碱性条件下稳定存在,在酸性条件下不稳定。向 溶液中滴加盐酸,溶液变浑浊,析出浅黄色固体(单质)并放出刺激性气味的气体(相对分子质量为64),写出该反应的离子方程式:
溶液中滴加盐酸,溶液变浑浊,析出浅黄色固体(单质)并放出刺激性气味的气体(相对分子质量为64),写出该反应的离子方程式:_______ 。
(3)在定量实验中,常用 溶液测定溶液中
溶液测定溶液中 含量,发生反应的化学方程式为
含量,发生反应的化学方程式为 。若某次实验中恰好消耗200mL
。若某次实验中恰好消耗200mL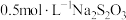 溶液,理论上转移电子数目约为
溶液,理论上转移电子数目约为_______ 。
(4)某实验需要使用250mL 溶液,用
溶液,用 配制该溶液。
配制该溶液。
①配制过程中,下列仪器不需要选用的是_______ (填字母)。
A. B.
B. C.
C. D.
D.
②若其他操作均正确,定容时俯视刻度线,配制的溶液浓度_______ (填“偏小”“偏大”或“无影响”,下同);容量瓶没有干燥,配制的溶液浓度_______ 。
 )俗称大苏打,是化学常用试剂。回答下列问题:
)俗称大苏打,是化学常用试剂。回答下列问题:(1)
 中S的平均化合价为
中S的平均化合价为A.酸 B.碱 C.盐 D.氧化物
(2)
 在碱性条件下稳定存在,在酸性条件下不稳定。向
在碱性条件下稳定存在,在酸性条件下不稳定。向 溶液中滴加盐酸,溶液变浑浊,析出浅黄色固体(单质)并放出刺激性气味的气体(相对分子质量为64),写出该反应的离子方程式:
溶液中滴加盐酸,溶液变浑浊,析出浅黄色固体(单质)并放出刺激性气味的气体(相对分子质量为64),写出该反应的离子方程式:(3)在定量实验中,常用
 溶液测定溶液中
溶液测定溶液中 含量,发生反应的化学方程式为
含量,发生反应的化学方程式为 。若某次实验中恰好消耗200mL
。若某次实验中恰好消耗200mL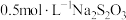 溶液,理论上转移电子数目约为
溶液,理论上转移电子数目约为(4)某实验需要使用250mL
 溶液,用
溶液,用 配制该溶液。
配制该溶液。①配制过程中,下列仪器不需要选用的是
A.
 B.
B. C.
C. D.
D.
②若其他操作均正确,定容时俯视刻度线,配制的溶液浓度
您最近一年使用:0次
3 . 按图示装置进行实验。打开装置Ⅰ中分液漏斗活塞,将浓盐酸全部加入锥形瓶中,关闭活塞。下列说法不正确的是


A.Ⅰ中生成大量黄绿色气体,说明氧化性: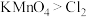 |
B.Ⅱ中湿润的红色布条褪色,说明 具有漂白性 具有漂白性 |
C.Ⅲ中溶液变为红色,说明 的还原性比 的还原性比 强 强 |
D.Ⅳ中可获得漂白粉,说明 既有氧化性,又有还原性 既有氧化性,又有还原性 |
您最近一年使用:0次
解题方法
4 . Na2S2O4(保险粉)是一种强还原剂,锌粉法制备Na2S2O4.所发生的化学方程式如下:2SO2+Zn+2NaOH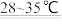 Na2S2O4+Zn(OH)2↓,下列有关该反应的说法
Na2S2O4+Zn(OH)2↓,下列有关该反应的说法不正确 的是
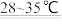 Na2S2O4+Zn(OH)2↓,下列有关该反应的说法
Na2S2O4+Zn(OH)2↓,下列有关该反应的说法| A.保险粉(Na2S2O4)中,S的化合价为+3价 |
| B.控制温度在28~35℃应该采用水浴加热 |
| C.在该反应中SO2做氧化剂,Zn(OH)2作氧化产物 |
| D.消耗标况下22.4L的SO2,转移的电子数为2NA |
您最近一年使用:0次
5 . 二氧化氯( ,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠(
,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠( )制备
)制备 。制备
。制备 及验证其氧化性的装置如图所示(部分夹持装置已省略):
及验证其氧化性的装置如图所示(部分夹持装置已省略):

已知:实验室可用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放
,使用时加酸只释放 一种气体;酸性条件下高锰酸钾的还原产物为
一种气体;酸性条件下高锰酸钾的还原产物为 。回答下列问题:
。回答下列问题:
(1)盛装浓盐酸的仪器名称为_______ 。
(2)装置A中发生反应的离子方程式为_______ 。
(3)装置B中盛放的试剂是_______ 。
(4)向装置D中通入 的目的是
的目的是_______ ,装置D中发生反应的化学方程式为_______ 。
(5)装置G中能观察到溶液显红色,则发生反应的离子方程式为_______ 、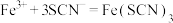 。
。
(6)用 替代
替代 作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率(
作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率( ),那么消毒杀菌剂消毒效率:
),那么消毒杀菌剂消毒效率: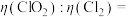
_______ (保留到小数点后两位)。
 ,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠(
,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠( )制备
)制备 。制备
。制备 及验证其氧化性的装置如图所示(部分夹持装置已省略):
及验证其氧化性的装置如图所示(部分夹持装置已省略):
已知:实验室可用稳定剂吸收
 ,生成
,生成 ,使用时加酸只释放
,使用时加酸只释放 一种气体;酸性条件下高锰酸钾的还原产物为
一种气体;酸性条件下高锰酸钾的还原产物为 。回答下列问题:
。回答下列问题:(1)盛装浓盐酸的仪器名称为
(2)装置A中发生反应的离子方程式为
(3)装置B中盛放的试剂是
(4)向装置D中通入
 的目的是
的目的是(5)装置G中能观察到溶液显红色,则发生反应的离子方程式为
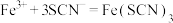 。
。(6)用
 替代
替代 作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率(
作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率( ),那么消毒杀菌剂消毒效率:
),那么消毒杀菌剂消毒效率: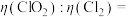
您最近一年使用:0次
名校
解题方法
6 . 化学与生产、生活密切相关。下列对应关系错误的是
| A.湿手不可以直接接触电源——电解质溶液能够导电 |
| B.食物腐败——涉及氧化还原反应 |
C.漂白液可作消毒剂——漂白液的有效成分是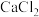 |
| D.下水井盖由生铁铸造——生铁硬度高于纯铁 |
您最近一年使用:0次
解题方法
7 . 铁和铝是两种重要的金属,它们的单质及其化合物有着各自的用途。用工业烧渣(主要成分为 、
、 ,含少量FeO等)回收并分离
,含少量FeO等)回收并分离 和
和 ,工艺流程图如下所示:
,工艺流程图如下所示:

已知: 。
。
回答下列问题:
(1)“烧渣”中加入NaOH溶液发生反应的化学方程式为___________ 。
(2)“物质X”的俗称为___________ 。物质X也可以通过向饱和氯化钠溶液中先后通入足量的氨气和二氧化碳制得,写出反应的化学方程式:___________ 。
(3)向“滤渣I”中加入盐酸溶解后,再加入双氧水的目的是___________ ,发生反应的离子方程式为___________ 。
(4)写出“物质Y”的一种用途:___________ 。
(5)若将“滤渣1”用适量硫酸恰好完全溶解后,进行过滤得到 和
和 的混合溶液。通过元素分析测得其中Fe和S的物质的量之比
的混合溶液。通过元素分析测得其中Fe和S的物质的量之比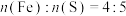 ,则此溶液中
,则此溶液中 和
和 的物质的量之比为
的物质的量之比为___________ 。
 、
、 ,含少量FeO等)回收并分离
,含少量FeO等)回收并分离 和
和 ,工艺流程图如下所示:
,工艺流程图如下所示:
已知:
 。
。回答下列问题:
(1)“烧渣”中加入NaOH溶液发生反应的化学方程式为
(2)“物质X”的俗称为
(3)向“滤渣I”中加入盐酸溶解后,再加入双氧水的目的是
(4)写出“物质Y”的一种用途:
(5)若将“滤渣1”用适量硫酸恰好完全溶解后,进行过滤得到
 和
和 的混合溶液。通过元素分析测得其中Fe和S的物质的量之比
的混合溶液。通过元素分析测得其中Fe和S的物质的量之比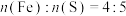 ,则此溶液中
,则此溶液中 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
8 . 下列生产生活现象对应的解释错误 的是
选项 | 生产生活现象 | 对应的解释 |
A | 铵态氨肥不能与碱性物质混合施用 | 二者能发生反应 |
B | “卤水”点豆腐 | 电解质与胶体发生化学反应 |
C | 补铁剂与维C共服,促进铁元素的吸收 | 维C具有还原性 |
D | 戴N95口罩防流感病毒 | N95口罩有吸附、过滤等作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 工业上可用以下方案使饮用水中 含量达标。
含量达标。
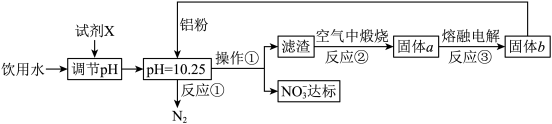
已知:滤渣的成分为Al(OH)3,pH>12时Al(OH)3开始溶解。
(1)流程中操作①的名称为___________ ,从经济角度考虑,试剂X可以选用___________ (请填字母)。
a.CuO b.Ca(OH)2 c.NH3
(2)请写出固体a的化学式___________ 。
(3)写出反应①中铝粉和 反应的离子方程式
反应的离子方程式___________ ;如果该溶液酸碱度调节至酸性过强或碱性过强,可能出现滤渣的质量减少,其原因可能是___________ 。
(4)如果在化学实验室中模拟反应②的进行,需要选择___________ (实验仪器)盛放Al(OH)3进行煅烧操作。
(5)也可以使用Fe2+与 反应,使其含量达标。FeC2O4(草酸亚铁)常用作分析试剂,在配制一定浓度FeC2O4溶液过程中,溶液的浓度将偏低的是
反应,使其含量达标。FeC2O4(草酸亚铁)常用作分析试剂,在配制一定浓度FeC2O4溶液过程中,溶液的浓度将偏低的是___________ (填序号)。
①容量瓶在使用前未干燥,里面有少量蒸馏水
②忘记将洗涤液转入容量瓶
③定容时俯视容量瓶刻度线
④定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
 含量达标。
含量达标。
已知:滤渣的成分为Al(OH)3,pH>12时Al(OH)3开始溶解。
(1)流程中操作①的名称为
a.CuO b.Ca(OH)2 c.NH3
(2)请写出固体a的化学式
(3)写出反应①中铝粉和
 反应的离子方程式
反应的离子方程式(4)如果在化学实验室中模拟反应②的进行,需要选择
(5)也可以使用Fe2+与
 反应,使其含量达标。FeC2O4(草酸亚铁)常用作分析试剂,在配制一定浓度FeC2O4溶液过程中,溶液的浓度将偏低的是
反应,使其含量达标。FeC2O4(草酸亚铁)常用作分析试剂,在配制一定浓度FeC2O4溶液过程中,溶液的浓度将偏低的是①容量瓶在使用前未干燥,里面有少量蒸馏水
②忘记将洗涤液转入容量瓶
③定容时俯视容量瓶刻度线
④定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
您最近一年使用:0次
10 . 化学与生活、生产息息相关。请回答下列问题:
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有______ (填序号,下同),属于非电解质的有______ 。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为____________ 。
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为_________ 。
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式:______ 。
______C+______K2Cr2O7+______H2SO4=______K2SO4+______CO2↑+______Cr2(SO4)3+______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为______ 。
③H2SO4在上述反应中表现出来的性质是______ (填选项编号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式:
______C+______K2Cr2O7+______H2SO4=______K2SO4+______CO2↑+______Cr2(SO4)3+______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为
③H2SO4在上述反应中表现出来的性质是
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
您最近一年使用:0次



