解题方法
1 . ZnO是制备各种含锌材料的原料,在电镀、医疗上有广泛应用。一种以菱锌矿(主要成分为 ,杂质为
,杂质为 以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
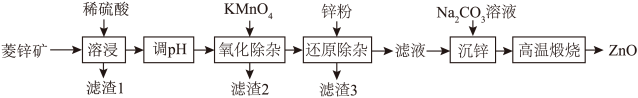
已知:①“溶浸”后的溶液中金属离子主要有: 、
、 、
、 、
、 。
。
②在本实验条件下, 不能被氧化;弱酸性溶液中
不能被氧化;弱酸性溶液中 能将
能将 氧化生成
氧化生成 。
。
③生成氢氧化物沉淀的pH见下表:
回答下列问题:
(1)“溶浸”实验中,锌的浸出率结果如下图所示,由图可知,当锌的浸出率为70%时,所采用的实验条件为___________ 。

(2)“调pH”中,向“溶浸”后的溶液中加入___________ (填化学式)调节pH约为5。
(3)“氧化除杂”中发生反应的离子方程式分别是:① ,②
,②___________ 。
(4)“还原除杂”中,滤渣3的主要成分是___________ 及过量的锌粉,“还原除杂”的反应类型为___________ 。
(5)“沉锌”后,沉淀要用水洗,检查沉淀是否洗涤干净的方法是___________ 。
(6)“沉锌”生成碱式碳酸锌的成分可能是 ,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=
,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=___________ 。
 ,杂质为
,杂质为 以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
已知:①“溶浸”后的溶液中金属离子主要有:
 、
、 、
、 、
、 。
。②在本实验条件下,
 不能被氧化;弱酸性溶液中
不能被氧化;弱酸性溶液中 能将
能将 氧化生成
氧化生成 。
。③生成氢氧化物沉淀的pH见下表:
| 物质 |  |  |  |  |  |
| 开始沉淀时的pH | 1.5 | 6.3 | 6.2 | 6.9 | 8.1 |
| 沉淀完全时的pH | 2.8 | 8.3 | 8.2 | 8.9 | 10.1 |
(1)“溶浸”实验中,锌的浸出率结果如下图所示,由图可知,当锌的浸出率为70%时,所采用的实验条件为

(2)“调pH”中,向“溶浸”后的溶液中加入
(3)“氧化除杂”中发生反应的离子方程式分别是:①
 ,②
,②(4)“还原除杂”中,滤渣3的主要成分是
(5)“沉锌”后,沉淀要用水洗,检查沉淀是否洗涤干净的方法是
(6)“沉锌”生成碱式碳酸锌的成分可能是
 ,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=
,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=
您最近一年使用:0次
名校
2 . 使用相关化学用语回答下列问题:
(1)用化学方程式表示金属钠的工业制法:___________ ;
(2)用化学方程式表示高炉炼铁的反应原理:___________ ;
(3)实验室使用 和浓盐酸制备氯气的反应离子方程式:
和浓盐酸制备氯气的反应离子方程式:___________ ;
(4)通过氯碱工业制备氯气的离子方程式:___________ ;
(5)用化学方程式表示氨气实验室制法的反应原理:___________ ;
(6)实验室制乙烯的化学反应方程式:___________ ;
(7)实验室制乙炔的化学反应方程式:___________ ;
(8)泡沫灭火器反应原理的离子方程式:___________ 。
(1)用化学方程式表示金属钠的工业制法:
(2)用化学方程式表示高炉炼铁的反应原理:
(3)实验室使用
 和浓盐酸制备氯气的反应离子方程式:
和浓盐酸制备氯气的反应离子方程式:(4)通过氯碱工业制备氯气的离子方程式:
(5)用化学方程式表示氨气实验室制法的反应原理:
(6)实验室制乙烯的化学反应方程式:
(7)实验室制乙炔的化学反应方程式:
(8)泡沫灭火器反应原理的离子方程式:
您最近一年使用:0次
3 . NOx是空气的污染物,废水中的氨氮(以NH3、NH 存在)和硝态氮(以NO
存在)和硝态氮(以NO 、NO
、NO 存在)会引起水体富营养化,需经处理后才能排放。
存在)会引起水体富营养化,需经处理后才能排放。
(1)电解氧化吸收法可将废气中的 NOx转变为NO 。电解 0.1 mol·L-1NaCl 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图-1 所示。向 0.1 mol·L-1NaCl 溶液中通入 NO,测得电流强度与 NO 的脱除率的关系如图-2 所示。
。电解 0.1 mol·L-1NaCl 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图-1 所示。向 0.1 mol·L-1NaCl 溶液中通入 NO,测得电流强度与 NO 的脱除率的关系如图-2 所示。
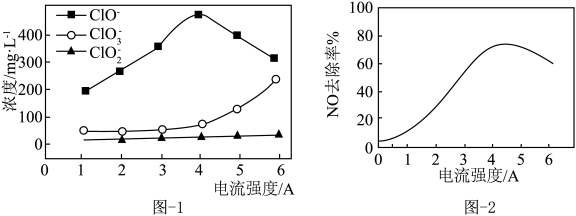
①电解NaCl溶液作吸收液时,若电流强度为4A,吸收NO 的反应离子方程式为_______ 。
②当电流强度大于 4A 后,NO去除率下降,其原因是_______ 。
(2)某氮肥厂处理氨氮废水的方案如图,回答下列问题:
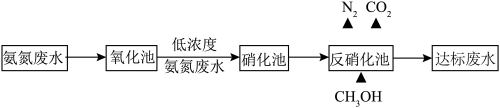
①“氧化池”中可用活性炭—臭氧可处理高浓度氨氮废水。氧化机理如图-3 所示。*表示吸附在活性炭表面的物种,·OH 为羟基自由基。其它条件不变,调节 pH,废水中氨氮去除率随 pH 的变化如图-4 所示。随 pH 增大氨氮去除率先明显增大后变化较小的可能原因是_______ 。

②“反硝化池”中发生的变化为:HNO3→ →N2。1 mol HNO3完全转化理论上消耗甲醇的质量为
→N2。1 mol HNO3完全转化理论上消耗甲醇的质量为_______ 。
(3)纳米Fe 可还原去除水中的硝酸盐污染物。
已知:i.纳米 Fe 具有很高的活性,易被氧化使表面形成氧化层
ii.纳米 Fe 将 还原为
还原为 的转化关系如下:
的转化关系如下:


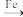

①纳米 Fe 的制备原理:FeSO4+2NaBH4+6H2O=2B(OH)3+Fe+7H2↑+Na2SO4; 已知电负性 H>B,则该反应中氧化剂是_______ (填化学式) 。
②检验还原后的溶液中存在 的实验方法是
的实验方法是_______ 。
③溶液初始 pH 较低有利于 的去除,其可能的原因是
的去除,其可能的原因是_______ 。
 存在)和硝态氮(以NO
存在)和硝态氮(以NO 、NO
、NO 存在)会引起水体富营养化,需经处理后才能排放。
存在)会引起水体富营养化,需经处理后才能排放。(1)电解氧化吸收法可将废气中的 NOx转变为NO
 。电解 0.1 mol·L-1NaCl 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图-1 所示。向 0.1 mol·L-1NaCl 溶液中通入 NO,测得电流强度与 NO 的脱除率的关系如图-2 所示。
。电解 0.1 mol·L-1NaCl 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图-1 所示。向 0.1 mol·L-1NaCl 溶液中通入 NO,测得电流强度与 NO 的脱除率的关系如图-2 所示。
①电解NaCl溶液作吸收液时,若电流强度为4A,吸收NO 的反应离子方程式为
②当电流强度大于 4A 后,NO去除率下降,其原因是
(2)某氮肥厂处理氨氮废水的方案如图,回答下列问题:

①“氧化池”中可用活性炭—臭氧可处理高浓度氨氮废水。氧化机理如图-3 所示。*表示吸附在活性炭表面的物种,·OH 为羟基自由基。其它条件不变,调节 pH,废水中氨氮去除率随 pH 的变化如图-4 所示。随 pH 增大氨氮去除率先明显增大后变化较小的可能原因是

②“反硝化池”中发生的变化为:HNO3→
 →N2。1 mol HNO3完全转化理论上消耗甲醇的质量为
→N2。1 mol HNO3完全转化理论上消耗甲醇的质量为(3)纳米Fe 可还原去除水中的硝酸盐污染物。
已知:i.纳米 Fe 具有很高的活性,易被氧化使表面形成氧化层
ii.纳米 Fe 将
 还原为
还原为 的转化关系如下:
的转化关系如下:
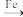

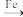

①纳米 Fe 的制备原理:FeSO4+2NaBH4+6H2O=2B(OH)3+Fe+7H2↑+Na2SO4; 已知电负性 H>B,则该反应中氧化剂是
②检验还原后的溶液中存在
 的实验方法是
的实验方法是③溶液初始 pH 较低有利于
 的去除,其可能的原因是
的去除,其可能的原因是
您最近一年使用:0次
名校
4 . 成都理工大学刘兴诗教授提出了三星堆青铜器源自四川彭州龙门山的猜想并展开科考活动,经过调查初步判断,三星堆的铜来自龙门山区。经调查,上世纪80~90年代,该地利用资源优势,大规模进行冶铜及生产大量附属产品。以黄铜矿为原料生产硫酸、铁红、胆矾的流程如下:

已知:黄铜矿中 含量不高,工业上一般通过浮选除去矿石中的其他成分,得到仅含
含量不高,工业上一般通过浮选除去矿石中的其他成分,得到仅含 的
的 (Fe化合价为+2价)矿粉。
(Fe化合价为+2价)矿粉。
回答下列问题:
(1)已知信息中涉及的“浮选”过程是为了使矿石中的 含量大大增加,该过程在工业上称为矿石(元素)的
含量大大增加,该过程在工业上称为矿石(元素)的_________ 。
(2)黄铜矿粉在空气中焙烧时的化学方程式为 ,该反应中还原产物为
,该反应中还原产物为___________ ,若有标准状况下的空气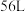 (假设空气中氧气的体积分数为
(假设空气中氧气的体积分数为 )参与反应,则反应过程中转移电子的物质的量为
)参与反应,则反应过程中转移电子的物质的量为___________ 。
(3)若在实验室环境下由固体C制得铁红,需要在___________ (填仪器名称)中进行。
(4)由气体B制硫酸的过程中,为了避免___________ ,用 的浓硫酸代替水进行气体的吸收。
的浓硫酸代替水进行气体的吸收。
(5)由固体B通过一系列操作制备 溶液的过程中,有以下四种方案:
溶液的过程中,有以下四种方案:
①固体B先在空气中充分灼烧,再用稀硫酸溶解,过滤;
②直接用浓硫酸溶解,过滤;
③边通空气边加热,在稀硫酸中溶解,过滤;
④在混酸(按一定比例混合的稀硝酸和稀硫酸)溶液中溶解,过滤;
ⅰ.方案②相对方案①,不足之处有___________ ;
ⅰ.方案③中发生反应的离子方程式为___________ ;
ⅲ.方案④中当金属和酸同时消耗完,所得溶液不含硝酸铜,则硝酸和硫酸的物质的量浓度比为___________ 时恰好满足。

已知:黄铜矿中
 含量不高,工业上一般通过浮选除去矿石中的其他成分,得到仅含
含量不高,工业上一般通过浮选除去矿石中的其他成分,得到仅含 的
的 (Fe化合价为+2价)矿粉。
(Fe化合价为+2价)矿粉。回答下列问题:
(1)已知信息中涉及的“浮选”过程是为了使矿石中的
 含量大大增加,该过程在工业上称为矿石(元素)的
含量大大增加,该过程在工业上称为矿石(元素)的(2)黄铜矿粉在空气中焙烧时的化学方程式为
 ,该反应中还原产物为
,该反应中还原产物为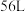 (假设空气中氧气的体积分数为
(假设空气中氧气的体积分数为 )参与反应,则反应过程中转移电子的物质的量为
)参与反应,则反应过程中转移电子的物质的量为(3)若在实验室环境下由固体C制得铁红,需要在
(4)由气体B制硫酸的过程中,为了避免
 的浓硫酸代替水进行气体的吸收。
的浓硫酸代替水进行气体的吸收。(5)由固体B通过一系列操作制备
 溶液的过程中,有以下四种方案:
溶液的过程中,有以下四种方案:①固体B先在空气中充分灼烧,再用稀硫酸溶解,过滤;
②直接用浓硫酸溶解,过滤;
③边通空气边加热,在稀硫酸中溶解,过滤;
④在混酸(按一定比例混合的稀硝酸和稀硫酸)溶液中溶解,过滤;
ⅰ.方案②相对方案①,不足之处有
ⅰ.方案③中发生反应的离子方程式为
ⅲ.方案④中当金属和酸同时消耗完,所得溶液不含硝酸铜,则硝酸和硫酸的物质的量浓度比为
您最近一年使用:0次
5 . 黄铁矿制硫酸的副产物硒酸泥中含有较高品位的硒元素(其主要成分含量如下表所示),硒酸泥可用于制取硒单质。
步骤1:粗硒的制备

步骤2:粗硒的精制
回答下列问题:
(1)步骤1中“浸取”的主要目的是为了除去硒酸泥中的___________ (填化学式),采取“热过滤”的主要原因是___________ 。
(2)步骤1中“氧化浸硒”时主要生成H2SeO3和C1O2,当NaClO3过量会有副产物H2SeO4生成。H2SeO3的化学名称为___________ ,生成H2SeO4的化学方程式为___________ 。反应过程中稀硫酸的浓度要大于3mol·L-1,原因是___________ 。
(3)步骤1中“还原”时硫脲[(NH2)2CS]和Na2SO3均为还原剂。酸性条件下,硫脲转化成(SCN2H3)2的半反应式为___________ 。若硫脲按此半反应式发生转化,则等物质的量的(NH2)2CS和Na2 SO3,还原能力较强的是___________ 。
(4)步骤2中“净化”时,Na2SeSO3溶液中少量的Fe2+转化为FeS沉淀而除去,若沉淀完全后要求Fe2+的浓度小于0.56mg·L-1,则此时溶液中的c(S2-)>___________ mol·L-1[ ]。
]。
(5)步骤2中“酸化”时发生反应的离子方程式为___________ 。
| 成分 | Se | S | Fe2O3 | SiO2 | CuO | ZnO |
| 质量分数(%) | 9.10 | 23.80 | 65.01 | 0.31 | 0.87 | 0.91 |

步骤2:粗硒的精制

回答下列问题:
(1)步骤1中“浸取”的主要目的是为了除去硒酸泥中的
(2)步骤1中“氧化浸硒”时主要生成H2SeO3和C1O2,当NaClO3过量会有副产物H2SeO4生成。H2SeO3的化学名称为
(3)步骤1中“还原”时硫脲[(NH2)2CS]和Na2SO3均为还原剂。酸性条件下,硫脲转化成(SCN2H3)2的半反应式为
(4)步骤2中“净化”时,Na2SeSO3溶液中少量的Fe2+转化为FeS沉淀而除去,若沉淀完全后要求Fe2+的浓度小于0.56mg·L-1,则此时溶液中的c(S2-)>
 ]。
]。(5)步骤2中“酸化”时发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 硝酸铵(NH4NO3)是汽车安全气囊中经常用到的填充物,因汽车受到撞击,导致气囊中的硝酸铵分解而发生爆炸,生成空气中常见的两种物质和一种常见的液体氧化物,使气囊鼓起,避免人员受到伤害,根据以上信息,回答下列问题:
(1)写出汽车安全气囊中发生反应的化学方程式___________ ;
(2)该反应的氮元素化合价由___________ 变为___________ 。
(1)写出汽车安全气囊中发生反应的化学方程式
(2)该反应的氮元素化合价由
您最近一年使用:0次
名校
解题方法
7 . 锌是现代工业中不可或缺的重要金属。以闪锌矿(主要含ZnS,还含有 和少量FeS、CdS、PbS等杂质)为原料制备金属锌的工艺流程如下:
和少量FeS、CdS、PbS等杂质)为原料制备金属锌的工艺流程如下:

已知: 、
、 不溶于水且不与酸反应。
不溶于水且不与酸反应。
(1)焙烧:为了提高焙烧效率,通常在焙烧前将矿石___________ ,写出焙烧过程中ZnS发生反应的化学方程式___________ 。
(2)浸出:产生的滤渣的主要成分为___________ 。
(3)该工艺中可循环利用的物质X是___________ 。
 和少量FeS、CdS、PbS等杂质)为原料制备金属锌的工艺流程如下:
和少量FeS、CdS、PbS等杂质)为原料制备金属锌的工艺流程如下:
已知:
 、
、 不溶于水且不与酸反应。
不溶于水且不与酸反应。(1)焙烧:为了提高焙烧效率,通常在焙烧前将矿石
(2)浸出:产生的滤渣的主要成分为
(3)该工艺中可循环利用的物质X是
您最近一年使用:0次
名校
解题方法
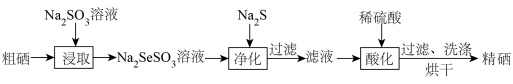
8 . 氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂等。一种用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有 、
、 、CuS、
、CuS、 、
、 、
、 及
及 )制备高纯氯氧化铋的工艺流程如下,回答下列问题:
)制备高纯氯氧化铋的工艺流程如下,回答下列问题:
已知:
①“浸铋”所得浸取液中含 、
、 等物质;
等物质; 极易水解:
极易水解:
② 微溶于水,在
微溶于水,在 浓度较大的溶液中,存在平衡:
浓度较大的溶液中,存在平衡: 。
。
(1)“浸铜”时有单质硫生成,发生反应的化学反应方程式为___________ 。
(2)“浸渣1”的主要成分为___________ (填化学式,下同);“浸铋”时含铅物质主要以___________ 存在。
(3)“浸铋”时需控制溶液的pH=3.0,盐酸的作用为:①充分浸出 、
、 和
和 等;②
等;②___________ 。
(4)“除铅、砷”是加入改性羟基磷灰石固体(HAP),“浸铋”所得浸取液与改性HAP的液固比与铅、砷去除率以及后续沉铋量的关系如下图所示(图中a<b<c<d),“除铅、砷”时应采用的最佳液固比为___________ (填“a”或“b”或“c”或“d”)。

(5)“沉铋”时发生反应的离子方程式为___________ 。
(6)已知“浸铋”、“除铅、砷”和“沉铋”各环节中Bi元素的利用率分别为70%、80%和80%,忽略其他环节Bi元素的损失,则Bi元素的总利用率为___________ 。
 、
、 、CuS、
、CuS、 、
、 、
、 及
及 )制备高纯氯氧化铋的工艺流程如下,回答下列问题:
)制备高纯氯氧化铋的工艺流程如下,回答下列问题:
已知:
①“浸铋”所得浸取液中含
 、
、 等物质;
等物质; 极易水解:
极易水解:②
 微溶于水,在
微溶于水,在 浓度较大的溶液中,存在平衡:
浓度较大的溶液中,存在平衡: 。
。(1)“浸铜”时有单质硫生成,发生反应的化学反应方程式为
(2)“浸渣1”的主要成分为
(3)“浸铋”时需控制溶液的pH=3.0,盐酸的作用为:①充分浸出
 、
、 和
和 等;②
等;②(4)“除铅、砷”是加入改性羟基磷灰石固体(HAP),“浸铋”所得浸取液与改性HAP的液固比与铅、砷去除率以及后续沉铋量的关系如下图所示(图中a<b<c<d),“除铅、砷”时应采用的最佳液固比为

(5)“沉铋”时发生反应的离子方程式为
(6)已知“浸铋”、“除铅、砷”和“沉铋”各环节中Bi元素的利用率分别为70%、80%和80%,忽略其他环节Bi元素的损失,则Bi元素的总利用率为
您最近一年使用:0次
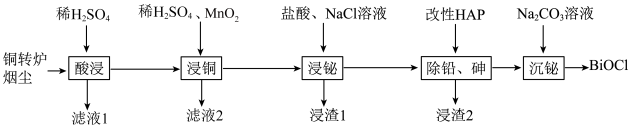
9 . 硫酸在工农业生产和国防工业中有着广泛的应用,其中 (不溶于水)是硫酸工业重要的催化剂,其废催化剂中含有
(不溶于水)是硫酸工业重要的催化剂,其废催化剂中含有 、
、 (易溶于水)和不溶性残渣,利用废弃催化剂回收
(易溶于水)和不溶性残渣,利用废弃催化剂回收 的工业流程如下图所示,回答下面问题:
的工业流程如下图所示,回答下面问题:
(1)滤液1的主要溶质是________ (填化学式),操作II中用到的玻璃仪器有_________ 。
(2)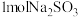 理论上能还原
理论上能还原___________ 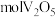 。
。
(3)写出混合液与 反应的离子方程式
反应的离子方程式___________ 。
(4)一系列操作包括先用乙醇洗涤滤渣,再用乙醚洗涤,用乙醚洗涤的作用是___________ 、___________ 。(答两点作用)
(5)写出含 溶液与过量氨水反应的离子方程式
溶液与过量氨水反应的离子方程式___________ 。使用过量氨水有利于 的析出,利用平衡移动原理进行解释:
的析出,利用平衡移动原理进行解释:___________ 。
(6)我国科学家设计了如下装置来制备 和
和 ,
,
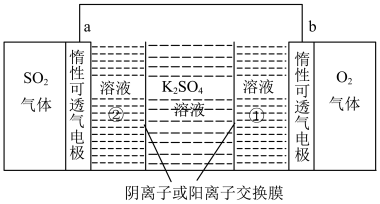
溶液①是___________ (填化学式)电极 的电极反应是
的电极反应是___________ 。
 (不溶于水)是硫酸工业重要的催化剂,其废催化剂中含有
(不溶于水)是硫酸工业重要的催化剂,其废催化剂中含有 、
、 (易溶于水)和不溶性残渣,利用废弃催化剂回收
(易溶于水)和不溶性残渣,利用废弃催化剂回收 的工业流程如下图所示,回答下面问题:
的工业流程如下图所示,回答下面问题:
(1)滤液1的主要溶质是
(2)
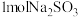 理论上能还原
理论上能还原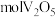 。
。(3)写出混合液与
 反应的离子方程式
反应的离子方程式(4)一系列操作包括先用乙醇洗涤滤渣,再用乙醚洗涤,用乙醚洗涤的作用是
(5)写出含
 溶液与过量氨水反应的离子方程式
溶液与过量氨水反应的离子方程式 的析出,利用平衡移动原理进行解释:
的析出,利用平衡移动原理进行解释:(6)我国科学家设计了如下装置来制备
 和
和 ,
,
溶液①是
 的电极反应是
的电极反应是
您最近一年使用:0次
名校
10 . 高压氢还原法可直接从溶液中提取金属。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如图。
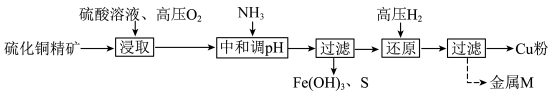
(1)浸取前,通常将硫化铜精矿粉碎的目的是_________ 。
(2)写出通入高压O2时硫化铜发生反应的化学方程式:_________ 。
(3)第一次过滤后的溶液中所含的阳离子有Cu2+、H+、_______ 、_______ 。通入高压H2时发生的反应中氧化剂和还原剂的物质的量之比为________ 。
(4)通入高压H2时,Cu2+先于M2+被还原出来的原因为________ 。
(5)若取10kg质量分数为84%的硫化铜精矿经过上述流程(铜元素在整个流程中损失率为5%,则可制得Cu粉的质量为________ kg。

(1)浸取前,通常将硫化铜精矿粉碎的目的是
(2)写出通入高压O2时硫化铜发生反应的化学方程式:
(3)第一次过滤后的溶液中所含的阳离子有Cu2+、H+、
(4)通入高压H2时,Cu2+先于M2+被还原出来的原因为
(5)若取10kg质量分数为84%的硫化铜精矿经过上述流程(铜元素在整个流程中损失率为5%,则可制得Cu粉的质量为
您最近一年使用:0次



