1 . 随着新能源汽车的不断发展,从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已经刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
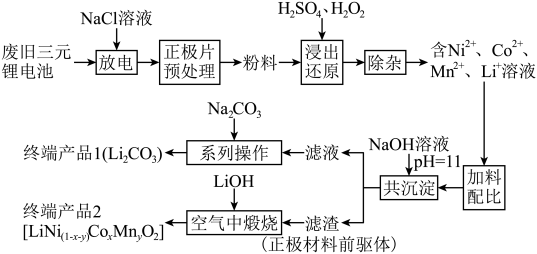
查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。
b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第_______ 周期第_______ 族。
(2)写出粉料中的 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:______________________________________________ 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为_______  ,浸出时间为
,浸出时间为_______  。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:_____________________ 。

(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式_____________________ 。
(5)“共沉淀”后的滤液中含有大量 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:_______ 、_______ 、洗涤、干燥。
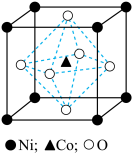
(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为_______ ;已知晶胞参数为 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
_______  。(列出计算式)
。(列出计算式)

查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为
 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第
(2)写出粉料中的
 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为
 ,浸出时间为
,浸出时间为 。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:
(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式
(5)“共沉淀”后的滤液中含有大量
 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为
 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
名校
解题方法
2 . 以黄铜矿(主要成分为CuFeS2)为原料,用(NH4)2S2O8溶液作浸取剂提取铜。
已知:i.S2O 的结构式为
的结构式为 。
。
ii.CuFeS2、Ag2S均能导电。
(1)(NH4)2S2O8有强氧化性,用(NH4)2S2O8溶液作浸取剂浸出CuFeS2的原理示意图如下。

①正极的电极反应式为___________ 。
②浸取初期,随着浸泡时间延长,Cu2+的浸出速率提高。可能的原因是___________ 。
(2)在足量 (NH4)2S2O8溶液中添加少量AgNO3溶液作为浸取剂与CuFeS2作用,一段时间结果如下:
①结合离子方程式解释添加Ag+ 可以显著提高Cu元素的浸出率的原因:___________ 。
②进一步研究发现添加的少量Ag+ 可以多次循环使用,具有类似“催化剂”的作用。其中Ag+“再生”的离子方程式为:___________ 。
(3)进一步从浸出液中提取铜并使(NH4)2S2O8再生的流程示意图如下。

①在空气中焙烧FeC2O4得到铁红,反应的化学方程式为___________ 。
②由滤液B电解(Pt作电极)生成(NH4)2S2O8的总反应的离子方程式为___________ 。
③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:___________ 。
已知:i.S2O
 的结构式为
的结构式为 。
。ii.CuFeS2、Ag2S均能导电。
(1)(NH4)2S2O8有强氧化性,用(NH4)2S2O8溶液作浸取剂浸出CuFeS2的原理示意图如下。

①正极的电极反应式为
②浸取初期,随着浸泡时间延长,Cu2+的浸出速率提高。可能的原因是
(2)在足量 (NH4)2S2O8溶液中添加少量AgNO3溶液作为浸取剂与CuFeS2作用,一段时间结果如下:
| 添加Ag+ | 未加Ag+ | |
| Cu元素的浸出率 | 98.02% | 30.90% |
| 过程中产物形态 |  |  |
②进一步研究发现添加的少量Ag+ 可以多次循环使用,具有类似“催化剂”的作用。其中Ag+“再生”的离子方程式为:
(3)进一步从浸出液中提取铜并使(NH4)2S2O8再生的流程示意图如下。

①在空气中焙烧FeC2O4得到铁红,反应的化学方程式为
②由滤液B电解(Pt作电极)生成(NH4)2S2O8的总反应的离子方程式为
③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:
您最近一年使用:0次
2024-02-23更新
|
221次组卷
|
3卷引用:北京市第一七一中学2023-2024学年高三下学期开学考试化学试题
名校
3 . 水合硼酸锌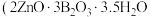 ,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为
,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为 ,以及少量
,以及少量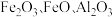 和
和 等)和菱锌矿(主要成分为
等)和菱锌矿(主要成分为 ,
,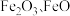 和
和 等)为原料制备水合硼酸锌的工艺流程如下:
等)为原料制备水合硼酸锌的工艺流程如下: 如下表所示:
如下表所示:
(1)“酸浸”时, 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为___________ 。为加快“酸浸”时的浸取速率,下列措施中无法达到目的是___________ (填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加硫酸浓度 e.适当升高温度
(2)滤渣1的主要成分为___________ (填化学式)。
(3)“氧化”的目的是___________ (语言叙述), 也可以用
也可以用 代替,若“氧化”过程中转移电子数相等,则消耗
代替,若“氧化”过程中转移电子数相等,则消耗 和
和 的物质的量之比为
的物质的量之比为___________ 。
(4)“一次调 ”时,调节溶液的
”时,调节溶液的 ,目的是
,目的是___________ 。“二次调 ”时的
”时的 范围为
范围为___________ 。
(5)“制备”水合硼酸锌的化学方程式为___________ 。
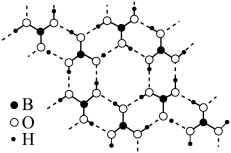
(6)䂽酸的一种片层状结构如图所示。层内的硼酸分子通过氢键相连。 硼酸晶体中含有
硼酸晶体中含有___________  氢键,硼酸晶体内所含有作用力类型除了氢键外,还有
氢键,硼酸晶体内所含有作用力类型除了氢键外,还有___________ 。
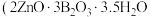 ,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为
,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为 ,以及少量
,以及少量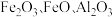 和
和 等)和菱锌矿(主要成分为
等)和菱锌矿(主要成分为 ,
,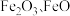 和
和 等)为原料制备水合硼酸锌的工艺流程如下:
等)为原料制备水合硼酸锌的工艺流程如下:
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |  |
开始沉淀 | 1.9 | 7.0 | 3.0 | 6.2 | 8.9 |
完全沉淀 | 3.2 | 9.0 | 4.7 | 8.0 | 10.9 |
(1)“酸浸”时,
 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加硫酸浓度 e.适当升高温度
(2)滤渣1的主要成分为
(3)“氧化”的目的是
 也可以用
也可以用 代替,若“氧化”过程中转移电子数相等,则消耗
代替,若“氧化”过程中转移电子数相等,则消耗 和
和 的物质的量之比为
的物质的量之比为(4)“一次调
 ”时,调节溶液的
”时,调节溶液的 ,目的是
,目的是 ”时的
”时的 范围为
范围为(5)“制备”水合硼酸锌的化学方程式为
(6)䂽酸的一种片层状结构如图所示。层内的硼酸分子通过氢键相连。
 硼酸晶体中含有
硼酸晶体中含有 氢键,硼酸晶体内所含有作用力类型除了氢键外,还有
氢键,硼酸晶体内所含有作用力类型除了氢键外,还有
您最近一年使用:0次
2024-02-23更新
|
108次组卷
|
2卷引用:河南省郑州市第五高级中学2023-2024学年高三2月开学考理综试题-高中化学
名校
解题方法
4 . 下列实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 向含有淀粉的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 | 比较 和 和 的氧化性强弱 的氧化性强弱 |
| B | 常温下,用 计测得浓度不同的 计测得浓度不同的 饱和溶液和 饱和溶液和 饱和溶液的 饱和溶液的 | 验证 和 和 的金属性 的金属性 |
| C | 将铁片分别插入 和 和 溶液中 溶液中 | 验证活动性: |
| D | 取一定量未知溶液于试管,滴入 溶液并加热,试管口放置湿润红色石蕊试纸,观察试纸颜色变化 溶液并加热,试管口放置湿润红色石蕊试纸,观察试纸颜色变化 | 检验未知溶液中是否含有铵盐 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-23更新
|
329次组卷
|
4卷引用:四川省绵阳中学2023-2024学年高三下学期2月开学考理科综合-高中化学
名校
解题方法
5 . 硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂、木材和皮革的保存剂。现从工业废渣中(主要成分ZnS,含有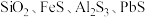 等杂质)制取
等杂质)制取 流程如图所示;
流程如图所示;
(1)“酸浸”时为了提高浸出效率可采取的措施有___________ 。
(2)“滤渣1”的主要成分是___________ 。
(3)“氧化”中发生反应的离子方程式是___________ 。
(4)加入氨水“调节 ”的作用是
”的作用是___________ ,调节过程中加热有利于反应但温度不宜过高,原理是___________ 。
(5)“一系列操作”中包括___________ ,冷却结晶、___________ 、洗涤、干燥。
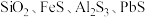 等杂质)制取
等杂质)制取 流程如图所示;
流程如图所示;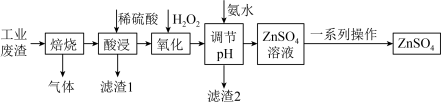
(1)“酸浸”时为了提高浸出效率可采取的措施有
(2)“滤渣1”的主要成分是
(3)“氧化”中发生反应的离子方程式是
(4)加入氨水“调节
 ”的作用是
”的作用是(5)“一系列操作”中包括
您最近一年使用:0次
6 . 钛(T)被称为“未来金属”,钛合金广泛应用于多个领域。
(1)工业上由钛铁矿(主要成分为 )在高温下经氯化得到
)在高温下经氯化得到 ,再制取金属钛的流程如图
,再制取金属钛的流程如图

① 元素在元素周期表的位置是
元素在元素周期表的位置是_______ 。
②基态 原子的简化电子排布式是
原子的简化电子排布式是_______ 。
③补全反应器中发生反应的化学方程式:_______ 。

④由合成器得到的粗产品是 、
、 、
、 的混合物,可采用真空蒸馏的方法分离得到
的混合物,可采用真空蒸馏的方法分离得到 。依据下表信息,加热的温度略高于
。依据下表信息,加热的温度略高于_______  即可。
即可。
(2)超高硬度生物材料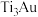 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 、
、 两种结构,如下图所示。
两种结构,如下图所示。

① 晶胞中,
晶胞中, 原子周围与它最近且距离相等的
原子周围与它最近且距离相等的 原子有
原子有_______ 个。
② 的晶胞边长为
的晶胞边长为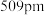 ,每个晶胞面上有两个
,每个晶胞面上有两个 原子。
原子。 晶体的密度是
晶体的密度是_______  (列出计算式)。(已知:阿伏加德罗常数为
(列出计算式)。(已知:阿伏加德罗常数为 ,
,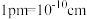 )
)
③与 晶体相比,
晶体相比, 晶体有更长的
晶体有更长的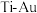 键键长。上述两种晶体中硬度较高的是
键键长。上述两种晶体中硬度较高的是_______ (填“ ”或“
”或“ ”)。
”)。
(1)工业上由钛铁矿(主要成分为
 )在高温下经氯化得到
)在高温下经氯化得到 ,再制取金属钛的流程如图
,再制取金属钛的流程如图
①
 元素在元素周期表的位置是
元素在元素周期表的位置是②基态
 原子的简化电子排布式是
原子的简化电子排布式是③补全反应器中发生反应的化学方程式:

④由合成器得到的粗产品是
 、
、 、
、 的混合物,可采用真空蒸馏的方法分离得到
的混合物,可采用真空蒸馏的方法分离得到 。依据下表信息,加热的温度略高于
。依据下表信息,加热的温度略高于 即可。
即可。 |  |  |  | |
熔点/ |  | 648.8 | 714 | 1667 |
沸点/ | 136.4 | 1090 | 1412 | 3287 |
(2)超高硬度生物材料
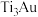 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 、
、 两种结构,如下图所示。
两种结构,如下图所示。
①
 晶胞中,
晶胞中, 原子周围与它最近且距离相等的
原子周围与它最近且距离相等的 原子有
原子有②
 的晶胞边长为
的晶胞边长为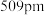 ,每个晶胞面上有两个
,每个晶胞面上有两个 原子。
原子。 晶体的密度是
晶体的密度是 (列出计算式)。(已知:阿伏加德罗常数为
(列出计算式)。(已知:阿伏加德罗常数为 ,
,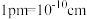 )
)③与
 晶体相比,
晶体相比, 晶体有更长的
晶体有更长的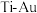 键键长。上述两种晶体中硬度较高的是
键键长。上述两种晶体中硬度较高的是 ”或“
”或“ ”)。
”)。
您最近一年使用:0次
名校
解题方法
7 . 在无水无氧条件下制备新型锂离子电池电解质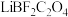 ,其过程可表示为:
,其过程可表示为:
(1)草酸的结构简式为 ,
,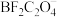 具有五元环结构,
具有五元环结构, 原子的轨道杂化类型是
原子的轨道杂化类型是 ,其结构式可表示为
,其结构式可表示为___________ 。
(2)实验室可以在 用浓硝酸在硝酸汞催化下氧化乙炔(
用浓硝酸在硝酸汞催化下氧化乙炔( )气体来制备草酸,主要装置如图所示。
)气体来制备草酸,主要装置如图所示。
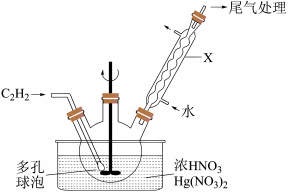
①仪器 的名称为
的名称为___________ ;
②用电石制得的 含有
含有 杂质,通过计算平衡常数说明用
杂质,通过计算平衡常数说明用 溶液除去
溶液除去 气体的可行性
气体的可行性___________ ;(常温下, ,
, 的
的 ,
,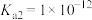 )
)
③装置中浓硝酸的还原产物为 ,生成草酸的化学方程式为
,生成草酸的化学方程式为___________ ,当硝酸的质量分数超过 或温度高于
或温度高于 ,草酸的产率开始下降,其原因分别是
,草酸的产率开始下降,其原因分别是___________ 。
(3) 遇水剧烈水解。
遇水剧烈水解。 和
和 混合加热制取无水
混合加热制取无水 时,
时, 的作用是
的作用是___________ 。
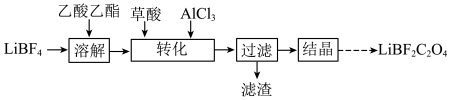
(4)“溶解”和“转化”操作在如图所示装置中进行。“溶解”时的操作依次为:称取一定质量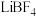 置于三颈瓶中→
置于三颈瓶中→___________ →搅拌直至完全溶解(填字母)。
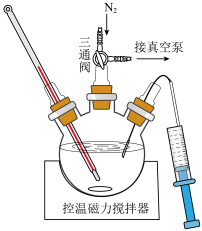
a.注入乙酸乙酯→充入→抽真空
b.抽真空→注入乙酸乙酯→充入
c.抽真空→充入 →注入乙酸乙酯
→注入乙酸乙酯
(5)产品(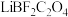 )纯度的测定
)纯度的测定
步骤1:称取 样品(假设只含
样品(假设只含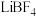 杂质)配制成
杂质)配制成 溶液。(
溶液。(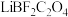 在水中可分解出草酸根,
在水中可分解出草酸根,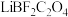 相对分子质量为144)
相对分子质量为144)
步骤2:量取 所配制的溶液于锥形瓶中,用
所配制的溶液于锥形瓶中,用 酸性
酸性 溶液滴定三次,平均消耗体积为
溶液滴定三次,平均消耗体积为 。产品(
。产品(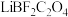 )的质量分数为
)的质量分数为___________ (列式即可,不用化简)。
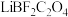 ,其过程可表示为:
,其过程可表示为:
(1)草酸的结构简式为
 ,
,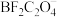 具有五元环结构,
具有五元环结构, 原子的轨道杂化类型是
原子的轨道杂化类型是 ,其结构式可表示为
,其结构式可表示为(2)实验室可以在
 用浓硝酸在硝酸汞催化下氧化乙炔(
用浓硝酸在硝酸汞催化下氧化乙炔( )气体来制备草酸,主要装置如图所示。
)气体来制备草酸,主要装置如图所示。
①仪器
 的名称为
的名称为②用电石制得的
 含有
含有 杂质,通过计算平衡常数说明用
杂质,通过计算平衡常数说明用 溶液除去
溶液除去 气体的可行性
气体的可行性 ,
, 的
的 ,
,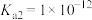 )
)③装置中浓硝酸的还原产物为
 ,生成草酸的化学方程式为
,生成草酸的化学方程式为 或温度高于
或温度高于 ,草酸的产率开始下降,其原因分别是
,草酸的产率开始下降,其原因分别是(3)
 遇水剧烈水解。
遇水剧烈水解。 和
和 混合加热制取无水
混合加热制取无水 时,
时, 的作用是
的作用是(4)“溶解”和“转化”操作在如图所示装置中进行。“溶解”时的操作依次为:称取一定质量
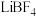 置于三颈瓶中→
置于三颈瓶中→
a.注入乙酸乙酯→充入→抽真空
b.抽真空→注入乙酸乙酯→充入

c.抽真空→充入
 →注入乙酸乙酯
→注入乙酸乙酯(5)产品(
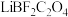 )纯度的测定
)纯度的测定步骤1:称取
 样品(假设只含
样品(假设只含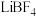 杂质)配制成
杂质)配制成 溶液。(
溶液。(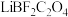 在水中可分解出草酸根,
在水中可分解出草酸根,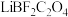 相对分子质量为144)
相对分子质量为144)步骤2:量取
 所配制的溶液于锥形瓶中,用
所配制的溶液于锥形瓶中,用 酸性
酸性 溶液滴定三次,平均消耗体积为
溶液滴定三次,平均消耗体积为 。产品(
。产品(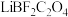 )的质量分数为
)的质量分数为
您最近一年使用:0次
名校
解题方法
8 . 某粗铜精炼得到的阳极泥主要成分为 、
、 、
、 ,从中提取
,从中提取 的工艺流程如图:
的工艺流程如图: ;
; 为弱酸。
为弱酸。
下列说法正确的是
 、
、 、
、 ,从中提取
,从中提取 的工艺流程如图:
的工艺流程如图:
 ;
; 为弱酸。
为弱酸。下列说法正确的是
A. 、 、 、 、 氧化性由强到弱的顺序为 氧化性由强到弱的顺序为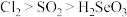 |
B.“氯化”过程中 转化为 转化为 ,反应的离子方程式为 ,反应的离子方程式为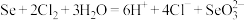 |
C. 转化为 转化为 的原因是 的原因是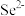 被 被 氧化为 氧化为 ,导致 ,导致 增大 增大 |
D.粗铜精炼时,若以恒定电流强度I安培持续电解t秒,电解效率为 ,当阴极增重m克时,则 ,当阴极增重m克时,则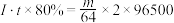 |
您最近一年使用:0次
2024-02-04更新
|
183次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三下学期开学化学试题
名校
9 . 某兴趣小组用铬铁矿( ,含
,含 等杂质)为主要原料制备重铬酸钾
等杂质)为主要原料制备重铬酸钾 晶体,流程如下:
晶体,流程如下:

已知: 中
中 元素为
元素为 价;
价; 与
与 高温生成可溶于水的
高温生成可溶于水的 ;
; 酸性条件下能转化为
酸性条件下能转化为 。
。
回答下列问题:
(1)“焙烧”时,除生成 和
和 外,还生成一种无色无味的气体,该反应的化学方程式为
外,还生成一种无色无味的气体,该反应的化学方程式为___________ 。
(2)实验室进行“操作1”用到的玻璃仪器有:烧杯、___________ 。
(3)“晶体X”的化学式为___________ 。
(4)交警查酒驾所用检测仪器的工作原理为:
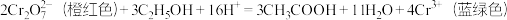
该反应中,还原剂为___________ ;反应消耗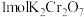 时,转移电子的物质的量为
时,转移电子的物质的量为___________  。
。
(5)“结晶”时,为得到杂质较少的 粗产品,请结合下图从下列选项中选出合理的操作并排序
粗产品,请结合下图从下列选项中选出合理的操作并排序___________ (填字母)。
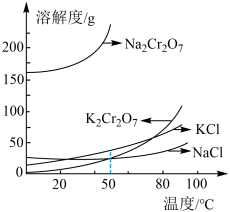
a. 蒸发溶剂 b.
蒸发溶剂 b. 蒸发溶剂 c.过滤 d.冷却至室温
蒸发溶剂 c.过滤 d.冷却至室温
e.蒸发至溶液出现晶膜,停止加热
 ,含
,含 等杂质)为主要原料制备重铬酸钾
等杂质)为主要原料制备重铬酸钾 晶体,流程如下:
晶体,流程如下:
已知:
 中
中 元素为
元素为 价;
价; 与
与 高温生成可溶于水的
高温生成可溶于水的 ;
; 酸性条件下能转化为
酸性条件下能转化为 。
。回答下列问题:
(1)“焙烧”时,除生成
 和
和 外,还生成一种无色无味的气体,该反应的化学方程式为
外,还生成一种无色无味的气体,该反应的化学方程式为(2)实验室进行“操作1”用到的玻璃仪器有:烧杯、
(3)“晶体X”的化学式为
(4)交警查酒驾所用检测仪器的工作原理为:
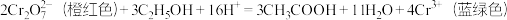
该反应中,还原剂为
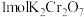 时,转移电子的物质的量为
时,转移电子的物质的量为 。
。(5)“结晶”时,为得到杂质较少的
 粗产品,请结合下图从下列选项中选出合理的操作并排序
粗产品,请结合下图从下列选项中选出合理的操作并排序
a.
 蒸发溶剂 b.
蒸发溶剂 b. 蒸发溶剂 c.过滤 d.冷却至室温
蒸发溶剂 c.过滤 d.冷却至室温e.蒸发至溶液出现晶膜,停止加热
您最近一年使用:0次
2024-02-02更新
|
165次组卷
|
2卷引用:湖南省衡阳市第八中学2023-2024学年高一下学期开学考试化学试题
解题方法
10 . 硝酸铈(Ⅳ)铵的化学式为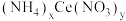 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。___________ ,装置C的作用是___________ 。该实验以氮化钙和水制备NH3应选择装置___________ (填“A”或“D”)。
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为___________ 。装置B中发生反应的离子方程式为___________ 。
(3)该实验装置存在的一处缺陷为___________ 。
步骤二:制备硝酸铈(Ⅳ)铵___________ 。
(5)“烘干”采取自然干燥的原因为___________ 。
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用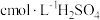 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
(6)计算y=___________ (用上述字母表示)。
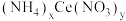 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。
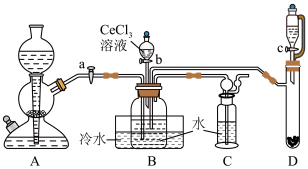
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为
(3)该实验装置存在的一处缺陷为
步骤二:制备硝酸铈(Ⅳ)铵

(5)“烘干”采取自然干燥的原因为
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用
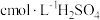 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。(6)计算y=
您最近一年使用:0次
2024-02-02更新
|
262次组卷
|
3卷引用:山东省临沂市郯城县美澳学校2023-2024学年高三下学期开学考试化学试题



