名校
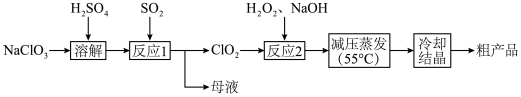
1 . 亚氯酸钠( )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L 溶液,现进行溶液配制。
溶液,现进行溶液配制。
①实验室购买的浓硫酸标签如图所示。配制所需的 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有___________ ,需要量取的浓硫酸的体积是___________ mL。
②在容量瓶的使用方法中,下列操作正确的是___________ 。
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中
③配制过程中下列各项操作可能导致浓度偏小的有___________ (填写字母)。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是___________ 。
(3)“反应2”中加入的 的电子式是
的电子式是___________ ,发生反应的离子方程式是___________ 。
 )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L
 溶液,现进行溶液配制。
溶液,现进行溶液配制。①实验室购买的浓硫酸标签如图所示。配制所需的
 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有| 硫酸化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的
 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中③配制过程中下列各项操作可能导致浓度偏小的有
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是
(3)“反应2”中加入的
 的电子式是
的电子式是
您最近一年使用:0次
名校
2 .  是环境污染物。
是环境污染物。
(1)消除 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为_______ 。
(2)以氨气为原料脱硝除去 。
。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知: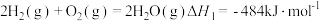
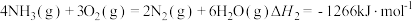
则 的
的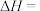
_______  。
。
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为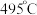 时,
时,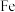 的温度为
的温度为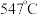 ,而
,而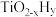 的温度为
的温度为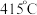 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是_______ 。 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性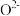 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。_______ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为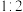 ,则反应的化学方程式为
,则反应的化学方程式为_______ 。
(4)以 为原料脱硝除去
为原料脱硝除去 。
。
烟气中的 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中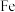 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的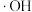 (羟基自由基),
(羟基自由基),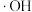 能将
能将 快速氧化为
快速氧化为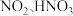 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示:_______ 。
②化学式为 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
 是环境污染物。
是环境污染物。(1)消除
 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为(2)以氨气为原料脱硝除去
 。
。①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
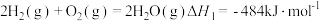
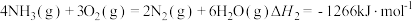
则
 的
的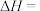
 。
。②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为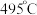 时,
时,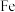 的温度为
的温度为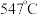 ,而
,而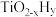 的温度为
的温度为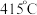 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是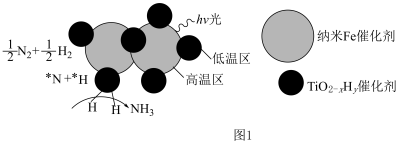
 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性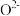 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。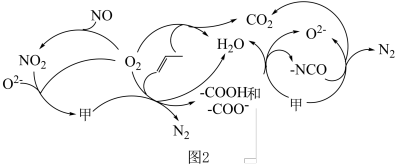
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为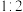 ,则反应的化学方程式为
,则反应的化学方程式为(4)以
 为原料脱硝除去
为原料脱硝除去 。
。烟气中的
 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中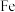 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的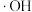 (羟基自由基),
(羟基自由基),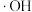 能将
能将 快速氧化为
快速氧化为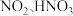 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示: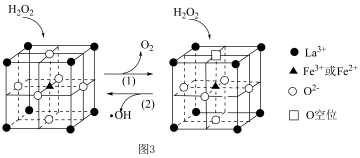
②化学式为
 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
3 . 电解锰渣主要含 、
、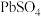 、
、 、
、 。利用电解锰回收铅的工艺如图所示[已知:
。利用电解锰回收铅的工艺如图所示[已知: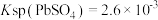 ]:
]:
①“还原酸浸”时, 氧化
氧化 生成
生成 的离子方程式为
的离子方程式为_______ 。
②“浸出液”含有的盐类主要有 和
和_______ (填化学式)。
③从平衡移动的角度分析“浸铅”反应发生的原因:_______ 。
(2)利用 可制备
可制备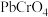 。以
。以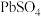 、
、 和
和 为原料,通过混合后进行沉淀转化可制得
为原料,通过混合后进行沉淀转化可制得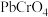 。已知:
。已知: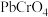 的产率随
的产率随 的变化如图1所示。
的变化如图1所示。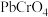 时,控制
时,控制 约为8的原因是
约为8的原因是_______ 。
②设计如图装置(均为惰性电极)电解 溶液制取
溶液制取 。图中右侧电极产生的气体为
。图中右侧电极产生的气体为_______ 。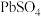 可制得
可制得 。
。 受热分解为
受热分解为 的
的 和
和 价的混合氧化物,
价的混合氧化物, 价的
价的 能氧化浓盐酸生成
能氧化浓盐酸生成 。现将
。现将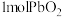 加热分解得到
加热分解得到 ,向“剩余固体”中加入足量的浓盐酸得到
,向“剩余固体”中加入足量的浓盐酸得到 。生成的
。生成的 和
和 的物质的量相等。计算“剩余固体”中
的物质的量相等。计算“剩余固体”中 原子个数比。(写出计算过程)
原子个数比。(写出计算过程)_______ 。
 、
、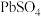 、
、 、
、 。利用电解锰回收铅的工艺如图所示[已知:
。利用电解锰回收铅的工艺如图所示[已知: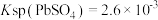 ]:
]:
①“还原酸浸”时,
 氧化
氧化 生成
生成 的离子方程式为
的离子方程式为②“浸出液”含有的盐类主要有
 和
和③从平衡移动的角度分析“浸铅”反应发生的原因:
(2)利用
 可制备
可制备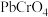 。以
。以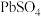 、
、 和
和 为原料,通过混合后进行沉淀转化可制得
为原料,通过混合后进行沉淀转化可制得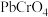 。已知:
。已知: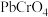 的产率随
的产率随 的变化如图1所示。
的变化如图1所示。
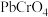 时,控制
时,控制 约为8的原因是
约为8的原因是②设计如图装置(均为惰性电极)电解
 溶液制取
溶液制取 。图中右侧电极产生的气体为
。图中右侧电极产生的气体为
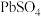 可制得
可制得 。
。 受热分解为
受热分解为 的
的 和
和 价的混合氧化物,
价的混合氧化物, 价的
价的 能氧化浓盐酸生成
能氧化浓盐酸生成 。现将
。现将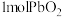 加热分解得到
加热分解得到 ,向“剩余固体”中加入足量的浓盐酸得到
,向“剩余固体”中加入足量的浓盐酸得到 。生成的
。生成的 和
和 的物质的量相等。计算“剩余固体”中
的物质的量相等。计算“剩余固体”中 原子个数比。(写出计算过程)
原子个数比。(写出计算过程)
您最近一年使用:0次
2024-03-02更新
|
417次组卷
|
2卷引用:江苏省海安高级中学2023-2024学年高三下学期开学考试化学试题
名校
解题方法
4 . 构建知识网络是一种有效的学习方法,化学学习中的“价-类”二维图就是其中一种,如图所示是铁及其化合物的“价-类”二维图,请回答下列问题:_____ 。
(2)下列各图示中能较长时间观察到 的是
的是_____ 。_____ ,当生成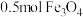 时,转移电子数为
时,转移电子数为_____ 。
(4)将 溶于盐酸后再加入1滴
溶于盐酸后再加入1滴 溶液,则溶液变红时发生反应的离子方程式为
溶液,则溶液变红时发生反应的离子方程式为_____ 。
(5)绿矾 是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后
是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后_____ 可获得绿矾晶体,如何检验绿矾是否完全变质_____ 。
(6)将硫酸亚铁固体隔绝空气煅烧,可发生以下反应,请将方程式配平:_____ 。
_____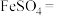 _____
_____ _____
_____ _____
_____

(2)下列各图示中能较长时间观察到
 的是
的是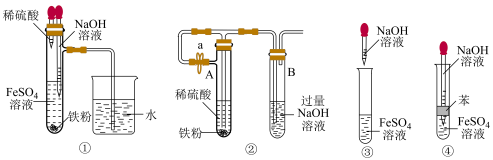
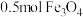 时,转移电子数为
时,转移电子数为(4)将
 溶于盐酸后再加入1滴
溶于盐酸后再加入1滴 溶液,则溶液变红时发生反应的离子方程式为
溶液,则溶液变红时发生反应的离子方程式为(5)绿矾
 是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后
是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后(6)将硫酸亚铁固体隔绝空气煅烧,可发生以下反应,请将方程式配平:
_____
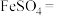 _____
_____ _____
_____ _____
_____
您最近一年使用:0次
名校
解题方法
5 . 从钒铬锰矿渣(主要成分为 、
、 、MnO)中提取铬的一种工艺流程如图所示:
、MnO)中提取铬的一种工艺流程如图所示:
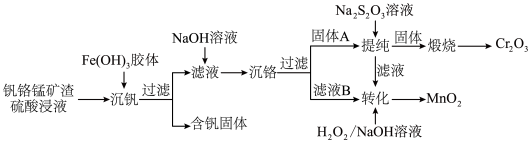
已知:①pH较大时,二价锰[Mn(Ⅱ)]在空气中易被氧化;
②“沉钒”过程控制 ,钒主要以
,钒主要以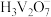 形式与胶体共沉降。
形式与胶体共沉降。
回答下列问题:
(1)硫酸酸浸时,常将钒铬锰矿渣粉碎的目的是___________ 。
(2)制备 胶体:先将
胶体:先将 固体溶解到浓盐酸中,然后加入一定量的水稀释至所需的浓度,其目的是
固体溶解到浓盐酸中,然后加入一定量的水稀释至所需的浓度,其目的是___________ (用离子方程式表示,并用简要文字说明),再用所得 溶液制备
溶液制备 胶体。
胶体。
(3)过滤时用到的主要玻璃仪器有烧杯、___________ 和___________ 。
(4)常温下,“沉铬”过程中为了获得更多的 ,该过程中的pH控制在6.0,若在该条件下,滤液B中
,该过程中的pH控制在6.0,若在该条件下,滤液B中 mol⋅L-1,则
mol⋅L-1,则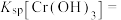
___________ (用含a的代数式表示)。
(5)“提纯”过程中:
① 中存在的化学键有
中存在的化学键有___________ (填“离子键”“共价键”或“离子键和共价键”)。
② 在水中的电离方程式为
在水中的电离方程式为___________ 。
(6)“转化”过程中,二价锰转化为 反应的离子方程式为
反应的离子方程式为___________ ,该反应中每生成0.1 mol  ,此时消耗
,此时消耗 的物质的量为
的物质的量为___________ mol。
 、
、 、MnO)中提取铬的一种工艺流程如图所示:
、MnO)中提取铬的一种工艺流程如图所示:
已知:①pH较大时,二价锰[Mn(Ⅱ)]在空气中易被氧化;
②“沉钒”过程控制
 ,钒主要以
,钒主要以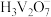 形式与胶体共沉降。
形式与胶体共沉降。回答下列问题:
(1)硫酸酸浸时,常将钒铬锰矿渣粉碎的目的是
(2)制备
 胶体:先将
胶体:先将 固体溶解到浓盐酸中,然后加入一定量的水稀释至所需的浓度,其目的是
固体溶解到浓盐酸中,然后加入一定量的水稀释至所需的浓度,其目的是 溶液制备
溶液制备 胶体。
胶体。(3)过滤时用到的主要玻璃仪器有烧杯、
(4)常温下,“沉铬”过程中为了获得更多的
 ,该过程中的pH控制在6.0,若在该条件下,滤液B中
,该过程中的pH控制在6.0,若在该条件下,滤液B中 mol⋅L-1,则
mol⋅L-1,则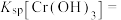
(5)“提纯”过程中:
①
 中存在的化学键有
中存在的化学键有②
 在水中的电离方程式为
在水中的电离方程式为(6)“转化”过程中,二价锰转化为
 反应的离子方程式为
反应的离子方程式为 ,此时消耗
,此时消耗 的物质的量为
的物质的量为
您最近一年使用:0次
2024-03-01更新
|
57次组卷
|
2卷引用:河北省定州市第二中学2023-2024学年高二下学期开学化学试题
名校
解题方法
6 . 金属镓在工业和医学中有广泛应用。一种利用锌粉置换渣(主要成分为 、
、 、
、 、
、 、
、 、
、 )制备粗镓的工艺流程如图所示:
)制备粗镓的工艺流程如图所示:
回答下列问题。
(1)浸渣的主要成分是___________ ,“富氧浸出”中高压 的作用是
的作用是___________ 。
(2)用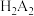 代表P204,RH代表YW100,“协同萃取”过程中发生反应:
代表P204,RH代表YW100,“协同萃取”过程中发生反应: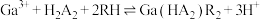 ,“协同萃取”后无机相含有的主要金属离子为
,“协同萃取”后无机相含有的主要金属离子为___________ ,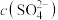 随
随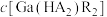 变化关系如图所示,“反萃取”加入稀硫酸的目的是
变化关系如图所示,“反萃取”加入稀硫酸的目的是___________ (用化学方程式表示)。 系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~
系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~___________ (填正整数),“碱溶造液”过程中发生反应的离子方程式为___________ 。___________ 。
(5)填隙方钴矿锑化物是一类新型热电材料,钴形成的六面体空隙中分别填充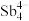 和As,该化合物的化学式为
和As,该化合物的化学式为___________ ;设阿伏加德罗常数的值为 ,已知该晶胞参数为a nm,则该晶体的密度是
,已知该晶胞参数为a nm,则该晶体的密度是___________  。
。
 、
、 、
、 、
、 、
、 、
、 )制备粗镓的工艺流程如图所示:
)制备粗镓的工艺流程如图所示:
回答下列问题。
(1)浸渣的主要成分是
 的作用是
的作用是(2)用
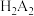 代表P204,RH代表YW100,“协同萃取”过程中发生反应:
代表P204,RH代表YW100,“协同萃取”过程中发生反应: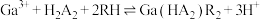 ,“协同萃取”后无机相含有的主要金属离子为
,“协同萃取”后无机相含有的主要金属离子为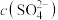 随
随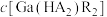 变化关系如图所示,“反萃取”加入稀硫酸的目的是
变化关系如图所示,“反萃取”加入稀硫酸的目的是
 系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~
系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~
(5)填隙方钴矿锑化物是一类新型热电材料,钴形成的六面体空隙中分别填充
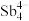 和As,该化合物的化学式为
和As,该化合物的化学式为 ,已知该晶胞参数为a nm,则该晶体的密度是
,已知该晶胞参数为a nm,则该晶体的密度是 。
。
您最近一年使用:0次
2024-03-01更新
|
498次组卷
|
4卷引用:甘肃省平凉市静宁县第一中学2023-2024学年高三下学期开学化学试题
甘肃省平凉市静宁县第一中学2023-2024学年高三下学期开学化学试题甘肃省张掖市某重点校2023-2024学年高三下学期开年摸底联考化学试题2024届河北省百师联盟高三下学期开学摸底联考化学试题(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
7 . 二氯化二硫 常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。
常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。 沸点为
沸点为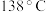 ,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成
,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成 。实验室用S和
。实验室用S和 制备
制备 的装置如图(部分夹持装置已略去)。
的装置如图(部分夹持装置已略去)。
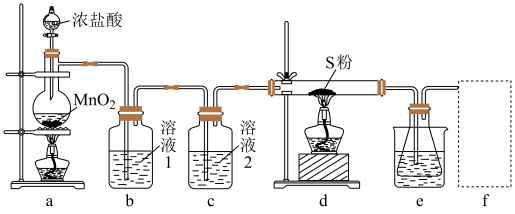
回答下列问题:
(1)装置b用于吸收 ,则溶液1为
,则溶液1为_______ ;溶液2的作用为_______ 。
(2)实验开始时,先点燃a处酒精灯,圆底烧瓶中发生反应的化学方程式为_______ ,当_______ (描述现象)时,点燃d处酒精灯。
(3)e中大烧杯装有冰水,作用是_______ ;f可以选用_______ (填标号)装置。
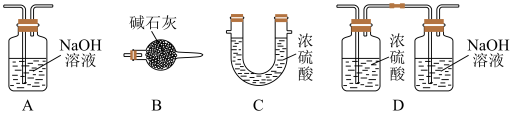
(4) (
( 中S为
中S为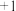 价)遇水会生成
价)遇水会生成 、一种强酸和一种淡黄色固体单质,该反应的化学方程式为
、一种强酸和一种淡黄色固体单质,该反应的化学方程式为_______ ,反应中每转移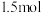 电子,生成的
电子,生成的 在标准状况下的体积为
在标准状况下的体积为_______ 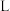 。
。
 常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。
常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。 沸点为
沸点为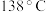 ,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成
,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成 。实验室用S和
。实验室用S和 制备
制备 的装置如图(部分夹持装置已略去)。
的装置如图(部分夹持装置已略去)。
回答下列问题:
(1)装置b用于吸收
 ,则溶液1为
,则溶液1为(2)实验开始时,先点燃a处酒精灯,圆底烧瓶中发生反应的化学方程式为
(3)e中大烧杯装有冰水,作用是

(4)
 (
( 中S为
中S为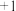 价)遇水会生成
价)遇水会生成 、一种强酸和一种淡黄色固体单质,该反应的化学方程式为
、一种强酸和一种淡黄色固体单质,该反应的化学方程式为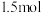 电子,生成的
电子,生成的 在标准状况下的体积为
在标准状况下的体积为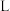 。
。
您最近一年使用:0次
2024-03-01更新
|
150次组卷
|
2卷引用:河南省优质高中2023-2024学年高一下学期二月联考化学试题
8 . 二水合草酸钴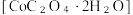 常用于制指示剂、催化剂及有机合成中间体。某同学在实验室按如下步骤制备二水合草酸钴:
常用于制指示剂、催化剂及有机合成中间体。某同学在实验室按如下步骤制备二水合草酸钴:
在一定温度下,将(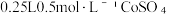 溶液加入
溶液加入 的
的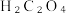 溶液中,保温、搅拌反应0.5h后,静置3h,过滤,固体用冷的蒸馏水洗涤数次。
溶液中,保温、搅拌反应0.5h后,静置3h,过滤,固体用冷的蒸馏水洗涤数次。
已知:H2C2O4为二元弱酸。
请回答下列问题:
(1)用草酸晶体( 配制
配制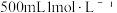 草酸溶液。
草酸溶液。
①需要使用到的玻璃仪器有量筒、玻璃棒、烧杯、_______ ,其中玻璃棒的作用为搅拌和_______ 。
②用托盘天平称取_______ g草酸晶体,下列情况会使配制的溶液浓度偏大的是_______ (填标号)。
a.砝码生锈 b.草酸晶体失去部分结晶水
c.定容时仰视刻度线 d.称量时砝码与药品位置放反了
(2)CoSO4溶液加入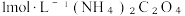 溶液中发生反应生成二水合草酸钴的化学方程式为
溶液中发生反应生成二水合草酸钴的化学方程式为_______ 。
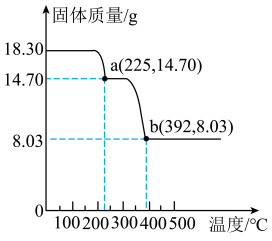
(3)二水合草酸钴受热易分解,在不同的温度下分解产物不同。18.30g二水合草酸钴在空气中的热重曲线如图所示。已知二水合草酸钴在温度较低时易失去结晶水,在温度较高时易分解生成氧化物。250℃时,固体物质为_______ (填化学式);500℃时在空气中灼烧二水合草酸钴使其分解的化学方程式为_______ (提示:500℃时,钴的氧化物可能为CoO、Co2O3或(Co3O4中的一种)。
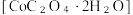 常用于制指示剂、催化剂及有机合成中间体。某同学在实验室按如下步骤制备二水合草酸钴:
常用于制指示剂、催化剂及有机合成中间体。某同学在实验室按如下步骤制备二水合草酸钴:在一定温度下,将(
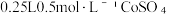 溶液加入
溶液加入 的
的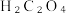 溶液中,保温、搅拌反应0.5h后,静置3h,过滤,固体用冷的蒸馏水洗涤数次。
溶液中,保温、搅拌反应0.5h后,静置3h,过滤,固体用冷的蒸馏水洗涤数次。已知:H2C2O4为二元弱酸。
请回答下列问题:
(1)用草酸晶体(
 配制
配制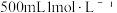 草酸溶液。
草酸溶液。①需要使用到的玻璃仪器有量筒、玻璃棒、烧杯、
②用托盘天平称取
a.砝码生锈 b.草酸晶体失去部分结晶水
c.定容时仰视刻度线 d.称量时砝码与药品位置放反了
(2)CoSO4溶液加入
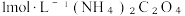 溶液中发生反应生成二水合草酸钴的化学方程式为
溶液中发生反应生成二水合草酸钴的化学方程式为(3)二水合草酸钴受热易分解,在不同的温度下分解产物不同。18.30g二水合草酸钴在空气中的热重曲线如图所示。已知二水合草酸钴在温度较低时易失去结晶水,在温度较高时易分解生成氧化物。250℃时,固体物质为
您最近一年使用:0次
2024-03-01更新
|
60次组卷
|
2卷引用:河南省优质高中2023-2024学年高一下学期二月联考化学试题
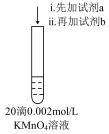
9 . 小组同学探究金属钠与KMnO4溶液的反应。
①向KMnO4溶液中投入一小块金属钠,溶液颜色略有变浅;继续依次投入五小块金属钠,溶液变为绿色,产生气体
②向KMnO4溶液中加入少量NaOH固体,溶液颜色无明显变化;继续加入NaOH固体,溶液变为绿色,产生气体
已知:Mn2+无色,MnO 绿色。
绿色。
对比①②,下列有关说法不正确的是
①向KMnO4溶液中投入一小块金属钠,溶液颜色略有变浅;继续依次投入五小块金属钠,溶液变为绿色,产生气体
②向KMnO4溶液中加入少量NaOH固体,溶液颜色无明显变化;继续加入NaOH固体,溶液变为绿色,产生气体
已知:Mn2+无色,MnO
 绿色。
绿色。对比①②,下列有关说法不正确的是
| A.①中溶液颜色变浅,说明KMnO4发生还原反应 |
B.①中溶液变为绿色,说明MnO 被钠还原为MnO 被钠还原为MnO |
C.②中溶液变为绿色,可能发生4MnO +4OH-=4MnO +4OH-=4MnO +O2↑+2H2O +O2↑+2H2O |
| D.②中溶液颜色变化表明,溶液pH会影响物质氧化性或还原性的强弱 |
您最近一年使用:0次
2024-03-01更新
|
107次组卷
|
3卷引用:北京九中2023-2024学年高一下学期开学测试化学试题
名校
解题方法
10 . 实验小组探究溶液酸碱性对锰化合物和 ,氧化还原反应的影响。
,氧化还原反应的影响。
资料:i. 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。
ii. 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。
iii. 为微溶物。
为微溶物。
(1)用离子方程式解释实验I中出现乳白色浑浊的原因________________________ 。
(2)已知,实验I、II、III中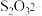 均被氧化为
均被氧化为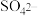 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:
①对于 氧化性的认识是
氧化性的认识是____________ 。
②实验Ⅱ所得溶液中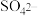 的检验方法为
的检验方法为________________________ 。
(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为____________ 。
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:____________ (写出2点)。
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
②实验VI:向实验IV的试管中继续滴加足量 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
对比实验V、VI,结合方程式分析实验VI滴加 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因____________ 。
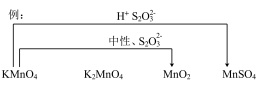
(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系_____________ 。
 ,氧化还原反应的影响。
,氧化还原反应的影响。资料:i.
 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。ii.
 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。iii.
 为微溶物。
为微溶物。实验 | 序号 | 试剂 | 现象 |
| I | a:10滴 溶液 溶液b:20滴 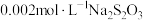 溶液 溶液 | 溶液紫色变浅至接近无色,静置一段时间后出现乳白色浑浊 |
II | a:10滴蒸馏水 b:20滴 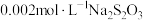 溶液 溶液 | 紫色溶液逐渐褪色,产生棕黑色沉淀 | |
III | a:10滴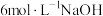 溶液 溶液b:2滴 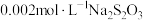 溶液和18滴蒸馏水 溶液和18滴蒸馏水 | 溶液变为绿色,无沉淀生成;静置5min,未见明显变化 | |
IV | a:10滴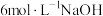 溶液 溶液b:20滴 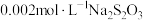 溶液 溶液 | 溶液变为绿色,无沉淀生成;静置5min,绿色变浅,有棕黑色沉淀生成 |
(1)用离子方程式解释实验I中出现乳白色浑浊的原因
(2)已知,实验I、II、III中
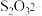 均被氧化为
均被氧化为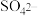 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:①对于
 氧化性的认识是
氧化性的认识是②实验Ⅱ所得溶液中
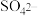 的检验方法为
的检验方法为(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量
 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。②实验VI:向实验IV的试管中继续滴加足量
 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。对比实验V、VI,结合方程式分析实验VI滴加
 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系
您最近一年使用:0次
2024-02-29更新
|
272次组卷
|
2卷引用:北京市第一七一中学2023-2024学年高三下学期开学考试化学试题