解题方法
1 . 一种从水钴矿(含 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
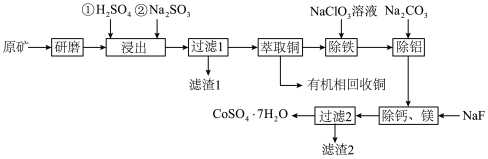
请回答下列问题:
(1)“研磨”的目的是___________ 。
(2)“浸出”时, 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
(3)滤渣1的成分是___________ 。
(4)“除铁”时, 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为___________ ;“除铝”时加入 的目的是
的目的是___________ 。
(5)已知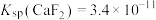 ,
,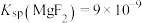 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中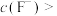
___________  。
。
(6)由“过滤2”后的母液得到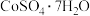 的操作是
的操作是___________ ,___________ 、过滤、洗涤、干燥。
 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是
(2)“浸出”时,
 被浸出的化学方程式为
被浸出的化学方程式为(3)滤渣1的成分是
(4)“除铁”时,
 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为 的目的是
的目的是(5)已知
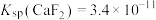 ,
,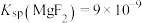 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中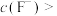
 。
。(6)由“过滤2”后的母液得到
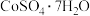 的操作是
的操作是
您最近一年使用:0次
解题方法
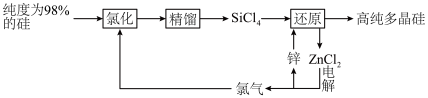
2 . 多晶硅的生产工艺方法主要是改良西门子法,该方法安全可靠,产品纯度高,但是生产成本较高.锌还原法成本低,但制备的多晶硅纯度不高,某研究所对锌还原法进行了研究改良,并成功制得了高纯多晶硅.改良后的锌还原法制备高纯多晶硅的主要流程如图,请回答下列问题: 和焦炭在
和焦炭在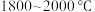 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为___________ ,该反应的氧化产物为___________ (填化学式).高纯硅常用作半导体材料,下列可用作半导体材料的是___________ (填标号).
A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成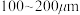 的粉末,这样做的目的是
的粉末,这样做的目的是___________ ;“精馏”可获得纯度为99.99%以上的高纯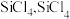 的电子式为
的电子式为___________ ;
(3)“还原”时的温度约为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;“电解”时,熔融 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于___________ (填“离子”或“共价”)化合物,“电解”反应中,每消耗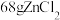 ,则生成
,则生成___________ L(换算成标准状况) 。
。
 和焦炭在
和焦炭在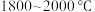 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成
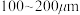 的粉末,这样做的目的是
的粉末,这样做的目的是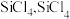 的电子式为
的电子式为(3)“还原”时的温度约为
 ,该反应的化学方程式为
,该反应的化学方程式为 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于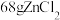 ,则生成
,则生成 。
。
您最近一年使用:0次
2024-04-04更新
|
39次组卷
|
2卷引用:广西桂林市恭城瑶族自治县民族高级中学2023-2024学年高一下学期开学考试化学试题
3 . 已知离子反应: (已配平),下列说法错误的是
(已配平),下列说法错误的是
A. 是 是 | B. 是还原产物 是还原产物 |
C.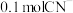 反应,转移的电子数目为 反应,转移的电子数目为 | D.该反应中 体现氧化性 体现氧化性 |
您最近一年使用:0次
名校
解题方法
4 . 葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过如下实验流程制得:
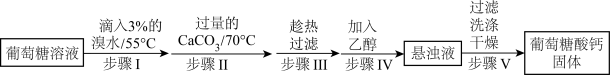
已知:a.反应原理: 。
。
b.相关物质的溶解性如下表:
c.相关物质的酸性:氢溴酸>葡萄糖酸>碳酸。
回答下列问题:
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是___________ ,恒压滴液漏斗使用时需要打开的活塞或玻璃塞是___________ (填“a”“b”或“a和b”)。烧杯中 溶液水浴的作用是
溶液水浴的作用是___________ 。
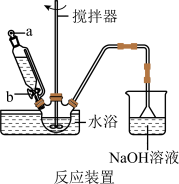
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
(3)步骤Ⅱ中加入过量的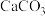 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为___________ 。加入过量的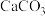 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是___________ 。
(4)洗涤操作中最合适的洗涤剂是___________ (填序号),理由是___________ 。
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:___________ (填序号,操作步骤不可重复使用)。
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出
④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液

已知:a.反应原理:
 。
。b.相关物质的溶解性如下表:
| 物质的名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 |
| 在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 极易溶 |
| 在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 |
回答下列问题:
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是
 溶液水浴的作用是
溶液水浴的作用是
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
A.新制 悬浊液 悬浊液 | B.酸性 溶液 溶液 |
C. /葡萄糖氧化酶 /葡萄糖氧化酶 | D. 溶液 溶液 |
(3)步骤Ⅱ中加入过量的
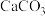 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为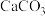 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是(4)洗涤操作中最合适的洗涤剂是
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入
 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入
 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
您最近一年使用:0次
名校
解题方法
5 . 含氯消毒剂在生产生活中被广泛用于杀菌、消毒和漂白。
(1)氯水具有漂白性,其中起漂白作用的物质是
(2)氯水需要避光保存,原因是
(3)通常将Cl2与NaOH或
 反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为
反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为(4)漂白粉[成分为
 、
、 和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:
和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:a.不宜用金属容器盛装
b.勿与酸性物质混用
c.水体中铵盐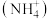 含量高,使用时产生NH3
含量高,使用时产生NH3
d.水体中亚硝酸盐(NO2)含量高,会降低其消毒效果
①注意事项a说明漂白粉具有
②为了验证注意事项b,向漂白粉中滴加稀硫酸,产生黄绿色气体,被还原的微粒是
③注意事项c中NH3产生的原因是
④从物质性质的角度解释注意事项d中漂白粉消毒效果降低的原因 浓度较高的鱼塘使用漂白粉,会使水中
浓度较高的鱼塘使用漂白粉,会使水中 含量升高,池水富营养化。)
含量升高,池水富营养化。)
您最近一年使用:0次
名校
6 . 硝酸是一种重要的化工原料,某工厂利用氨催化法制备硝酸的工艺流程如下。_____________ 。
(2)原料气在氧化炉中不同温度和催化剂条件下生成不同产物(如图所示)。900℃时发生的主要反应的化学方程式为_____________ 。_____________ 。
(4)工业制硝酸的尾气中含有NO、NO2,通常用NaOH溶液吸收,发生的反应有:
反应I: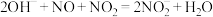
反应Ⅱ:
①反应I生成 时,转移电子的物质的量为
时,转移电子的物质的量为__________ mol。
②当尾气中NO2的含量小于50%时,向NaOH溶液中加入H2O2能提升氮氧化物的去除率,原因是_______________ 。
(5)上述工业流程中体现绿色化学理念的设计是______________ (写出1条)。
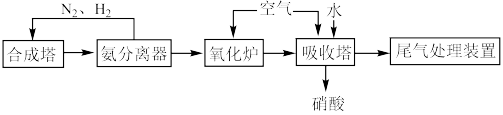
(2)原料气在氧化炉中不同温度和催化剂条件下生成不同产物(如图所示)。900℃时发生的主要反应的化学方程式为

(4)工业制硝酸的尾气中含有NO、NO2,通常用NaOH溶液吸收,发生的反应有:
反应I:
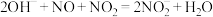
反应Ⅱ:

①反应I生成
 时,转移电子的物质的量为
时,转移电子的物质的量为②当尾气中NO2的含量小于50%时,向NaOH溶液中加入H2O2能提升氮氧化物的去除率,原因是
(5)上述工业流程中体现绿色化学理念的设计是
您最近一年使用:0次
2024-03-24更新
|
145次组卷
|
3卷引用:北京市中关村中学2023-2024学年高一下学期开学考化学试题
名校
解题方法
7 . 某化学活动小组利用如下装置制备氯气并进行相关的性质验证。
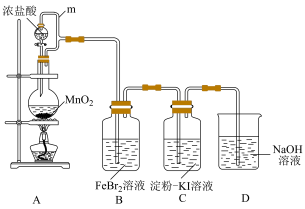
已知:
① 易溶于有机溶剂四氯化碳(
易溶于有机溶剂四氯化碳( ),且所得溶液呈橙红色;
),且所得溶液呈橙红色;
② 不溶于水,密度比水大。
不溶于水,密度比水大。
(1)装置A中发生反应的化学方程式为
(2)m的作用是
(3)装置C中的现象是
(4)装置D中发生反应的离子方程式为
(5)取少量反应后的B中溶液,向其中加入
 ,振荡后静置,若出现
,振荡后静置,若出现 被氧化。
被氧化。(6)另取少量反应后的B中溶液于试管中,向其中加入少量
 被氧化。
被氧化。(7)已知氧化性
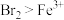 ,向200mL 0.1mol/L
,向200mL 0.1mol/L  溶液中通入标准状况下0.56L
溶液中通入标准状况下0.56L  时反应的离子方程式为
时反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 攀枝花铁矿,探明储量的钒钛磁铁矿达近百亿吨,其中钒、钛储量分别占全国已探明储量的87%和94.3%,分别居世界第三位和第一位,有“世界钒钛之都”之称,是全国四大铁矿区之一,炼铁厂以磁铁矿石、焦炭、空气等为主要原料炼铁,主要反应过程如图所示:

请根据所学知识回答下列问题。
(1)磁铁矿的主要成分是___________ (填化学式),铁元素在元素周期表中位于第___________ 周期第___________ 族。
(2)生铁和钢相比,含碳量更高的是___________ 。
(3)原料中焦炭的作用是___________ 。写出反应③的化学方程式:___________ 。
(4)铁的化合物之一聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m高铁酸盐均可用作水处理剂。以绿矾(FeSO4·7H2O)为原料,可制备聚合硫酸铁和高铁酸盐。
①为检验绿矾是否变质,可采取的操作方法是___________ 。
②取2ml FeSO4溶液于试管中,向其中滴加氢氧化钠溶液,观察到生成的白色沉淀迅速变为灰绿色, 最终变为红褐色,写出此过程中涉及的氧化还原反应的化学方程式:___________ 。已知在浓碱溶液中,NaClO能将Fe(OH)3,氧化为含FeO 的紫红色溶液,请写出该过程中发生反应的离子方程式:
的紫红色溶液,请写出该过程中发生反应的离子方程式:___________ 。

请根据所学知识回答下列问题。
(1)磁铁矿的主要成分是
(2)生铁和钢相比,含碳量更高的是
(3)原料中焦炭的作用是
(4)铁的化合物之一聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m高铁酸盐均可用作水处理剂。以绿矾(FeSO4·7H2O)为原料,可制备聚合硫酸铁和高铁酸盐。
①为检验绿矾是否变质,可采取的操作方法是
②取2ml FeSO4溶液于试管中,向其中滴加氢氧化钠溶液,观察到生成的白色沉淀迅速变为灰绿色, 最终变为红褐色,写出此过程中涉及的氧化还原反应的化学方程式:
 的紫红色溶液,请写出该过程中发生反应的离子方程式:
的紫红色溶液,请写出该过程中发生反应的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 从宏观现象探究微观本质是重要的化学学科素养。为研究FeCl3溶液的性质,某小组同学进行了如下探究实验。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是______ 。
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为______ 。
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为______ (填化学式)。两位同学实验如下:
(4)两位同学猜测实验a中的黑色沉淀可能是Fe2S3。继续实验:
根据实验b说明黑色沉淀是Fe2S3,写出实验b中Fe2S3与盐酸反应的化学方程式:______ 。
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为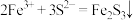 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于______ 。
②实验a中Fe2S3溶解时生成的黄色固体为______ ,乙同学推测是因为随着FeCl3溶液滴加至一定量, 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。
(6)已知: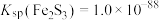 ,
,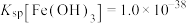 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:______ 。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为
| 实验a | 向稀Na2S溶液中逐滴加入FeCl3稀溶液,直至过量 |
| 实验现象 | 立即产生黑色沉淀并逐渐增加,无臭鸡蛋气味;FeCl3溶液过量后,黑色沉淀部分溶解,出现黄色沉淀 |
| 实验b | 将实验a中黑色沉淀过滤,并用CS2处理后洗净。向沉淀中加入6mol/L的盐酸,振荡试管 |
| 实验现象 | 加入盐酸后黑色沉淀溶解,转为乳黄色沉淀,并伴有臭鸡蛋气味 |
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为
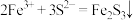 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于②实验a中Fe2S3溶解时生成的黄色固体为
 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。(6)已知:
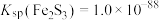 ,
,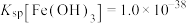 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
您最近一年使用:0次
名校
10 . 某铜合金中 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:
1.称取 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;
Ⅱ.取 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;
Ⅲ.向Ⅱ的锥形瓶中加入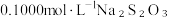 溶液滴定,发生反应:
溶液滴定,发生反应:
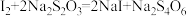 (无色);
(无色);
Ⅳ.平行测定四次,四次滴定实验消耗 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:
V.计算铜的质量分数。
已知: 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。
(1)盛装 溶液,应选择下图中的
溶液,应选择下图中的_____________ (填“a”或“b”)。

(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):_______
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是_____________ 。
(4)滴定终点的现象_____________ 。
(5)Ⅳ所消耗的 标准溶液平均体积为
标准溶液平均体积为_____________  ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为_____________ (结果保留两位小数)。
(6)以下操作造成铜的含量偏高的是_____________ 。
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入 溶液
溶液
 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:1.称取
 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;Ⅱ.取
 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;Ⅲ.向Ⅱ的锥形瓶中加入
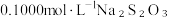 溶液滴定,发生反应:
溶液滴定,发生反应: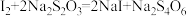 (无色);
(无色);Ⅳ.平行测定四次,四次滴定实验消耗
 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:| 滴定次数 | 待测溶液的体积/ |  溶液的体积/ 溶液的体积/ | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 50.00 | 0.00 | 18.02 |
| 第二次 | 50.00 | 0.56 | 18.96 |
| 第三次 | 50.00 | 0.22 | 18.20 |
| 第四次 | 50.00 | 0.35 | 18.35 |
已知:
 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。(1)盛装
 溶液,应选择下图中的
溶液,应选择下图中的
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中
 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是(4)滴定终点的现象
(5)Ⅳ所消耗的
 标准溶液平均体积为
标准溶液平均体积为 ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为(6)以下操作造成铜的含量偏高的是
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入
 溶液
溶液
您最近一年使用:0次



