名校
解题方法
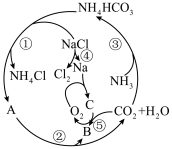
1 . 某些化合物具有如图所示的转化关系,其中A、B、C均为含有钠元素的化合物,部分转化的条件省略。 极易溶于水。
极易溶于水。
回答下列问题:
(1)A为___________ (填化学式,下同),B为___________ ,C为___________
(2) 的摩尔质量为
的摩尔质量为___________ ;要获得高浓度的 溶液,需向水中先通入
溶液,需向水中先通入___________ (填“ ”或“
”或“ ”)。
”)。
(3)反应④中氧化产物和还原产物的质量之比为___________ (填最简整数比);反应⑤中转移 电子时,生成
电子时,生成___________  (换算成标准状况下)
(换算成标准状况下) 。
。
(4)现有 由A、B形成的混合物,加入
由A、B形成的混合物,加入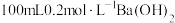 溶液(过量),充分反应后,过滤、洗涤、干燥,称量所得固体质量为
溶液(过量),充分反应后,过滤、洗涤、干燥,称量所得固体质量为 。
。
①配制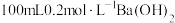 溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、
溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、___________ ;配制过程中,下列情况会导致配制结果偏低的是___________ 。(填标号)。
a.称量的 中含有少量
中含有少量
b.定容时未冷却至室温
c.定容时溶液超过刻度线,迅速用胶头滴管吸出多余液体
d.将配制好的溶液倒入试剂瓶中时有少量液体溅到试剂瓶外
② 原混合物中,A与B的物质的量之比
原混合物中,A与B的物质的量之比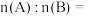
___________ (填最简整数比)。
 极易溶于水。
极易溶于水。回答下列问题:
(1)A为
(2)
 的摩尔质量为
的摩尔质量为 溶液,需向水中先通入
溶液,需向水中先通入 ”或“
”或“ ”)。
”)。(3)反应④中氧化产物和还原产物的质量之比为
 电子时,生成
电子时,生成 (换算成标准状况下)
(换算成标准状况下) 。
。(4)现有
 由A、B形成的混合物,加入
由A、B形成的混合物,加入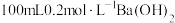 溶液(过量),充分反应后,过滤、洗涤、干燥,称量所得固体质量为
溶液(过量),充分反应后,过滤、洗涤、干燥,称量所得固体质量为 。
。①配制
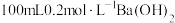 溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、
溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、a.称量的
 中含有少量
中含有少量
b.定容时未冷却至室温
c.定容时溶液超过刻度线,迅速用胶头滴管吸出多余液体
d.将配制好的溶液倒入试剂瓶中时有少量液体溅到试剂瓶外
②
 原混合物中,A与B的物质的量之比
原混合物中,A与B的物质的量之比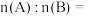
您最近一年使用:0次
2024-02-28更新
|
44次组卷
|
2卷引用:河北省衡水中学2023-2024学年高一下学期2月开学检测化学试题
2 . 锅炉水中溶解的氧气易对锅炉造成腐蚀,为了保证锅炉安全正常使用,常使用联氨( )处理锅炉水中溶解的氧,部分转化关系如图所示。下列说法错误的是
)处理锅炉水中溶解的氧,部分转化关系如图所示。下列说法错误的是
 )处理锅炉水中溶解的氧,部分转化关系如图所示。下列说法错误的是
)处理锅炉水中溶解的氧,部分转化关系如图所示。下列说法错误的是
A.液态 不能导电 不能导电 |
| B.反应①②③④均属于氧化还原反应 |
C.反应②中,每生成 ,同时生成 ,同时生成 |
D.反应①的电子转移可表示为 |
您最近一年使用:0次
2024-02-28更新
|
67次组卷
|
2卷引用:河北省衡水中学2023-2024学年高一下学期2月开学检测化学试题
3 . 钒和铬都是重要的战略金属,利用钒、铬废渣(主要成分为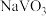 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。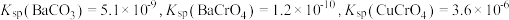 。
。
回答下列问题:
(1)基态铬原子价电子轨道表示式为_______ 。
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有_______ (任写一点)。
(3)“沉钒”的含钒产物为钒酸钙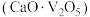 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是_______ 。
(4)“沉铬”时,铬转化为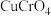 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为_______ 。
(5)向“沉钒后液”中加入足量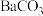 ,可将其中的铬转化为
,可将其中的铬转化为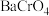 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为_______ (保留三位有效数字) 。
。
(6)复合材料氧铬酸钙的立方晶胞如下图所示。_______ 。
②已知该晶体的密度为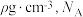 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与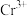 之间的最短距离为
之间的最短距离为_______ 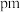 (列出计算式即可)。
(列出计算式即可)。
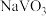 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。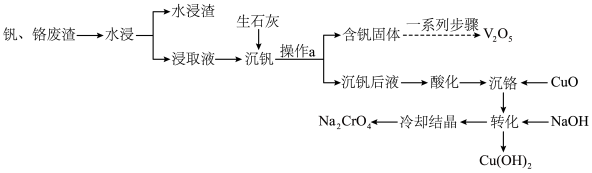
 。
。回答下列问题:
(1)基态铬原子价电子轨道表示式为
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有
(3)“沉钒”的含钒产物为钒酸钙
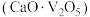 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是(4)“沉铬”时,铬转化为
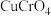 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为(5)向“沉钒后液”中加入足量
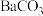 ,可将其中的铬转化为
,可将其中的铬转化为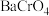 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为 。
。(6)复合材料氧铬酸钙的立方晶胞如下图所示。
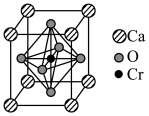
②已知该晶体的密度为
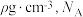 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与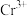 之间的最短距离为
之间的最短距离为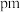 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2024-02-27更新
|
658次组卷
|
4卷引用:贵州省黔东南苗族侗族自治州黔东南州九校联考2023-2024学年高三下学期开学化学试题
贵州省黔东南苗族侗族自治州黔东南州九校联考2023-2024学年高三下学期开学化学试题广东省湛江市2024届高三下学期第二次模拟测试化学试题(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届河南省中原名校高三下学期考前全真模拟考试理科综合试题-高中化学
名校
4 . 二氧化铅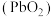 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
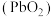 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是A.X是 ,Y是 ,Y是 |
B.还原产物与氧化产物的物质的量之比为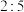 |
C.当生成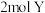 时,转移 时,转移 电子 电子 |
D.根据上述反应推测 不能氧化 不能氧化 |
您最近一年使用:0次
2024-02-27更新
|
227次组卷
|
3卷引用:山东省济宁市育才中学2023-2024学年高一下学期开学化学试题
5 . 以 溶液和不同金属的盐溶液作为实验对象,探究
溶液和不同金属的盐溶液作为实验对象,探究 的性质和盐溶液间反应的多样性。
的性质和盐溶液间反应的多样性。
【查阅资料】
① 能与多种不同金属离子形成沉淀或配合物:
能与多种不同金属离子形成沉淀或配合物:
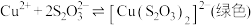 ,
,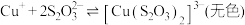
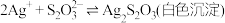 ,
,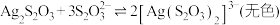
② 易被氧化为
易被氧化为 或者
或者
【进行实验】
Ⅰ.探究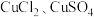 和
和 溶液之间的反应
溶液之间的反应
(1)经检验,实验a绿色变浅后的溶液中含 ,这说明
,这说明 具有
具有_______ (填“氧化”或“还原”)性。
(2)从反应速率和化学平衡两个角度解释实验a的实验现象_______ 。
II.探究 和
和 溶液之间的反应。
溶液之间的反应。
(3)实验c中产生的白色沉淀为 ,用化学用语解释“超过
,用化学用语解释“超过 后,产生少量白色沉淀”的原因:
后,产生少量白色沉淀”的原因:_______ 。
(4)为了探究实验c中产生黑色沉淀的原因,甲同学进行了进一步的实验:
ⅰ.取少量滤液B,用广泛pH试纸测定 ;
;
ⅱ.另取少量滤液B于试管中,_______ (填操作和现象),说明滤液中有 。
。
由上述实验现象,进而推测出黑色沉淀A可能为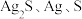 或它们的混合物。运用氧化还原反应规律,做出该推测的理由是
或它们的混合物。运用氧化还原反应规律,做出该推测的理由是_______ 。
【获得结论】
(5)根据上述实验, 和金属盐溶液之间反应的多样性与多种因素有关:①
和金属盐溶液之间反应的多样性与多种因素有关:①_______ :②金属盐中的阴离子是否能够参与反应;③反应时间的长短;④_______ 。
 溶液和不同金属的盐溶液作为实验对象,探究
溶液和不同金属的盐溶液作为实验对象,探究 的性质和盐溶液间反应的多样性。
的性质和盐溶液间反应的多样性。| 实验 试管 | 试剂滴管:逐滴滴加,总体积 | 现象 |
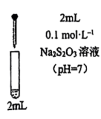 | 实验a: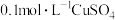 溶液 溶液实验b: 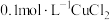 溶液 溶液 | 溶液先变为绿色,静止后缓慢变浅,最终变为浅绿色 溶液先变为绿色,缓慢产生白色浑浊,充分反应后绿色比实验a更浅 |
实验c: 溶液 溶液 | 生成白色沉淀,振荡后迅速溶解,得到无色清液;超过1.0mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色,静置充分反应后,过滤得到黑色沉淀A和滤液B |
①
 能与多种不同金属离子形成沉淀或配合物:
能与多种不同金属离子形成沉淀或配合物: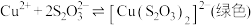 ,
,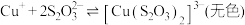
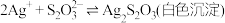 ,
,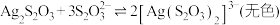
②
 易被氧化为
易被氧化为 或者
或者
【进行实验】
Ⅰ.探究
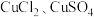 和
和 溶液之间的反应
溶液之间的反应(1)经检验,实验a绿色变浅后的溶液中含
 ,这说明
,这说明 具有
具有(2)从反应速率和化学平衡两个角度解释实验a的实验现象
II.探究
 和
和 溶液之间的反应。
溶液之间的反应。(3)实验c中产生的白色沉淀为
 ,用化学用语解释“超过
,用化学用语解释“超过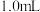 后,产生少量白色沉淀”的原因:
后,产生少量白色沉淀”的原因:(4)为了探究实验c中产生黑色沉淀的原因,甲同学进行了进一步的实验:
ⅰ.取少量滤液B,用广泛pH试纸测定
 ;
;ⅱ.另取少量滤液B于试管中,
 。
。由上述实验现象,进而推测出黑色沉淀A可能为
 或它们的混合物。运用氧化还原反应规律,做出该推测的理由是
或它们的混合物。运用氧化还原反应规律,做出该推测的理由是【获得结论】
(5)根据上述实验,
 和金属盐溶液之间反应的多样性与多种因素有关:①
和金属盐溶液之间反应的多样性与多种因素有关:①
您最近一年使用:0次
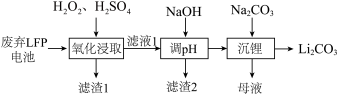
6 . LFP是一种常见的锂离子电池正极材料,其中含有LiFePO4、炭黑、铝箔。利用废弃LFP正极材料回收金属、选择性提锂的工艺流程如下图所示。
回答下列问题:
(1)Fe位于元素周期表的第___________ 周期___________ 族。
(2)若“滤渣1”中含有炭黑和FePO4,则“氧化浸取”中生成FePO4的离子方程式为___________ 。
(3)“滤渣2”的主要成分是___________ 。
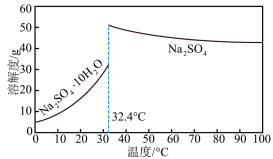
(4) 和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、
和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、___________ 、干燥。
(5)利用FePO4和Li2CO3与葡萄糖在氮气氛围中加热能制备LiFePO4和CO,则发生的化学方程式为___________ 。
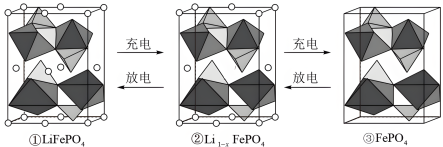
(6)LiFePO4的晶胞结构如图①所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,LiFeO4脱出部分 ,转化为
,转化为 (图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为
(图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为___________ g/cm3,LiFeO4转化 的电极反应式为
的电极反应式为___________ 。

回答下列问题:
(1)Fe位于元素周期表的第
(2)若“滤渣1”中含有炭黑和FePO4,则“氧化浸取”中生成FePO4的离子方程式为
(3)“滤渣2”的主要成分是
(4)
 和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、
和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、
(5)利用FePO4和Li2CO3与葡萄糖在氮气氛围中加热能制备LiFePO4和CO,则发生的化学方程式为
(6)LiFePO4的晶胞结构如图①所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,LiFeO4脱出部分
 ,转化为
,转化为 (图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为
(图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为 的电极反应式为
的电极反应式为
您最近一年使用:0次
7 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,同时在化工制备和电池材料等方面具有广泛的应用前景。某实验小组制备高铁酸钾并探究其性质。
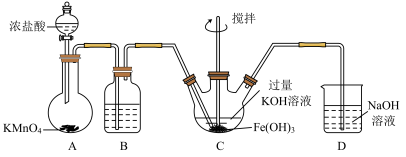
资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价_____ 。
(2)装置B中的试剂为_____ ,作用_____ 。
(3)装置C中制备K2FeO4时,发生反应的化学方程式为_____ ,每得到1mol K2FeO4,理论上消耗Cl2的物质的量为_____ mol。
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为_____ ,高铁酸钾作为水处理剂起到的作用是_____ 。
(5)制备 K2FeO4可以采用干式氧化法,初始反应为
 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为_____ 。

资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价
(2)装置B中的试剂为
(3)装置C中制备K2FeO4时,发生反应的化学方程式为
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为
(5)制备 K2FeO4可以采用干式氧化法,初始反应为

 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为
您最近一年使用:0次
解题方法
8 . 北京冬奥会备受世界瞩目。下列说法正确的
A.冬奥会“飞扬”火炬首次使用的燃料 为氧化性气体 为氧化性气体 |
B.国家速滑馆“冰丝带”采用 跨临界直冷制冰涉及化学变化 跨临界直冷制冰涉及化学变化 |
C.冬奥会提供的直饮水都经过 消毒处理,是利用其强氧化性 消毒处理,是利用其强氧化性 |
D.航天员通过化学反应让奥运五环在中国空间站上漂浮,其2号黑色环中,碘化钾、碘酸钾遇到乙酸后产生了碘单质,离子方程式: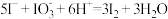 |
您最近一年使用:0次
名校
解题方法
9 . 三草酸合铁酸钾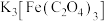 是制作蓝图的感光剂,光照下转化为黄色的
是制作蓝图的感光剂,光照下转化为黄色的 。已知:
。已知: 在水中的溶解度:
在水中的溶解度: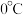 时,
时,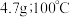 时,
时,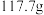
(1)制备 晶体
晶体
I.向 溶液中加入
溶液中加入 溶液,得到黄色沉淀
溶液,得到黄色沉淀 ;
;
Ⅱ.过滤,在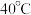 条件下向沉淀中加入
条件下向沉淀中加入 和
和 溶液,沉淀变为红褐色;
溶液,沉淀变为红褐色;
Ⅲ.待沉淀转化完全后,将浊液煮沸 ;停止加热,加入
;停止加热,加入 溶液,红褐色沉淀溶解,得到
溶液,红褐色沉淀溶解,得到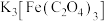 溶液;
溶液;
Ⅳ.___________(操作),得到 晶体。
晶体。
①配制 溶液需要加入稀硫酸,目的是防止氧化和
溶液需要加入稀硫酸,目的是防止氧化和___________ (用化学用语表示)。
②配平Ⅱ中反应方程式:___________ 。

③取少量Ⅱ中产物,先加入足量硫酸,___________ (填操作和现象),说明 完全反应。
完全反应。
④Ⅲ中将浊液煮沸 的目的是
的目的是___________ 。
⑤Ⅱ中加入 与
与 的物质的量比值大于2(理论值),结合化学方程式解释原因:
的物质的量比值大于2(理论值),结合化学方程式解释原因:___________ 。
⑥Ⅳ中的操作是___________ 。
(2)产品纯度检测
i.称量 制得的
制得的 样品,加水溶解,并加入稀
样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;
ii.加入过量 粉,反应完全后,弃去不溶物,向溶液中加入稀
粉,反应完全后,弃去不溶物,向溶液中加入稀 酸化,用
酸化,用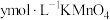 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知:ⅱ中 粉将铁元素全部还原为
粉将铁元素全部还原为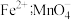 转化为
转化为 。
。
①步骤ⅰ的目的是___________ 。
②该样品中铁元素的质量分数是___________ (用含 的代数式表示)。
的代数式表示)。
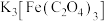 是制作蓝图的感光剂,光照下转化为黄色的
是制作蓝图的感光剂,光照下转化为黄色的 。已知:
。已知: 在水中的溶解度:
在水中的溶解度: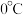 时,
时,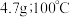 时,
时,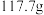
(1)制备
 晶体
晶体I.向
 溶液中加入
溶液中加入 溶液,得到黄色沉淀
溶液,得到黄色沉淀 ;
;Ⅱ.过滤,在
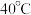 条件下向沉淀中加入
条件下向沉淀中加入 和
和 溶液,沉淀变为红褐色;
溶液,沉淀变为红褐色;Ⅲ.待沉淀转化完全后,将浊液煮沸
 ;停止加热,加入
;停止加热,加入 溶液,红褐色沉淀溶解,得到
溶液,红褐色沉淀溶解,得到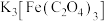 溶液;
溶液;Ⅳ.___________(操作),得到
 晶体。
晶体。①配制
 溶液需要加入稀硫酸,目的是防止氧化和
溶液需要加入稀硫酸,目的是防止氧化和②配平Ⅱ中反应方程式:

③取少量Ⅱ中产物,先加入足量硫酸,
 完全反应。
完全反应。④Ⅲ中将浊液煮沸
 的目的是
的目的是⑤Ⅱ中加入
 与
与 的物质的量比值大于2(理论值),结合化学方程式解释原因:
的物质的量比值大于2(理论值),结合化学方程式解释原因:⑥Ⅳ中的操作是
(2)产品纯度检测
i.称量
 制得的
制得的 样品,加水溶解,并加入稀
样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;ii.加入过量
 粉,反应完全后,弃去不溶物,向溶液中加入稀
粉,反应完全后,弃去不溶物,向溶液中加入稀 酸化,用
酸化,用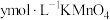 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:ⅱ中
 粉将铁元素全部还原为
粉将铁元素全部还原为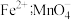 转化为
转化为 。
。①步骤ⅰ的目的是
②该样品中铁元素的质量分数是
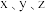 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
10 . 化学与生产生活密切相关。下列说法错误的是
A.饱和 溶液处理锅炉水垢中的 溶液处理锅炉水垢中的 ,发生了沉淀的转化 ,发生了沉淀的转化 |
B.夏天雷雨过后空气清新,是因为放电时 和 和 合成了 合成了 |
C.神舟系列飞船返回舱使用氮化硅耐高温结构材料, 属于共价晶体 属于共价晶体 |
D. 可用于污水脱氯 可用于污水脱氯 ,是由于其具有还原性 ,是由于其具有还原性 |
您最近一年使用:0次
2024-02-24更新
|
146次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三下学期开学化学试题



