1 . 综合处理含SO2的尾气工艺流程如图。下列说法正确的是

A.“吸收”过程发生的反应为 |
B.可用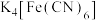 溶液检验“氧化”是否完全 溶液检验“氧化”是否完全 |
C.综合处理的总反应为 |
| D.向煤中加入石灰石可实现脱硫减排,该过程存在氧化还原反应 |
您最近一年使用:0次
2024-02-02更新
|
370次组卷
|
3卷引用:山东省临沂市郯城县美澳学校2023-2024学年高三下学期开学考试化学试题
名校
2 . 学以致用是学习化学的动力和源泉,掌握化学知识有助于我们更好地认识世界。回答下列问题:
(1)云、雾属于胶体,鉴别胶体和溶液的方法是______ ,胶体和溶液的本质区别是_______ 。
(2)生铁是______ (填“混合物”或“化合物”)。通常合金的熔点_____ (填“高于”或“低于”)其组成单质的熔点。
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得: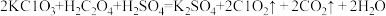 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为______ mol;该反应中的还原剂是______ (填化学式)。
(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=____ 。
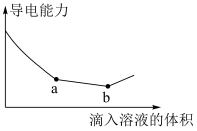
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是______ ,从a点到b点反应的离子方程式是______ ,解释b点之后导电能力上升的原因:______ 。
(1)云、雾属于胶体,鉴别胶体和溶液的方法是
(2)生铁是
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得:
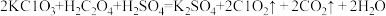 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是
您最近一年使用:0次
2024-01-28更新
|
111次组卷
|
4卷引用:新疆生产建设兵团第三师图木舒克市第二中学2023-2024学年高一下学期开学考试化学试题
解题方法
3 . 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。氯及其部分化合物的“价-类”二维图如图所示。回答下列问题:

(1)若e为钾盐,当e作氧化剂时,理论上可被直接还原为___________ (填标号),检验e中阳离子的实验方法是___________ 。
A. B.
B. C.
C. D.
D.
(2)实验室用 与a的浓溶液反应制取b,写出反应的化学方程式:
与a的浓溶液反应制取b,写出反应的化学方程式:___________ 。
(3)c是国际上公认的安全、高效的绿色消毒剂,对酸性污水中的 也有明显的去除效果,其反应原理为
也有明显的去除效果,其反应原理为 (部分反应物和产物省略,未配平),请将离子方程式补充完整:
(部分反应物和产物省略,未配平),请将离子方程式补充完整:___________ 。
(4)d见光易分解,见光分解反应的化学方程式为___________ 。
(5)用b可以制漂白粉,漂白粉的有效成分是___________ (填化学式);在潮湿的空气中起漂白作用的原理是___________ (用化学方程式表示)。

(1)若e为钾盐,当e作氧化剂时,理论上可被直接还原为
A.
 B.
B. C.
C. D.
D.
(2)实验室用
 与a的浓溶液反应制取b,写出反应的化学方程式:
与a的浓溶液反应制取b,写出反应的化学方程式:(3)c是国际上公认的安全、高效的绿色消毒剂,对酸性污水中的
 也有明显的去除效果,其反应原理为
也有明显的去除效果,其反应原理为 (部分反应物和产物省略,未配平),请将离子方程式补充完整:
(部分反应物和产物省略,未配平),请将离子方程式补充完整:(4)d见光易分解,见光分解反应的化学方程式为
(5)用b可以制漂白粉,漂白粉的有效成分是
您最近一年使用:0次
2024-01-28更新
|
60次组卷
|
2卷引用:河北省唐山市第五中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
4 . 合成氨技术对全球农业、工业和医药等领域都产生了重大影响。一种以N2和H2为原料光催化合成氨气的部分原理如图,其中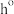 表示失去电子后带正电的空穴,
表示失去电子后带正电的空穴,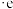 表示电子。下列说法错误的是
表示电子。下列说法错误的是
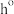 表示失去电子后带正电的空穴,
表示失去电子后带正电的空穴,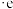 表示电子。下列说法错误的是
表示电子。下列说法错误的是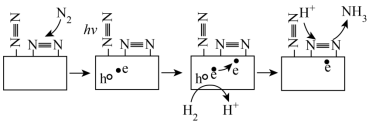
| A.反应过程中,N2得电子 |
| B.图示反应过程中有极性键和非极性键的断裂与形成 |
| C.每生成17gNH3,转移3mol电子 |
| D.标准状况下,相同体积的N2和NH3的物质的量相同 |
您最近一年使用:0次
2024-01-25更新
|
119次组卷
|
2卷引用:河北省石家庄市第二中学实验2023-2024学年高一下学期开学考试化学试题
名校
解题方法
5 . 实验室用废金属矿渣(主要成分是Al、Al2O3、Fe2O3、Fe3O4)为原料制备净水剂高铁酸钾(K2FeO4),流程如下:

(1)试剂a为___________ ,写出加入试剂a后Al发生的化学反应方程式___________ 。
(2)试剂b可以选择下列试剂___________ 。
①氨水②KI③H2O2④铁粉
并写出使用试剂b时,溶液中发生的离子反应方程式___________ 。证明溶液中试剂b加入的量不足的方法是___________ 。
(3)Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,KClO转化为KCl,制备过程中氧化剂与还原剂的物质的量之比为___________ 。
(4)实验室可用干法制备高铁酸钠,主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,制备1molNa2FeO4,反应转移的电子数目为___________ 。

(1)试剂a为
(2)试剂b可以选择下列试剂
①氨水②KI③H2O2④铁粉
并写出使用试剂b时,溶液中发生的离子反应方程式
(3)Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,KClO转化为KCl,制备过程中氧化剂与还原剂的物质的量之比为
(4)实验室可用干法制备高铁酸钠,主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,制备1molNa2FeO4,反应转移的电子数目为
您最近一年使用:0次
2024-01-24更新
|
205次组卷
|
2卷引用:广东省江门市第一中学2023-2024学年高一下学期开学考化学试题
6 . Ⅰ.“价类”二维图是学习元素及其化合物的重要工具.如图所示是铁及其化合物的“价类”二维图。__________ 、__________ ;Z在空气中转化为W的化学方程式为__________ 。
(2)含重铬酸根离子 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
______ (填“>”或“<”) 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为__________ g。
Ⅱ.硫酸亚铁晶体 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加__________ 后,溶液变为红色,证实了怀疑。
(4)步骤②反应的离子方程式为__________ ,下列物质中可以用来代替该步骤中的 是
是__________ (填序号)。
① 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠
(5)服用维生素C可使食物中的 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的__________ 性。假设实验中的损耗忽略不计,则该补血剂含铁元素的质量分数为__________ 。

(2)含重铬酸根离子
 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为Ⅱ.硫酸亚铁晶体
 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加
(4)步骤②反应的离子方程式为
 是
是①
 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠(5)服用维生素C可使食物中的
 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的
您最近一年使用:0次
2024-01-24更新
|
146次组卷
|
2卷引用:四川省广元市川师大万达中学2023-2024学年高一下学期入学考试化学试题
名校
解题方法
7 . 钼( )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
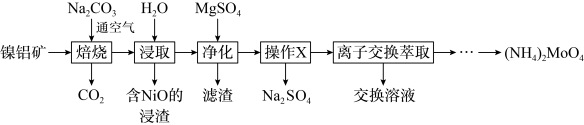
回答下列问题:
(1) 位于元素周期表第
位于元素周期表第_______ 周期第_______ 族。 中钼元素的化合价为
中钼元素的化合价为_______ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为_______ 。
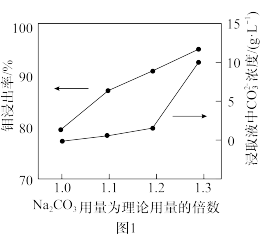
(3) 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:_______ 。
(4) 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。

(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“_______ ”步骤。
(6) 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为_______ 。
 )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
回答下列问题:
(1)
 位于元素周期表第
位于元素周期表第 中钼元素的化合价为
中钼元素的化合价为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)
 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:
(4)
 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。
| A.蒸发结晶 | B.低温结晶 | C.蒸馏 | D.萃取 |
(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“
(6)
 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为
您最近一年使用:0次
2024-01-22更新
|
1136次组卷
|
7卷引用:黑龙江省大庆市大庆中学2023-2024学年高三下学期开学化学试题
黑龙江省大庆市大庆中学2023-2024学年高三下学期开学化学试题2024年1月安徽普通高等学校招生考试适应性测试化学试题(已下线)T16-工业流程题(已下线)2024年1月“九省联考”安徽真题完全解读与考后提升(已下线)热点23 化学工艺流程综合题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省宜春市丰城市第九中学2023-2024学年高三(复读班)上学期期末考试化学试题
名校
8 . 实验室合成高铁酸钾( )的过程如下图所示。下列说法错误的是
)的过程如下图所示。下列说法错误的是
 )的过程如下图所示。下列说法错误的是
)的过程如下图所示。下列说法错误的是
A.气体a的主要成分为 |
B.沉淀b的主要成分为 |
C. 中 中 的化合价为 的化合价为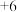 |
D.反应2为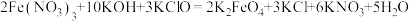 |
您最近一年使用:0次
2024-01-22更新
|
971次组卷
|
6卷引用:河南省信阳高级中学2023-2024学年高一下学期开学化学试题
河南省信阳高级中学2023-2024学年高一下学期开学化学试题河南省郑州市宇华实验学校2023-2024学年高二下学期开学考试化学试题2024年1月吉林、黑龙江普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”黑龙江、吉林卷真题完全解读与考后提升(已下线)选择题11-15湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题
名校
解题方法
9 . 对烟气高效的脱硫、脱硝是防治空气污染的重要方式。
Ⅰ.尿素液相脱硫脱硝
(1)尿素 含有的氨基中的N原子可与
含有的氨基中的N原子可与 形成配位键,原因是
形成配位键,原因是_______ 。
(2)尿素溶液吸收烟气中的 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是_______ 。
(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是_______ 。
Ⅱ. 气相脱硫脱硝
气相脱硫脱硝
一定温度下,将模拟烟气通入气相氧化反应器中。NO和 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。

已知:对于确定的基元反应,反应速率(v)与速率常数(k)成正比。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:
基元反应1:

基元反应2:
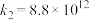
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:
基元反应3:
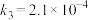
基元反应4:
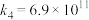
(4) 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是_______ 。
(5)将 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是_______ 。
(6)当体系中有水蒸气时, 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是_______ 。
Ⅰ.尿素液相脱硫脱硝
(1)尿素
 含有的氨基中的N原子可与
含有的氨基中的N原子可与 形成配位键,原因是
形成配位键,原因是(2)尿素溶液吸收烟气中的
 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若
 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是Ⅱ.
 气相脱硫脱硝
气相脱硫脱硝一定温度下,将模拟烟气通入气相氧化反应器中。NO和
 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。
已知:对于确定的基元反应,反应速率(v)与速率常数(k)成正比。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:基元反应1:


基元反应2:

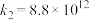
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:基元反应3:

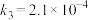
基元反应4:

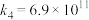
(4)
 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是(5)将
 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是(6)当体系中有水蒸气时,
 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
您最近一年使用:0次
2024-01-20更新
|
159次组卷
|
2卷引用:北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题
名校
10 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
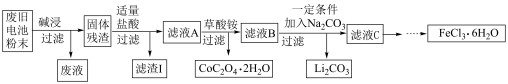
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近一年使用:0次
2024-01-16更新
|
268次组卷
|
3卷引用:四川省泸州市泸县第五中学2023-2024学年高一下学期开学化学试题



