名校
1 . 某电镀厂有两种废水,分别含有CN-和Cr2O 等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。

下列说法错误的是
 等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
下列说法错误的是
| A.上述流程图中,NaClO作氧化剂,Na2S2O3作还原剂 |
| B.可以用ClO2代替NaClO除去CN- |
| C.Cr3+的进一步处理方法可以是调节pH值使其生成Cr(OH)3沉淀,过滤而除去。 |
D.反应②中每消耗1mol Cr2O 转移电子的数目为3NA (NA表示阿伏加德罗常数) 转移电子的数目为3NA (NA表示阿伏加德罗常数) |
您最近一年使用:0次
2021-06-29更新
|
265次组卷
|
2卷引用:浙江省天台中学2021-2022学年高二上学期返校考试化学试题
2 . 实验室中利用固体KMnO4进行如图实验,下列说法错误的是
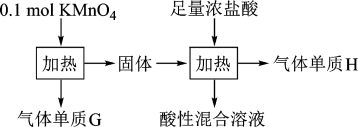

| A.G与H均为氧化产物 | B.实验中KMnO4只作氧化剂 |
| C.Mn元素至少参与了3个氧化还原反应 | D.G与H的物质的量之和可能为0.25mol |
您最近一年使用:0次
2021-06-29更新
|
8449次组卷
|
20卷引用:山东省济宁市实验中学2022届高三上学期开学考试化学试题
山东省济宁市实验中学2022届高三上学期开学考试化学试题2021年新高考山东化学高考真题(已下线)专题04 氧化还原反应-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省枣庄市第三中学2022届高三第一次月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题2021年山东高考化学试题变式题11-20(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)河北省邯郸市大名县第一中学2021-2022学年高二下学期期末考试化学试题江西省樟树航天中学高三年级2021-2022学年高三上学期10月调研考试化学试题山东省新泰市第一中学2022—2023学年高一上学期期中考试化学试题(已下线)热点情景汇编-专题三 氧化还原中的化学贵州省遵义市第一中学2022-2023学年高一上学期期中考试化学试题(已下线)专题04 氧化还原反应及其应用(讲)-2023年高考化学二轮复习讲练测(新高考专用)湖南省株洲市第二中学2023届高三上学期第二次月考化学试题(已下线)专题08 氧化还原反应方程式的书写及计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 氧化还原反应基本概念的判断(已下线)第4讲 氧化还原反应的基本概念与规律(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)
3 . 汽车安全气囊中装有 和
和 固体,发生碰撞时生成两种金属氧化物和一种单质气体,下列说法正确的是
固体,发生碰撞时生成两种金属氧化物和一种单质气体,下列说法正确的是
 和
和 固体,发生碰撞时生成两种金属氧化物和一种单质气体,下列说法正确的是
固体,发生碰撞时生成两种金属氧化物和一种单质气体,下列说法正确的是| A.氧化产物与还原产物的质量比为1∶15 |
B.每消耗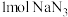 转移 转移 电子 电子 |
C.安全气囊中发生的反应为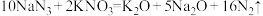 |
D.氮气的电子式为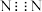 |
您最近一年使用:0次
2021-06-09更新
|
458次组卷
|
3卷引用:2021年秋季高三化学开学摸底考试卷03(广东专用)
4 . 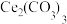 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有
形式存在,还含有 、
、 、
、 、
、 等物质。以独居石为原料制备
等物质。以独居石为原料制备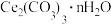 的工艺流程如下:
的工艺流程如下:
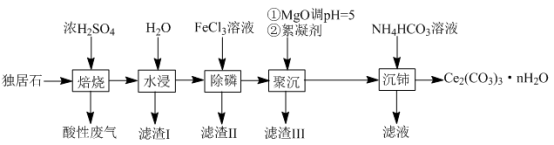
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为_______ ;
(2)为提高“水浸”效率,可采取的措施有_______ (至少写两条);
(3)滤渣Ⅲ的主要成分是_______ (填化学式);
(4)加入絮凝剂的目的是_______ ;
(5)“沉铈”过程中,生成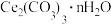 的离子方程式为
的离子方程式为_______ ,常温下加入的 溶液呈
溶液呈_______ (填“酸性”“碱性”或“中性”)(已知: 的
的 ,
, 的
的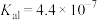 ,
, );
);
(6)滤渣Ⅱ的主要成分为 ,在高温条件下,
,在高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成
,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______
 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有
形式存在,还含有 、
、 、
、 、
、 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为
(2)为提高“水浸”效率,可采取的措施有
(3)滤渣Ⅲ的主要成分是
(4)加入絮凝剂的目的是
(5)“沉铈”过程中,生成
 的离子方程式为
的离子方程式为 溶液呈
溶液呈 的
的 ,
, 的
的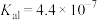 ,
, );
);(6)滤渣Ⅱ的主要成分为
 ,在高温条件下,
,在高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成
,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
2021-06-09更新
|
11107次组卷
|
32卷引用:黑龙江省齐齐哈尔市讷河市第一中学2023-2024学年高二下学期开学考试化学试题
黑龙江省齐齐哈尔市讷河市第一中学2023-2024学年高二下学期开学考试化学试题2021年新高考湖南化学高考真题(已下线)微专题32 化学工艺流程题——核心反应与条件控制-备战2022年高考化学考点微专题(已下线)微专题31 化学工艺流程题——原料的预处理-备战2022年高考化学考点微专题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)2021年湖南省高考化学试卷变式题11-19(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题27 无机化工流程-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题16 工艺流程题-三年(2020-2022)高考真题分项汇编(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题(已下线)第09讲 无机非金属材料(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省常德市汉寿县第一中学2022-2023学年高三上学期第一次月考化学试题山东省滨州市沾化区实验高级中学2022-2023学年高三上学期第二次月考化学试题第二部分 热点专项突破——解题能力稳提升 专项1 物质制备类的工艺流程 热点1 以矿物为载体的工艺流程(已下线)第八章 水溶液中的离子反应与平衡 第55讲 无机化工流程题的解题策略(已下线)第二部分 工业生产流程 综合提能训练(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题福建省永春第一中学2022-2023学年高二下学期6月月考化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)微专题 无机化工流程题的解题策略
5 .  常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是
。下列说法错误的是
 常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是
。下列说法错误的是A.产生22.4L(标准状况) 时,反应中转移 时,反应中转移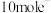 |
| B.反应中氧化剂和还原剂的物质的量之比为11:6 |
C.可用石灰乳吸收反应产生的 制备漂白粉 制备漂白粉 |
D.可用酸化的淀粉碘化钾溶液检验食盐中 的存在 的存在 |
您最近一年使用:0次
2021-06-09更新
|
15633次组卷
|
75卷引用:山东省济宁市实验中学2022届高三上学期开学考试化学试题
山东省济宁市实验中学2022届高三上学期开学考试化学试题辽宁省凌源市2021-2022学年高三下学期高三开学考试化学试题江西省瑞金市第二中学2022-2023学年高三上学期开学考试化学试题北京工业大学附属中学2022-2023学年高三上学期开学测试化学试题2021年新高考湖南化学高考真题河北省辛集中学 2020-2021学年高二下学期期末考试化学试题(已下线)课时09 氧化还原反应概念及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向05 氧化还原反应-备战2022年高考化学一轮复习考点微专题(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题11 富集在海水中的元素——氯 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第5讲 氧化还原反应(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)湖南省邵阳邵东市第一中学2022届高三上学期第一次月考化学试题安徽省合肥市第九中学2022届高三第一次阶段测验化学试卷江西省赣州市第十四中学2022届高三上学期第二次月考化学试题北京市第二十中学2021-2022学年高一上学期期中考试化学试题山西省运城市2021-2022学年高三上学期期中考试化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)吉林省东北师范大学附属中学2021-2022学年高三上学期一模考试化学试题甘肃省天水市第一中学2021-2022高三上学期第三次考试化学试题天津市第一中学2021-2022学年高三上学期第二次月考化学试题2021年湖南省高考化学试卷变式题1-10(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)河南省名校联盟2021-2022学年高三上学期第三次诊断考试化学试题河南省顶尖名校联盟2021-2022学年高二下学期联赛考试化学试题(已下线)卷06 氧化还原-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题04 氧化还原反应-三年(2020-2022)高考真题分项汇编(已下线)微专题10 “守恒法”在氧化还原反应计算中的应用-备战2023年高考化学一轮复习考点微专题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第03讲 氧化还原反应(讲)-2023年高考化学一轮复习讲练测(新教材新高考)河南省濮阳市第一高级中学2023届高三第一次质量检测化学试题陕西省西安市长安区第一中学2021-2022学年高二下学期期末考试化学试题(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题30 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2023年高考化学一轮复习考点微专题第二章 海水中的重要元素——钠和氯 ★综合拔高练江苏省南通市通州区金沙中学2021-2022学年高一上学期1月学业水平调研化学试题四川省广元市树人中学2021-2022学年高三上学期第二次段考化学试题江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题湖南省常德市桃源县第一中学2022-2023学年高三上学期9月月考化学试题河北省石家庄市第四中学2022-2023学年高三上学期十月月考化学试题安徽省六安市新安中学2022-2023学年高三上学期第二次月考化学试题(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题湖南省长沙市同升湖实验学校2022-2023学年高三上学期第三次月考化学试题安徽省宿城第一中学2022-2023学年高一上学期阶段检测化学试题(已下线)专题04 氧化还原反应及其应用(讲)-2023年高考化学二轮复习讲练测(新高考专用)广西钟山县钟山中学2021-2022学年高二上学期第一次(9月)月考化学(文科)试题湖南省株洲市九方中学2022-2023学年高一上学期第三次月考化学试题(已下线)专题07 氧化还原反应分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题卷07 氧化还原反应的概念、规律及应用-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题09 氧化还原反应(已下线)专题09 氧化还原反应(已下线)第5讲 氧化还原反应方程式的配平与计算(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)【知识图鉴】单元讲练测必修第一册第一单元03巩固练(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)云南省开远市第一中学校2022-2023学年高二下学期5月月考化学试题广东省台山市第一中学2023-2024学年高三上学期第一次月考化学试题广东省东莞市光正实验学校2023-2024学年高三上学期第一次月考化学试题吉林省长春外国语学校2023-2024学年高三上学期9月月考化学试题辽宁省沈阳市新民市高级中学2023-2024学年高三上学期10月月考化学试题广东省惠州市博罗县博师高级中学2023-2024学年高三上学期9月月考化学试题福建省厦门第六中学2023-2024学年高一上学期1月月考化学试题甘肃省天水市甘谷县第三中学2023-2024学年高一上学期12月第三次月考化学试卷(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
6 . 在酸性环境中,纳米 复合材料去除污染水体的
复合材料去除污染水体的 的反应过程(Ni不参与反应)如图所示:
的反应过程(Ni不参与反应)如图所示:
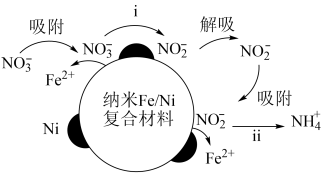
下列表达反应过程或现象的方程式错误的是
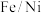 复合材料去除污染水体的
复合材料去除污染水体的 的反应过程(Ni不参与反应)如图所示:
的反应过程(Ni不参与反应)如图所示:
下列表达反应过程或现象的方程式错误的是
A.反应步骤ⅰ: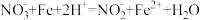 |
B.反应步骤ⅱ: |
C.反应进行一段时间,过滤出水体中出现的白色絮状物,白色絮状物在空气中最终变成红褐色: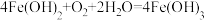 |
D.硝酸亚铁溶液中滴加稀硫酸发现溶液变黄: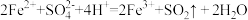 |
您最近一年使用:0次
2021-06-03更新
|
1421次组卷
|
14卷引用:湖南省永州市第一中学2022-2023学年高三上学期入学考试化学试题
湖南省永州市第一中学2022-2023学年高三上学期入学考试化学试题西藏拉萨中学2021届高三第八次月考理综化学试题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题13 氮及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练 (已下线)专题08 铁及其化合物(限时精练)-2022年高三毕业班化学常考点归纳与变式演练天津市耀华中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-测试上海市2021-2022学年高三下学期第三次适应性测试 化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专项特训2 非金属及其化合物对环境的影响宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题天津市天津中学2023-2024学年高三上学期第一次月考化学试题广东省实验中学2023-2024学年高三上学期第一次阶段考试化学试题
7 . 某废水理氨废水,反应为NH3+2O2
 +H++H2O,6H++6
+H++H2O,6H++6 +5CH3OH
+5CH3OH 3N2↑+5CO2↑+13H2O。在处理过程中,NH3转化为
3N2↑+5CO2↑+13H2O。在处理过程中,NH3转化为 的转化率可达95%,而
的转化率可达95%,而 转化为N2的转化率可达96%。若每天处理含NH30.034 g·L-1的废水500 m3,则理论上每天所需甲醇的质量为
转化为N2的转化率可达96%。若每天处理含NH30.034 g·L-1的废水500 m3,则理论上每天所需甲醇的质量为

 +H++H2O,6H++6
+H++H2O,6H++6 +5CH3OH
+5CH3OH 3N2↑+5CO2↑+13H2O。在处理过程中,NH3转化为
3N2↑+5CO2↑+13H2O。在处理过程中,NH3转化为 的转化率可达95%,而
的转化率可达95%,而 转化为N2的转化率可达96%。若每天处理含NH30.034 g·L-1的废水500 m3,则理论上每天所需甲醇的质量为
转化为N2的转化率可达96%。若每天处理含NH30.034 g·L-1的废水500 m3,则理论上每天所需甲醇的质量为| A.24.32 kg | B.30 kg | C.25.3 kg | D.4.08 kg |
您最近一年使用:0次
2021-06-01更新
|
59次组卷
|
2卷引用:云南省镇沅县第一中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
8 . 用FeCl3、CuCl2的混合溶液作吸收剂可吸收工厂排放的含H2S的废气,从而减少空气污染并回收S,其过程如图所示(各步均进行完全)。下列叙述正确的是
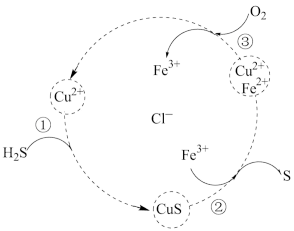

| A.①反应的离子方程式为: S2-+Cu2+= CuS |
| B.在转化过程中化合价没有变化的元素只有H |
| C.回收32gS时,理论上需要消耗标准状况O211.2 L |
| D.吸收剂吸收前后混合溶液中Fe3+、Cu2+浓度不变 |
您最近一年使用:0次
2021-05-31更新
|
1110次组卷
|
5卷引用:2021年秋季高三化学开学摸底考试卷03(广东专用)
9 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O3、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
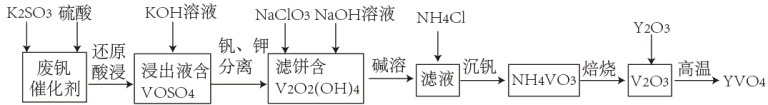
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是_______ 。V2O5被还原的离子方程式为_______ 。
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH_______ 7(填“>”“<”或“=”)。
(3)结合“碱溶”和“沉钒”可知, 、
、 中
中_______ 的氧化性更强,“沉钒”时发生反应的化学方程式为_______ 。
(4)利用上述表格数据,计算Fe(OH)2的Ksp=_______ 。
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为_______ 。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 阳离子 | VO2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mo/L)的pH | 3.0 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 7.0 | 3.2 | 9.0 |
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH
(3)结合“碱溶”和“沉钒”可知,
 、
、 中
中(4)利用上述表格数据,计算Fe(OH)2的Ksp=
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为
您最近一年使用:0次
名校
10 . 反应2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) ΔH=-1135.7 kJ·mol可为火箭发射提供能量。下列有关该反应的说法正确的是
| A.反应消耗32gN2H4(l)放出1135.7kJ的能量 |
| B.反应物中所有化学键键能之和大于生成物中所有化学键键能之和 |
| C.每生成18g水,反应中转移电子物质的量为4mol |
| D.常温下该反应可自发进行 |
您最近一年使用:0次
2021-05-28更新
|
380次组卷
|
5卷引用:四川省内江市第六中学2022-2023学年高二下学期入学考试化学试题
四川省内江市第六中学2022-2023学年高二下学期入学考试化学试题 江苏省南通市2021届高三下学期5月考前练习卷(四模)化学试题(已下线)【镇江新东方】考前练习卷(化学)(已下线)2020年江苏卷化学高考真题变式题1-10(已下线)选择题6-10



