1 . 资源、能源、材料、环保、健康、安全等是当今社会重要的研究主题,化学与这些主题密切相关,在其研究与应用中发挥着重要作用。
Ⅰ.保证食品安全、保持营养均衡,是保障人体健康的基础。
(1)由于化学物质使用不当,给人印象不佳的化学名词越来越多:苏丹红、三聚氰胺……。下列做法不会危及人体健康的是_______(填字母)。
Ⅱ.20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(2)下列各项属于“绿色化学”要求的是_______ (填字母)。
A.处理污染物 B.治理污染点 C.杜绝污染源
Ⅲ.资源的利用有着重要的意义。我国具有广阔的海岸线,海洋中蕴含着丰富的资源。下面是海水综合利用联合工业体系的简图:
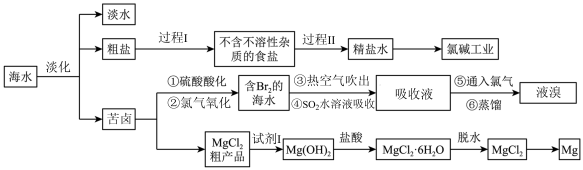
回答下列问题:
(3)过程I采用的操作是_______ 。
(4)工业上从海水中提取液溴的流程图中,步骤④除了用 吸收
吸收 外,理论上下列也能吸收
外,理论上下列也能吸收 的是_______(填字母)。
的是_______(填字母)。
(5)经过步骤①②已获得 ,不直接用含
,不直接用含 的海水进行蒸馏得到液溴,而要经过“热空气吹出、
的海水进行蒸馏得到液溴,而要经过“热空气吹出、 吸收、通入氯气”后再蒸馏,其目的是
吸收、通入氯气”后再蒸馏,其目的是_______ 。
(6)根据上述反应可判断 、
、 、
、 三种物质氧化性由强到弱的顺序是
三种物质氧化性由强到弱的顺序是_______ 。
(7)为了使镁离子沉淀下来,并充分利用当地的贝壳(主要成分为碳酸钙)资源,加入的试剂I是_______ (填化学式)。
(8)步骤⑥的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:_______ 。
Ⅰ.保证食品安全、保持营养均衡,是保障人体健康的基础。
(1)由于化学物质使用不当,给人印象不佳的化学名词越来越多:苏丹红、三聚氰胺……。下列做法不会危及人体健康的是_______(填字母)。
| A.为改善食品品质而加入规定范围内的食品添加剂 |
| B.用霉变花生压榨食用油 |
| C.用小苏打做糕点的疏松剂 |
| D.用工业盐亚硝酸钠腌制鱼肉 |
Ⅱ.20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(2)下列各项属于“绿色化学”要求的是
A.处理污染物 B.治理污染点 C.杜绝污染源
Ⅲ.资源的利用有着重要的意义。我国具有广阔的海岸线,海洋中蕴含着丰富的资源。下面是海水综合利用联合工业体系的简图:

回答下列问题:
(3)过程I采用的操作是
(4)工业上从海水中提取液溴的流程图中,步骤④除了用
 吸收
吸收 外,理论上下列也能吸收
外,理论上下列也能吸收 的是_______(填字母)。
的是_______(填字母)。A. | B. | C. | D.NaCl |
 ,不直接用含
,不直接用含 的海水进行蒸馏得到液溴,而要经过“热空气吹出、
的海水进行蒸馏得到液溴,而要经过“热空气吹出、 吸收、通入氯气”后再蒸馏,其目的是
吸收、通入氯气”后再蒸馏,其目的是(6)根据上述反应可判断
 、
、 、
、 三种物质氧化性由强到弱的顺序是
三种物质氧化性由强到弱的顺序是(7)为了使镁离子沉淀下来,并充分利用当地的贝壳(主要成分为碳酸钙)资源,加入的试剂I是
(8)步骤⑥的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:
您最近一年使用:0次
2022-07-24更新
|
230次组卷
|
2卷引用:山西省吕梁市2021-2022学年高一下学期期末考化学试题
2 . 硫代硫酸钠可用于照相业作定影剂、鞣革时重铬酸盐的还原剂,还可用于四乙基铅、染料中间体等的制造和矿石提银等。实验室模拟工业制取 的装置如图所示。已知:
的装置如图所示。已知: 易溶于水,不溶于乙醇;常温下溶液中析出的晶体为
易溶于水,不溶于乙醇;常温下溶液中析出的晶体为 ;
; 于
于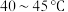 下熔化,
下熔化,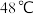 下分解。
下分解。
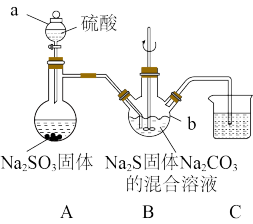
(1)仪器a的名称为___________ 。
(2)仪器a中的硫酸能不能用盐酸或硝酸代替?___________ (填“能”或“不能”),理由是___________ 。
(3)B中生成 反应的化学方程式为
反应的化学方程式为___________ ,该反应中每转移 电子时,生成
电子时,生成 的物质的量为
的物质的量为___________ ;反应结束后为了得到 ,可对三颈烧瓶中的溶液采取的措施是
,可对三颈烧瓶中的溶液采取的措施是___________ 蒸发浓缩、结晶、过滤。洗涤。洗涤时可选用的试剂为___________ (填名称),原因是___________ 。
(4)实验过程中,经常观察到三颈烧瓶中出现黄色浑浊,原因是___________ 。
 的装置如图所示。已知:
的装置如图所示。已知: 易溶于水,不溶于乙醇;常温下溶液中析出的晶体为
易溶于水,不溶于乙醇;常温下溶液中析出的晶体为 ;
; 于
于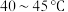 下熔化,
下熔化,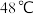 下分解。
下分解。
(1)仪器a的名称为
(2)仪器a中的硫酸能不能用盐酸或硝酸代替?
(3)B中生成
 反应的化学方程式为
反应的化学方程式为 电子时,生成
电子时,生成 的物质的量为
的物质的量为 ,可对三颈烧瓶中的溶液采取的措施是
,可对三颈烧瓶中的溶液采取的措施是(4)实验过程中,经常观察到三颈烧瓶中出现黄色浑浊,原因是
您最近一年使用:0次
解题方法
3 . 氯化亚砜(SOCl2)常用作脱水剂。某校科研小组拟以Cl2、S2Cl2、ClSO3H(氯磺酸)为原料合成SOCl2并探究其相关性质,制备装置如图所示。有关物质的部分性质见表。
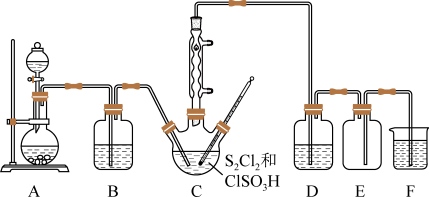
回答下列问题:
(1)装置A中可能的试剂是____ (选填数字编号)。
①MnO2和盐酸
②KMnO4和浓盐酸
③漂白粉和浓盐酸
④浓硫酸与NaCl
(2)装置D中盛放的试剂是____ ,装置E的作用是____ 。
(3)将SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因____ 。
(4)小明同学认为SOCl2也可与FeCl3·6H2O混合制取无水FeCl3,但小强同学认为可能会发生副反应使最后的产品不纯,可能产生的杂质微粒是____ ;为验证猜想,可选择的试剂是____ (选填数字编号)。
①BaCl2溶液、稀盐酸
②Ba(NO3)2溶液、稀HNO3
③KSCN溶液
④K3[Fe(CN)6]溶液
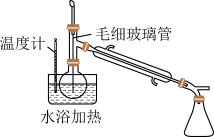
(5)若硫元素全部转化到目标产物中,在50℃下C中发生反应的化学方程式为____ ;反应结束后,利用如图所示装置将C中混合物分离,毛细玻璃管的作用是____ 。
| 物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
| SOCl2 | -105 | 78.8 | 易水解,温度高于150℃分解 |
| ClSO3H | -80 | 156 | 具有强吸水性,不易分解 |
| S2Cl2 | -77 | 138 | 遇水即反应 |

回答下列问题:
(1)装置A中可能的试剂是
①MnO2和盐酸
②KMnO4和浓盐酸
③漂白粉和浓盐酸
④浓硫酸与NaCl
(2)装置D中盛放的试剂是
(3)将SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因
(4)小明同学认为SOCl2也可与FeCl3·6H2O混合制取无水FeCl3,但小强同学认为可能会发生副反应使最后的产品不纯,可能产生的杂质微粒是
①BaCl2溶液、稀盐酸
②Ba(NO3)2溶液、稀HNO3
③KSCN溶液
④K3[Fe(CN)6]溶液
(5)若硫元素全部转化到目标产物中,在50℃下C中发生反应的化学方程式为

您最近一年使用:0次
解题方法
4 . 用废镍渣粉(含Ni、NiO、Al、Al2O3、FeO、SiO2)制备某镍催化剂(Ni/硅藻土)的工艺流程如下。
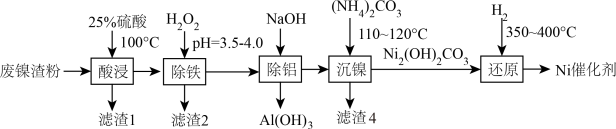
I、该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
II、室温时,Ksp[Al(OH)3]=1×10-33。
回答下列问题:。
(1)“酸浸”时,为提高浸出率,可采取的措施有___________ (列举2条)。
(2)滤渣1、滤渣2的成分依次是___________ 、___________ (填化学式)。
(3)“除铝”时,室温下,除去溶液中的Al3+[使c(Al3+)<1×10-6mol·L-1]理论上需调节溶液pH范围为___________ 。
(4)“沉镍”时,足量 沉淀Ni2+得到Ni2(OH)2CO3的离子方程式为
沉淀Ni2+得到Ni2(OH)2CO3的离子方程式为___________ ;“沉镍”时会加入硅藻土,硅藻土的作用是___________ 。;滤液4中主要阳离子为___________ (填化学式)。
(5)“还原”时,发生反应的化学方程式为___________ 。

I、该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Ni2+ |
| 开始沉淀pH | 2.2 | 7.0 | 6.4 |
| 完全沉淀pH | 3.2 | 9.0 | 8.4 |
回答下列问题:。
(1)“酸浸”时,为提高浸出率,可采取的措施有
(2)滤渣1、滤渣2的成分依次是
(3)“除铝”时,室温下,除去溶液中的Al3+[使c(Al3+)<1×10-6mol·L-1]理论上需调节溶液pH范围为
(4)“沉镍”时,足量
 沉淀Ni2+得到Ni2(OH)2CO3的离子方程式为
沉淀Ni2+得到Ni2(OH)2CO3的离子方程式为(5)“还原”时,发生反应的化学方程式为
您最近一年使用:0次
2022高三·全国·专题练习
真题
解题方法
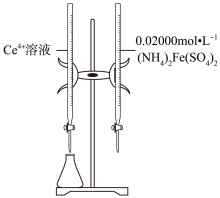
5 . 实验室以二氧化铈( )废渣为原料制备
)废渣为原料制备 含量少的
含量少的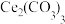 ,其部分实验过程如下:
,其部分实验过程如下:

(1)“酸浸”时 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(2)pH约为7的 溶液与
溶液与 溶液反应可生成
溶液反应可生成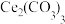 沉淀,该沉淀中
沉淀,该沉淀中 含量与加料方式有关。得到含
含量与加料方式有关。得到含 量较少的
量较少的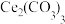 的加料方式为
的加料方式为_______ (填序号)。
A.将 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中
(3)通过中和、萃取、反萃取、沉淀等过程,可制备 含量少的
含量少的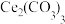 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
 (水层)+3HA(有机层)
(水层)+3HA(有机层)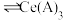 (有机层)+
(有机层)+ (水层)
(水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是_______ 。
②反萃取的目的是将有机层 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有_______ (填两项)。
③与“反萃取”得到的水溶液比较,过滤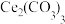 溶液的滤液中,物质的量减小的离子有
溶液的滤液中,物质的量减小的离子有_______ (填化学式)。
(4)实验中需要测定溶液中 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取
。请补充完整实验方案:①准确量取 溶液[
溶液[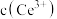 约为
约为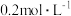 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到 容量瓶中后定容;②按规定操作分别将
容量瓶中后定容;②按规定操作分别将 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③_______ 。
 )废渣为原料制备
)废渣为原料制备 含量少的
含量少的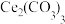 ,其部分实验过程如下:
,其部分实验过程如下:
(1)“酸浸”时
 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为(2)pH约为7的
 溶液与
溶液与 溶液反应可生成
溶液反应可生成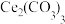 沉淀,该沉淀中
沉淀,该沉淀中 含量与加料方式有关。得到含
含量与加料方式有关。得到含 量较少的
量较少的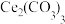 的加料方式为
的加料方式为A.将
 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中(3)通过中和、萃取、反萃取、沉淀等过程,可制备
 含量少的
含量少的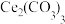 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为 (水层)+3HA(有机层)
(水层)+3HA(有机层)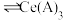 (有机层)+
(有机层)+ (水层)
(水层)①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是
②反萃取的目的是将有机层
 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有③与“反萃取”得到的水溶液比较,过滤
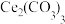 溶液的滤液中,物质的量减小的离子有
溶液的滤液中,物质的量减小的离子有(4)实验中需要测定溶液中
 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取
。请补充完整实验方案:①准确量取 溶液[
溶液[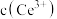 约为
约为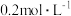 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到 容量瓶中后定容;②按规定操作分别将
容量瓶中后定容;②按规定操作分别将 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③
您最近一年使用:0次
2022-07-21更新
|
8007次组卷
|
13卷引用:专题16 化学实验综合题-2022年高考真题模拟题分项汇编
(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编江苏省2022年普通高中学业水平选择性考试(已下线)2022年江苏卷高考真题变式题14-17(已下线)专题17 化工流程综合题-备战2023年高考化学母题题源解密(广东卷)(已下线)易错点33 物质的制备-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十三 实验探究中的新思路(已下线)江苏省2022年普通高中学业水平选择性考试变式题(实验探究题)(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第30讲水的电离和溶液的酸碱性(已下线)题型四 以无机物制备为载体的综合实验-备战2024年高考化学答题技巧与模板构建
2022高三·全国·专题练习
真题
名校
6 . 室温下,下列实验探究方案不能 达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向盛有 溶液的试管中滴加几滴 溶液的试管中滴加几滴 溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 |  具有还原性 具有还原性 |
| B | 向盛有 水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 |  具有漂白性 具有漂白性 |
| C | 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 |  的氧化性比 的氧化性比 的强 的强 |
| D | 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 |  是弱电解质 是弱电解质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-21更新
|
10083次组卷
|
28卷引用:专题11 化学实验基础-2022年高考真题模拟题分项汇编
(已下线)专题11 化学实验基础-2022年高考真题模拟题分项汇编江苏省2022年普通高中学业水平选择性考试(已下线)2022年江苏卷高考真题变式题1-13河南省洛阳市第一高级中学2023届高三上学期8月调研考试化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点04 氧化还原反应-备战2023年高考化学考试易错题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)江苏省南京市金陵中学河西分校2022-2023学年高二上学期期末检测化学试题(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题11-13)(已下线)专题11 化学实验基础(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价(已下线)专题05 突破化学实验基础(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江苏省南京市第二十九中学2022-2023学年高二下学期3月月考化学试题(已下线)素养卷09 微型原理验证方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点10 再现常考化学实验基础知识-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)江苏省扬州中学2022-2023学年高一下学期5月月考化学试题(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)江苏省四校2023-2024学年高二上学期开学联考化学试题吉林省长春外国语学校2023-2024学年高三上学期开学考试化学试题河北省涞水北雄高级中学2022-2023学年高三下学期3月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第3讲 物质制备实验的设计与评价广西玉林市博白县中学2023-2024学年高三上学期开学考试化学试题安徽省芜湖市安徽师范大学附属中学2023-2024学年高一下学期4月测试化学试题(已下线)第04讲 氧化还原反应的基本概念和规律(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
2022高三·全国·专题练习
7 . 用尿素水解生成的 催化还原
催化还原 ,是柴油机车辆尾气净化的主要方法。反应为
,是柴油机车辆尾气净化的主要方法。反应为 ,下列说法正确的是
,下列说法正确的是
 催化还原
催化还原 ,是柴油机车辆尾气净化的主要方法。反应为
,是柴油机车辆尾气净化的主要方法。反应为 ,下列说法正确的是
,下列说法正确的是A.上述反应 |
B.上述反应平衡常数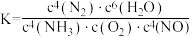 |
C.上述反应中消耗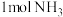 ,转移电子的数目为 ,转移电子的数目为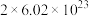 |
| D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小 |
您最近一年使用:0次
2022-07-21更新
|
8891次组卷
|
23卷引用:专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编
(已下线)专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编江苏省2022年普通高中学业水平选择性考试(已下线)2022年江苏卷高考真题变式题1-13(已下线)第20讲 化学平衡常数及转化率的计算(讲)-2023年高考化学一轮复习讲练测(新教材新高考)江苏省马坝高级中学2022-2023学年高三上学期9月份质量检测化学试题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题广东省深圳市红岭中学2022-2023学年高二上学期期中考试化学试题(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题6-10)四川省乐山市沫若中学2021-2022学年高二下学期第二次月考化学试题(已下线)专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题卷11 化学反应速率与化学平衡归因分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)四川省广元中学2022-2023学年高二下学期4月月考化学试题(已下线)题型24 单反应体系中的化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点23 化学平衡常数(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第28讲化化学平衡的移动及反应进行的方向(已下线)考点3 化学平衡常数及转化率的计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐八一中学2023-2024学年高二上学期第一次月考化学试题(已下线)题型13 化学平衡常数的计算及应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
8 . Ⅰ.某同学设计实验探究Cu与98%浓 的反应,装置如图所示,回答下列问题:
的反应,装置如图所示,回答下列问题:
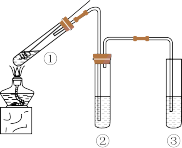
(1)试管①中发生反应的化学方程式为_______ 。
(2)试管②用来检验生成的 ,下列试剂中利用
,下列试剂中利用 的还原性进行检验的是 。
的还原性进行检验的是 。
(3)试管③中盛放______ ,用来吸收 ,防止污染空气。
,防止污染空气。
Ⅱ.如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:
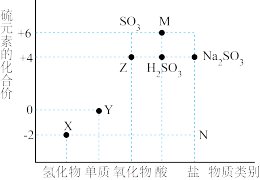
(4)将Z通入紫色石蕊溶液中,实验现象为_______ 。
(5)足量Y与1mol金属铜充分反应,转移电子的物质的量为_______ mol。
(6)将Z通入X的水溶液中,发生反应的化学方程式为_______ 。
(7)碳和M的浓溶液的反应中,氧化剂与还原剂物质的量之比为_______ 。
 的反应,装置如图所示,回答下列问题:
的反应,装置如图所示,回答下列问题:
(1)试管①中发生反应的化学方程式为
(2)试管②用来检验生成的
 ,下列试剂中利用
,下列试剂中利用 的还原性进行检验的是 。
的还原性进行检验的是 。A.酸性 | B.品红溶液 | C.溴水 | D. 溶液 溶液 |
 ,防止污染空气。
,防止污染空气。Ⅱ.如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:

(4)将Z通入紫色石蕊溶液中,实验现象为
(5)足量Y与1mol金属铜充分反应,转移电子的物质的量为
(6)将Z通入X的水溶液中,发生反应的化学方程式为
(7)碳和M的浓溶液的反应中,氧化剂与还原剂物质的量之比为
您最近一年使用:0次
名校
解题方法
9 . 下列说法正确的是
A.可利用乙醇的还原性以及 、 、 的颜色差异来检验酒后驾车 的颜色差异来检验酒后驾车 |
B.向30%的 溶液中加入 溶液中加入 可制得 可制得 , , 作氧化剂 作氧化剂 |
C. 溶液可用于蚀刻印刷电路,是因为该溶液显酸性 溶液可用于蚀刻印刷电路,是因为该溶液显酸性 |
| D.常温下,钠露置在空气中易被氧气氧化为过氧化钠,因此应保存在煤油里 |
您最近一年使用:0次
解题方法
10 . 我国提出争取在2030年前实现碳达峰,2060年实现碳中和。将二氧化碳进行捕集并转化为可利用的能源有具有划时代的意义。
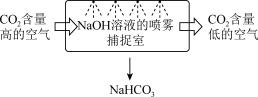
(1)下图是一种利用NaOH溶液实现“碳捕获”的技术,使用NaOH溶液喷雾捕捉 的原因是
的原因是_______ ,若实现NaOH溶液的循环利用,可采取的措施为_______ 。
(2)消防员和矿工使用的呼吸器是利用超氧化钾( )吸收
)吸收 ,若生成碳酸氢钟,则发生反应的化学方程式为
,若生成碳酸氢钟,则发生反应的化学方程式为_______ ,每吸收1mol 转移电子数为
转移电子数为_______ 。
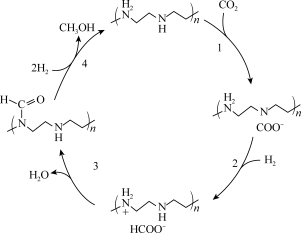
(3)下图是科学家利用石乙烯六胺来捕获 的反应机理示意图,总反应方程式为
的反应机理示意图,总反应方程式为_______ ,该反应中 表现
表现_______ 性,反应1和反应2中胺表现出_______ 性。
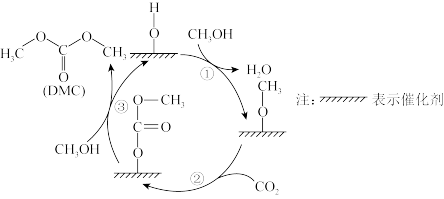
(4)我国科学家以 基做催化剂,利用
基做催化剂,利用 和
和 合成碳酸二甲酯(DMC)反应历程如图,反应①中催化剂的作用为
合成碳酸二甲酯(DMC)反应历程如图,反应①中催化剂的作用为_______ ,历程中涉及反应类型为_______ ,碳酸二甲酯(DMC)在氢氧化钠作用下发生水解的化学方程式为_______ 。
(1)下图是一种利用NaOH溶液实现“碳捕获”的技术,使用NaOH溶液喷雾捕捉
 的原因是
的原因是
(2)消防员和矿工使用的呼吸器是利用超氧化钾(
 )吸收
)吸收 ,若生成碳酸氢钟,则发生反应的化学方程式为
,若生成碳酸氢钟,则发生反应的化学方程式为 转移电子数为
转移电子数为(3)下图是科学家利用石乙烯六胺来捕获
 的反应机理示意图,总反应方程式为
的反应机理示意图,总反应方程式为 表现
表现
(4)我国科学家以
 基做催化剂,利用
基做催化剂,利用 和
和 合成碳酸二甲酯(DMC)反应历程如图,反应①中催化剂的作用为
合成碳酸二甲酯(DMC)反应历程如图,反应①中催化剂的作用为
您最近一年使用:0次



