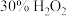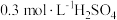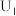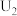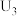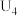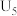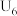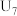解题方法
1 . 某化学兴趣小组采用次氯酸钙与稀盐酸反应制取氯气,并探究了氯气的性质。实验装置如图所示,下列说法正确的是
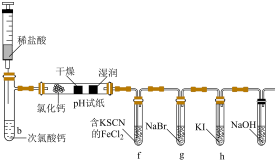
A.b试管中的离子方程式为: |
B.湿润的 试纸先变红后褪色,说明 试纸先变红后褪色,说明 有酸性,同时又有漂白性 有酸性,同时又有漂白性 |
C.f处变红,是因为 被氧化为 被氧化为 , , 遇 遇 溶液变红 溶液变红 |
D.g处变为橙色,h处变为黄色,说明氧化性: |
您最近一年使用:0次
2024-03-26更新
|
400次组卷
|
2卷引用:2024届广东省大亚湾区普通高中毕业年级高三1月份联合模拟考试(一)化学试卷
名校
解题方法
2 . 填空题
(一)某同学欲验证 与
与 的金属性强弱,设计实验如下:
的金属性强弱,设计实验如下:
依据上述实验设计,回答下列问题:
(1)铝元素在周期表中的位置为第______ 周期______ 族;
(2)上述实验试管 中的实验现象为
中的实验现象为_________________________ ;
(3)写出试管 中白色沉淀溶解的离子反应方程式
中白色沉淀溶解的离子反应方程式______________________ ;
(4)上述实验现象证明碱性:
______  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(二)某同学欲验证 、
、 、
、 的氧化性强弱,实验操作如下:
的氧化性强弱,实验操作如下:
Ⅰ.向盛有 和
和 混合液的试管
混合液的试管 中通入少量氯气,振荡观察;
中通入少量氯气,振荡观察;
Ⅱ.向盛有淀粉 混合液的试管
混合液的试管 中加入少量
中加入少量 溶液,振荡观察;
溶液,振荡观察;
(5) 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为____________
(6)试管 中通入少量氯气后的实验现象是
中通入少量氯气后的实验现象是______________________________
(7)写出试管 中发生的离子反应
中发生的离子反应______________________________
(一)某同学欲验证
 与
与 的金属性强弱,设计实验如下:
的金属性强弱,设计实验如下:实验操作 | 实验现象 | 反应或结论 |
Ⅰ.向试管 | ① |
|
Ⅱ.向试管 | 试管中先出现白色沉淀,后白色沉淀溶解 | ② |
(1)铝元素在周期表中的位置为第
(2)上述实验试管
 中的实验现象为
中的实验现象为(3)写出试管
 中白色沉淀溶解的离子反应方程式
中白色沉淀溶解的离子反应方程式(4)上述实验现象证明碱性:

 (填“>”“<”或“=”)
(填“>”“<”或“=”) (二)某同学欲验证
 、
、 、
、 的氧化性强弱,实验操作如下:
的氧化性强弱,实验操作如下:Ⅰ.向盛有
 和
和 混合液的试管
混合液的试管 中通入少量氯气,振荡观察;
中通入少量氯气,振荡观察;Ⅱ.向盛有淀粉
 混合液的试管
混合液的试管 中加入少量
中加入少量 溶液,振荡观察;
溶液,振荡观察;(5)
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(6)试管
 中通入少量氯气后的实验现象是
中通入少量氯气后的实验现象是(7)写出试管
 中发生的离子反应
中发生的离子反应
您最近一年使用:0次
名校
解题方法
3 . 下列劳动项目或生产活动与所述的化学知识没有关联的是
选项 | 劳动项目或生产活动 | 化学知识 |
A |
|
|
B | 用漂白液对环境消毒 |
|
C | 用食醋清洗水壶中的碳酸钙水垢 | 醋酸酸性比碳酸强 |
D | 用氯化铁溶液刻蚀电路板 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
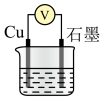
4 . 某学习小组将 与
与 的反应设计为原电池,并进行相关实验探究。回答下列问题:
的反应设计为原电池,并进行相关实验探究。回答下列问题:
I.实验准备
(1)稀 浓度的测定。
浓度的测定。
①用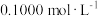 的
的 溶液滴定未知浓度的稀
溶液滴定未知浓度的稀 溶液,下列仪器需要用到的有
溶液,下列仪器需要用到的有________ 。
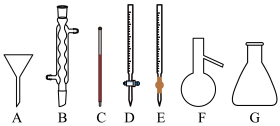
②下列操作可能造成测得 溶液浓度偏高的有:
溶液浓度偏高的有:________ 。
A.锥形瓶用待测液润洗 B.滴定前有气泡,滴定后气泡消失
C.滴定过程中用少量蒸馏水冲洗锥形瓶壁 D.滴定终点读数时俯视
(2) 在酸性条件下可溶解在
在酸性条件下可溶解在 中,反应的离子方程式为
中,反应的离子方程式为________________ 。
Ⅱ.实验探究
【实验任务】利用原电池装置探究物质氧化性或还原性强弱的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(3)利用下表所示装置进行实验1~4,记录数据。
已知:本实验条件下, 子对电压的影响可忽略。
子对电压的影响可忽略。
①根据表中信息,补充数据:
________ 。
②由实验2和4测得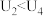 ,可得出结论
,可得出结论________________ 。
(4)由(3)中实验结果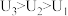 小组同学对“电压随
小组同学对“电压随 减小而增大”可能的原因,提出了以下两种猜想:
减小而增大”可能的原因,提出了以下两种猜想:
猜想1:酸性条件下, 的氧化性随
的氧化性随 减小而增强。
减小而增强。
猜想2:酸性条件下, 的还原性随
的还原性随 减小而增强。
减小而增强。
为验证猜想,小组同学在(3)中实验1~4的基础上,利用下表装置进行实验5~7,并记录数据。
实验结果为: 、
、________ ,说明猜想2不成立,猜想1成立。
【实验结论】物质的氧化性(或还原性)强弱与其浓度、 等因素有关。
等因素有关。
 与
与 的反应设计为原电池,并进行相关实验探究。回答下列问题:
的反应设计为原电池,并进行相关实验探究。回答下列问题:I.实验准备
(1)稀
 浓度的测定。
浓度的测定。①用
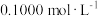 的
的 溶液滴定未知浓度的稀
溶液滴定未知浓度的稀 溶液,下列仪器需要用到的有
溶液,下列仪器需要用到的有
②下列操作可能造成测得
 溶液浓度偏高的有:
溶液浓度偏高的有:A.锥形瓶用待测液润洗 B.滴定前有气泡,滴定后气泡消失
C.滴定过程中用少量蒸馏水冲洗锥形瓶壁 D.滴定终点读数时俯视
(2)
 在酸性条件下可溶解在
在酸性条件下可溶解在 中,反应的离子方程式为
中,反应的离子方程式为Ⅱ.实验探究
【实验任务】利用原电池装置探究物质氧化性或还原性强弱的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(3)利用下表所示装置进行实验1~4,记录数据。
装置 | 实验序号 | 烧杯中所加试剂 | 电压表读数 | ||
|
|
|
| ||
|
|
| |||
1 | 20.0 | / | 10.0 |
| |
2 | 20.0 | 1.0 | 9.0 |
| |
3 | 20.0 | 2.0 |
|
| |
4 | 25.0 | 1.0 | 4.0 |
| |
 子对电压的影响可忽略。
子对电压的影响可忽略。①根据表中信息,补充数据:

②由实验2和4测得
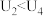 ,可得出结论
,可得出结论(4)由(3)中实验结果
 小组同学对“电压随
小组同学对“电压随 减小而增大”可能的原因,提出了以下两种猜想:
减小而增大”可能的原因,提出了以下两种猜想:猜想1:酸性条件下,
 的氧化性随
的氧化性随 减小而增强。
减小而增强。猜想2:酸性条件下,
 的还原性随
的还原性随 减小而增强。
减小而增强。为验证猜想,小组同学在(3)中实验1~4的基础上,利用下表装置进行实验5~7,并记录数据。
装置 | 实验序号 | 操作 | 电压表读数 |
 | 5 | 直接测左边装置图中的电压 |
|
6 | 向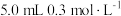  溶液。 溶液。 |
| |
7 | 向另一侧烧杯中滴加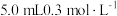  溶液。 溶液。 |
|
 、
、【实验结论】物质的氧化性(或还原性)强弱与其浓度、
 等因素有关。
等因素有关。
您最近一年使用:0次
5 . 某小组将浓盐酸和 混合加热生成氯气,发现氯气不再逸出时,固液混合物A中仍存在盐酸和
混合加热生成氯气,发现氯气不再逸出时,固液混合物A中仍存在盐酸和 ,回答下列问题。
,回答下列问题。
(1)写出反应中生成氯气的离子方程式___________ 。
(2)一个氧化还原反应包括氧化反应和还原反应两个过程(即两个半反应),第(1)题中的离子方程式可分为下面两个反应式:
i.氧化反应: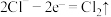
ii.还原反应:_______
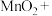 ___________
___________ ___________
___________
(3)根据两个半反应的反应式,分析A中仍存在盐酸和 的原因。
的原因。
i.随 降低,
降低, 还原性减弱
还原性减弱
ii.随 降低或
降低或 浓度升高,
浓度升高,___________ 。
(4)补充实验证实了(3)中的分析。
a是___________ ,b是___________ 。
(5)利用 浓度对
浓度对 氧化性的影响,探究同周期非金属元素阴离子的还原性。相同浓度的NaCl和
氧化性的影响,探究同周期非金属元素阴离子的还原性。相同浓度的NaCl和 溶液,能与
溶液,能与 反应所需
反应所需 较小的是
较小的是___________ 。
(6)该小组查资料得知:氧化还原反应电位传感器可以测量不同溶液的电位值。根据电位值大小可比较物质的氧化性或者还原性强弱:数值越大,氧化性越强;数值越小,还原性越强。由此推知 的以下物质溶液的电位值大小(填“<”“>”或“=”)
的以下物质溶液的电位值大小(填“<”“>”或“=”)
①KI___________ KBr
②
___________  (酸化)
(酸化)
 混合加热生成氯气,发现氯气不再逸出时,固液混合物A中仍存在盐酸和
混合加热生成氯气,发现氯气不再逸出时,固液混合物A中仍存在盐酸和 ,回答下列问题。
,回答下列问题。(1)写出反应中生成氯气的离子方程式
(2)一个氧化还原反应包括氧化反应和还原反应两个过程(即两个半反应),第(1)题中的离子方程式可分为下面两个反应式:
i.氧化反应:
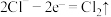
ii.还原反应:
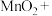 ___________
___________ ___________
___________(3)根据两个半反应的反应式,分析A中仍存在盐酸和
 的原因。
的原因。i.随
 降低,
降低, 还原性减弱
还原性减弱ii.随
 降低或
降低或 浓度升高,
浓度升高,(4)补充实验证实了(3)中的分析。
| 实验操作 | 试剂 | 产物 | |
| I | 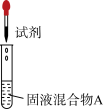 | 较浓 | 有氯气 |
| Ⅱ | a | 有氯气 | |
| Ⅲ | a和b | 无氯气 |
(5)利用
 浓度对
浓度对 氧化性的影响,探究同周期非金属元素阴离子的还原性。相同浓度的NaCl和
氧化性的影响,探究同周期非金属元素阴离子的还原性。相同浓度的NaCl和 溶液,能与
溶液,能与 反应所需
反应所需 较小的是
较小的是(6)该小组查资料得知:氧化还原反应电位传感器可以测量不同溶液的电位值。根据电位值大小可比较物质的氧化性或者还原性强弱:数值越大,氧化性越强;数值越小,还原性越强。由此推知
 的以下物质溶液的电位值大小(填“<”“>”或“=”)
的以下物质溶液的电位值大小(填“<”“>”或“=”)①KI
②

 (酸化)
(酸化)
您最近一年使用:0次
6 . 以下实验的实验过程正确并可以达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 探究 是否为电解质 是否为电解质 | 将一定量 通入蒸馏水中,测所得溶液是否导电 通入蒸馏水中,测所得溶液是否导电 |
| B | 探究 的氧化性 的氧化性 | 向盛有 稀溶液的试管中滴加3滴KI溶液,振荡后继续滴加2滴淀粉溶液,观察现象 稀溶液的试管中滴加3滴KI溶液,振荡后继续滴加2滴淀粉溶液,观察现象 |
| C | 制取纯净干燥的氢气 | 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和 溶液 溶液 |
| D | 配制浓度为 的 的 溶液 溶液 | 称取 固体 固体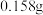 ,放入100mL容量瓶中,加水溶解并稀释至刻度 ,放入100mL容量瓶中,加水溶解并稀释至刻度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 化学是一门以实验为基础的学科。下列实验操作能达到目的的是
| 选项 | 目的 | 实验操作 |
| A | 测新制氯水的 | 取一小块试纸在玻璃片上,用洁净且干燥的玻璃棒蘸取待测液涂在试纸的中部,观察颜色并与标准比色卡对比 |
| B | 验证氧化性: | 向 溶液中加入 溶液中加入 溶液后滴加几滴淀粉溶液,溶液变为蓝色 溶液后滴加几滴淀粉溶液,溶液变为蓝色 |
| C | 验证还原性: | 将少量金属钠加入 溶液中,反应产生红色固体 溶液中,反应产生红色固体 |
| D | 证明溶液中一定含有 | 向某无色溶液中加入过量 溶液,产生白色沉淀 溶液,产生白色沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 某研究小组利用如图所示装置制备氯气,并进行Cl2、Br2、I2性质的探究。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)
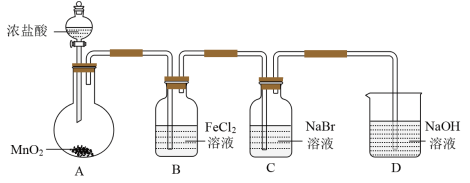
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为_______ 。
(2)B中发生反应的离子方程式为_______ 。
(3)D中发生反应的化学方程式为_______ 。
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:______
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
【分析与解释】
(5)实验1中a试管中反应的离子方程式是_______ 。
(6)通过实验1可以得出的结论是_______ 。
(7)①甲同学认为:实验2观察到_______ 现象,得出氧化性Br2>I2;
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
补做实验3的目的是_______ 。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)

(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为
(2)B中发生反应的离子方程式为
(3)D中发生反应的化学方程式为
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
| 实验1 | 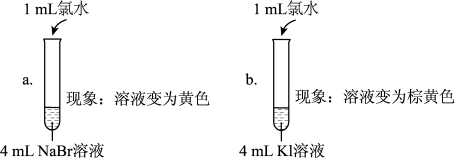 |
| 实验2 | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验1中a试管中反应的离子方程式是
(6)通过实验1可以得出的结论是
(7)①甲同学认为:实验2观察到
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
| 实验3 | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
您最近一年使用:0次
解题方法
9 . 按如图装置进行实验,将浓盐酸滴入Ⅰ中的圆底烧瓶中(已知: 和
和 溶液在加热条件下会生成
溶液在加热条件下会生成 ),下列说法不正确的是
),下列说法不正确的是
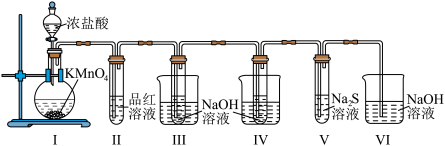
 和
和 溶液在加热条件下会生成
溶液在加热条件下会生成 ),下列说法不正确的是
),下列说法不正确的是
| A.Ⅰ中圆底烧瓶内的反应,体现了盐酸的酸性和还原性 |
| B.Ⅱ试管内的红色褪去后,再加热又恢复原来的红色 |
| C.Ⅲ和Ⅳ试管分别进行冷水浴和热水浴,反应的还原产物相同 |
D.Ⅴ试管内出现浑浊,氧化性: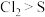 |
您最近一年使用:0次
解题方法
10 . 下列实验操作或现象与实验目的均正确且匹配的是
| 选项 | 实验操作或现象 | 实验目的 |
| A |  固体受热熔化后可以导电 固体受热熔化后可以导电 | 证明 是电解质 是电解质 |
| B | 将饱和 溶液滴入稀 溶液滴入稀 溶液 溶液 | 制备 胶体 胶体 |
| C | 用洁净的玻璃棒蘸取溶液进行焰色试验 | 检验溶液中含有 |
| D | 将铝片插入 溶液中,短时间内无明显现象 溶液中,短时间内无明显现象 | 氧化性: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-03更新
|
104次组卷
|
2卷引用:广东省深圳市罗湖区2023-2024学年高一上学期期末考试化学试题

 溶液,再逐滴滴入
溶液,再逐滴滴入 溶液,再逐滴滴入
溶液,再逐滴滴入 用作发酵粉蒸馒头
用作发酵粉蒸馒头 具有强氧化性
具有强氧化性 的还原性强于铜
的还原性强于铜