1 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)火药是中国的四大发明之一,永远值得华夏儿女骄傲,黑火药在发生爆炸时,发生如下反应: ,其中作氧化剂的是
,其中作氧化剂的是______ (填化学式,下同),被还原的是______ 。
(2)中国古代著作中有“银针验毒”的记录,其原理为 ,则X的化学式是
,则X的化学式是______ ,其中 在该反应中
在该反应中______ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)按如图所示操作,充分反应后:

①Ⅱ中发生反应的离子方程式为______ 。
②结合Ⅰ、Ⅱ实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为______ 。
(1)火药是中国的四大发明之一,永远值得华夏儿女骄傲,黑火药在发生爆炸时,发生如下反应:
 ,其中作氧化剂的是
,其中作氧化剂的是(2)中国古代著作中有“银针验毒”的记录,其原理为
 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)按如图所示操作,充分反应后:

①Ⅱ中发生反应的离子方程式为
②结合Ⅰ、Ⅱ实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近一年使用:0次
名校
解题方法
2 . 金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,·些水管的活塞会“自动”熔化,喷出水来。由一种铋矿[主要成分为 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
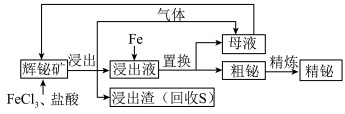
已知:酸性条件下的氧化性: 。
。
(1)“浸出”过程中,溶液中放出的气体是_________ ;放出该气体的离子方程式是________ 。
(2)加入 溶液的目的是
溶液的目的是___________ ,该反应的离子方程式是___________ 。
(3)检验母液中所含有的主要金属阳离子的方法是___________ 。
(4)铋的+5价盐类(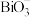 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究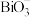 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:
据图回答下面的问题:
①上述试剂的氧化性强弱顺序为:___________ 。
②写出 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向_________ ,已知 不溶于水。)
不溶于水。)
 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
已知:酸性条件下的氧化性:
 。
。(1)“浸出”过程中,溶液中放出的气体是
(2)加入
 溶液的目的是
溶液的目的是(3)检验母液中所含有的主要金属阳离子的方法是
(4)铋的+5价盐类(
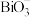 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究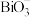 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:| 加入溶液 | ①适量铋酸钠固体 | ②过量的双氧水 | ③加入淀粉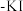 溶液 溶液 |
| 实验现象 | 溶液呈现紫红色 | 紫红色消失,产生气泡 | 溶液变为蓝色 |
①上述试剂的氧化性强弱顺序为:
②写出
 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向 不溶于水。)
不溶于水。)
您最近一年使用:0次
名校
3 . 已知:①F、 、
、 、I是同主族元素,且单质的氧化性
、I是同主族元素,且单质的氧化性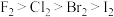 。②溴水浓度较低时呈黄色,浓度较高时呈红棕色;碘水呈棕黄色。用下图所示装置进行实验,验证卤素单质的氧化性
。②溴水浓度较低时呈黄色,浓度较高时呈红棕色;碘水呈棕黄色。用下图所示装置进行实验,验证卤素单质的氧化性 (夹持仪器已略去,气密性已检验)。
(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸;
Ⅱ.当N和P中的溶液都变为黄色时,夹紧弹簧夹;
Ⅲ.当N中溶液由黄色变为红棕色时,关闭活塞a;
Ⅳ.打开活塞b向Q中滴加P中溶液,溶液变为棕黄色,比P中溶液颜色深。
下列说法错误的是
 、
、 、I是同主族元素,且单质的氧化性
、I是同主族元素,且单质的氧化性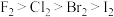 。②溴水浓度较低时呈黄色,浓度较高时呈红棕色;碘水呈棕黄色。用下图所示装置进行实验,验证卤素单质的氧化性
。②溴水浓度较低时呈黄色,浓度较高时呈红棕色;碘水呈棕黄色。用下图所示装置进行实验,验证卤素单质的氧化性 (夹持仪器已略去,气密性已检验)。
(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸;
Ⅱ.当N和P中的溶液都变为黄色时,夹紧弹簧夹;
Ⅲ.当N中溶液由黄色变为红棕色时,关闭活塞a;
Ⅳ.打开活塞b向Q中滴加P中溶液,溶液变为棕黄色,比P中溶液颜色深。
下列说法错误的是
A.实验开始时,M中湿润的淀粉 试纸变蓝 试纸变蓝 |
B.N中两次颜色变化的反应均为 |
C.若省略Ⅱ、Ⅲ,则不能说明氧化性 |
D.挥发的 气体会干扰本实验的结果和结论的得出,应改进装置 气体会干扰本实验的结果和结论的得出,应改进装置 |
您最近一年使用:0次
名校
解题方法
4 . 为了验证氧化性 ,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。

已知:
实验过程:
I.打开弹簧夹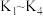 ,通入一段时间
,通入一段时间 ,再将T型导管插入B中,继续通入
,再将T型导管插入B中,继续通入 ,然后关闭
,然后关闭 、
、 、
、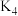 。
。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹 。
。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹 、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹
、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹 。
。
Ⅵ.更换新的试管D,重复过程Ⅳ,检验B溶液中的离子。
Ⅶ.实验结束后,打开弹簧夹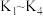 ,再通入一段时间
,再通入一段时间 ,然后拆卸,洗涤,整理仪器。
,然后拆卸,洗涤,整理仪器。
(1)A中反应的化学方程式为___________ 。
(2)棉花中浸润的溶液是___________ 。
(3)步骤Ⅲ中溶液变黄的离子方程式是___________ ,能说明氧化性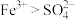 的离子方程式是
的离子方程式是___________ 。
(4)过程Ⅶ的目的是___________ 。
(5)甲、乙、丙三位同学分别完成上述实验,结论如下表所示。他们的检测结果一定能证明氧化性 的是
的是___________ (填“甲”、“乙”、“丙”)。
 ,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
已知:

实验过程:
I.打开弹簧夹
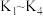 ,通入一段时间
,通入一段时间 ,再将T型导管插入B中,继续通入
,再将T型导管插入B中,继续通入 ,然后关闭
,然后关闭 、
、 、
、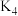 。
。Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹
 。
。Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹
 、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹
、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹 。
。Ⅵ.更换新的试管D,重复过程Ⅳ,检验B溶液中的离子。
Ⅶ.实验结束后,打开弹簧夹
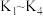 ,再通入一段时间
,再通入一段时间 ,然后拆卸,洗涤,整理仪器。
,然后拆卸,洗涤,整理仪器。(1)A中反应的化学方程式为
(2)棉花中浸润的溶液是
(3)步骤Ⅲ中溶液变黄的离子方程式是
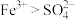 的离子方程式是
的离子方程式是(4)过程Ⅶ的目的是
(5)甲、乙、丙三位同学分别完成上述实验,结论如下表所示。他们的检测结果一定能证明氧化性
 的是
的是| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 既有 ,又有 ,又有 | 有 |
| 乙 | 有 ,无 ,无 | 有 |
| 丙 | 有 ,无 ,无 | 有 |
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.石油天然气开采和炼制过程中会产生大量含硫废水(其中S元素的主要化合价是-2价),对设备、环境等造成严重危害。已知:常温下H2S溶解度为1∶2.6(体积)。下图为常温下H2S、HS-、S2-在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:
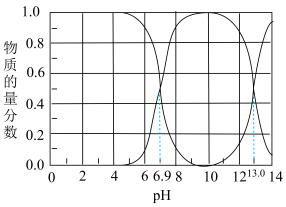
(1)由图判断,H2S的一级电离平衡常数为Ka1=___________ 。
(2)25℃,HS-电离程度小于水解程度,依据是:___________ 。
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是___________ 。
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:___________ 。
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是___________ 。
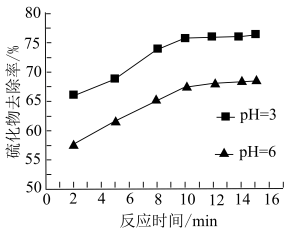
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:___________ 。
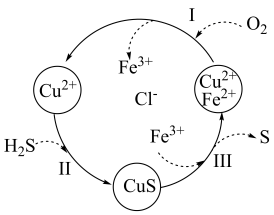
(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。
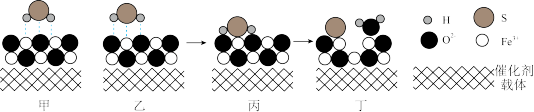
Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因___________ 。

(1)由图判断,H2S的一级电离平衡常数为Ka1=
(2)25℃,HS-电离程度小于水解程度,依据是:
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:

(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________

| A.转化过程中参与循环的离子只有Fe2+ |
| B.转化过程有四种元素的化合价发生了变化 |
| C.过程Ⅲ中发生的反应为CuS+2Fe3+=S+2Fe2++Cu2+ |
| D.氧化性由强到弱的顺序:O2 >Fe3+> S |
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。

Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因
您最近一年使用:0次
6 . 建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A.钠在氧气中燃烧,钠的氧化产物: |
B.向烧碱溶液通入 |
C.分散系的分类: |
D.FeBr2溶液中通入Cl2,铁元素存在形式(已知还原性:Fe2+>Br-):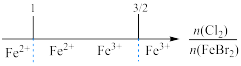 |
您最近一年使用:0次
2023-11-08更新
|
174次组卷
|
2卷引用: 四川省成都市树德中学2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
7 . 为检验某加碘食盐中是否含有 ,取相同食盐样品进行下表所示实验:
,取相同食盐样品进行下表所示实验:
已知:
下列说法中正确的是
 ,取相同食盐样品进行下表所示实验:
,取相同食盐样品进行下表所示实验:已知:

| 实验① | 实验② | 实验③ |
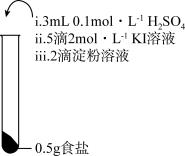 | 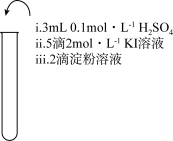 | 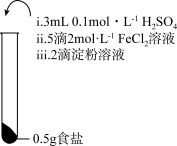 |
| 振荡,溶液迅速变为蓝色 | 振荡,一段时间后溶液变为浅蓝色 | 振荡,溶液变为浅黄色 |
A.仅由实验①就能证明食盐样品中存在 |
B.以上实验说明离子的还原性: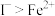 |
C.实验③能证明食盐样品中不存在 |
D.实验②中发生反应的离子方程式为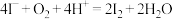 |
您最近一年使用:0次
2023-11-04更新
|
299次组卷
|
2卷引用:北京交通大学附属中学2023-2024学年高一上学期期中考试化学试题
8 . 资料显示, 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。
将等体积的 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。
实验记录如下:
(1)基态 的电子排布式
的电子排布式___________ 。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有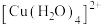 (蓝色)或
(蓝色)或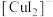 (无色),进行以下实验探究:
(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去 的原理是
的原理是___________ 。
ii.查阅资料, (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:___________ ,___________ 。
(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,___________ (填实验现象)。实验Ⅲ中铜被氧化的化学方程式是___________ 。
(4)上述实验结果, 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
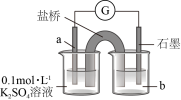
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为___________ ,b试剂为___________ 。
 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。将等体积的
 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。实验记录如下:
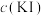 | 实验现象 | |
| 实验Ⅰ | 0.01 | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ | 0.1 | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 4 |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 的电子排布式
的电子排布式(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
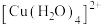 (蓝色)或
(蓝色)或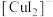 (无色),进行以下实验探究:
(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入
 ,多次萃取、分液。
,多次萃取、分液。步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去
 的原理是
的原理是ii.查阅资料,
 (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是
 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,(4)上述实验结果,
 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为
您最近一年使用:0次
2023-11-03更新
|
274次组卷
|
2卷引用:湖北省鄂东南省级示范高中教育教学改革联盟学校2023-2024学年高三上学期期中联考化学试题
9 . 某小组同学探究不同条件下氯气与二价锰化合物的反应,
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色);Mn(OH)2为不溶于水的白色固体。
(紫色);Mn(OH)2为不溶于水的白色固体。
ii.酸性条件下, 可被Cl-还原为Mn2+;浓碱条件下,
可被Cl-还原为Mn2+;浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
iii.Cl2的氧化性与溶液的酸碱性无关,Cl2与碱溶液反应可生成NaClO,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
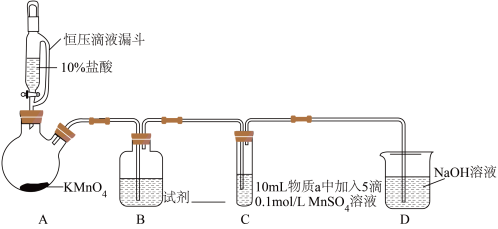
(1)A中制取Cl2的离子方程式为___________
(2)D装置的作用___________ 。
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为___________ 。
(4)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是___________ 。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二;可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①化学方程式表示可能导致溶液碱性减弱的原因___________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深,溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被NaClO氧化,可证明Ⅲ的悬浊液中氧化剂过量;
③取Ⅱ中放置后的1mL悬浊液,加入4mL水使溶液碱性减弱后,溶液紫色缓慢加深,发生的反应离子方程式是___________ 。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色);Mn(OH)2为不溶于水的白色固体。
(紫色);Mn(OH)2为不溶于水的白色固体。ii.酸性条件下,
 可被Cl-还原为Mn2+;浓碱条件下,
可被Cl-还原为Mn2+;浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。iii.Cl2的氧化性与溶液的酸碱性无关,Cl2与碱溶液反应可生成NaClO,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):

| 序号 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)D装置的作用
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为
(4)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二;可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①化学方程式表示可能导致溶液碱性减弱的原因
②取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深,溶液紫色变为绿色的离子方程式为
③取Ⅱ中放置后的1mL悬浊液,加入4mL水使溶液碱性减弱后,溶液紫色缓慢加深,发生的反应离子方程式是
您最近一年使用:0次
解题方法
10 . 铋酸钠(NaBiO3,难溶于水)是常用的氧化剂,MnO2是活性电极。以辉铋矿(主要成分为Bi2S3,含FeS2、SiO2杂质)和软锰矿(主要成分是MnO2)为原料联合焙烧制备NaBiO3和MnO2,流程如下:

已知:①金属活动性:Fe>(H)>Bi>Cu;
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1)“滤渣”的主要成分是___________ (填化学式)。
(2)“焙烧”采用逆流操作,即粉碎的矿粉从焙烧炉上部加入,空气从下部进入,这样操作的目的是___________ 。
(3)“酸浸”中产生气体X的离子方程式为___________ 。
(4)如果省略“还原”工序,其后果是___________ 。
(5)“电解”MnSO4溶液中产生一种气体,该气体是___________ (填化学式)。在碱性锌锰电池中,总反应式为Zn+2MnO2+2KOH+2H2O=2MnOOH+K2[Zn(OH)4],正极反应式为___________ 。
(6)在MnSO4溶液中加入少量NaBiO3,溶液变紫红色。由此推知,氧化性: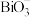
_______ (填“>”或“<”) 。
。

已知:①金属活动性:Fe>(H)>Bi>Cu;
②几种金属离子的氢氧化物沉淀pH如下:
| 金属子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 2.8 |
| Fe2+ | 6.3 | 8.3 |
| Mn2+ | 8.1 | 10.1 |
(1)“滤渣”的主要成分是
(2)“焙烧”采用逆流操作,即粉碎的矿粉从焙烧炉上部加入,空气从下部进入,这样操作的目的是
(3)“酸浸”中产生气体X的离子方程式为
(4)如果省略“还原”工序,其后果是
(5)“电解”MnSO4溶液中产生一种气体,该气体是
(6)在MnSO4溶液中加入少量NaBiO3,溶液变紫红色。由此推知,氧化性:
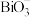
 。
。
您最近一年使用:0次



