名校
1 . 过量使用尿素[CO(NH2)2]会造成水体中氨氮(以 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法
(1)写出上述反应的离子方程式。___________ 。
(2)若收集到标况下 气体,转移电子的数目为
气体,转移电子的数目为___________ 。
(3)氨氮去除率随 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是___________ 。
(4)某废水中氨氮浓度(以 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为______ ?(写出计算过程)
 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法(1)写出上述反应的离子方程式。
(2)若收集到标况下
 气体,转移电子的数目为
气体,转移电子的数目为(3)氨氮去除率随
 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是(4)某废水中氨氮浓度(以
 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为
您最近一年使用:0次
解题方法
2 . 物质的形成与氧化还原反应的发生
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。
2.下列物质中,不可能含有离子键的是_________。
3.用化学用语表示化学方程式2Na+2H2O=2NaOH+H2↑中的相关徼粒,正确的是_________。
4.已知元素A的+1价的正离子核外没有电子,元素B的-2价的负离子的电子层结构与Ne原子相同。
①写出元素符号:A为___________ ;B为___________ 。
②A、B两元素结合成的一种常见的三原子化合物的分子式是___________ ,属于___________ 化合物。
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于___________ 选填“离子”或“共价”化合物。由此可知构成AlCl3固体的微粒是___________ 。
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目___________ ;
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是___________ 填序号,被还原的元素是___________ 填序号;
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式___________ 。
④0.3molCu被硝酸完全溶解后,被还原的硝酸是___________ mol,产生NO2气体的体积为___________ L标准状况下不考虑NO2与水的反应。
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘
 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。| A.72 | B.29 | C.53 | D.125 |
| A.CaO | B.NaOH | C.NaCl | D.HCl |
| A.中子数为12的钠原子:12Na | B.F-的结构示意图为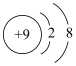 |
C.O的电子式: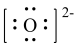 | D.NaOH中只含离子键 |
①写出元素符号:A为
②A、B两元素结合成的一种常见的三原子化合物的分子式是
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式
④0.3molCu被硝酸完全溶解后,被还原的硝酸是
您最近一年使用:0次
3 . 实验室用 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: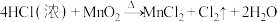
(1)该反应中被氧化的元素是___________ ,还原产物是___________ ;
(2)用单线桥标明电子转移的方向与数目___________ 。
(3)该反应中,氧化剂与还原剂的物质的量之比为___________ (前者比后者);盐酸在反应中表现出来的性质是___________ 。
(4)当生成标准状况下 时,转移的电子数目为
时,转移的电子数目为___________ ,被氧化的还原剂的物质的量为___________ 。
(5)也可以用 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:___________ 。
(6)举例说明氯气的氧化性比硫单质强,___________ 。
 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: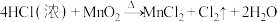
(1)该反应中被氧化的元素是
(2)用单线桥标明电子转移的方向与数目
(3)该反应中,氧化剂与还原剂的物质的量之比为
(4)当生成标准状况下
 时,转移的电子数目为
时,转移的电子数目为(5)也可以用
 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:(6)举例说明氯气的氧化性比硫单质强,
您最近一年使用:0次
解题方法
4 . 锂在电池领域的消费量最大,被称为“21世纪的能源金属”。
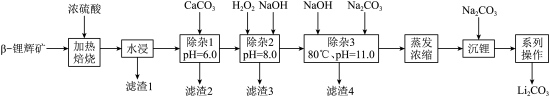
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
1.滤渣2的主要成分是_____ ,“除杂2”步骤中氧化剂和还原剂的理论物质的量之比是_____ 。
已知Li2CO3和CaCO3在不同温度下的Ksp:
2.“除杂3”步骤中,原溶液中Ca2+和Li+浓度分别为4.0×10-4mol·L-1和5.0mol·L-1.通过列式计算说明不损失Li+的情况下,Ca2+是否能除尽(工业离子除尽要求是浓度小于1.0×10-6mol·L-1)_____ 。
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为_____ 。
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.2 | 3.7 | 7.5 | 9.6 | 13.37 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 3.2 | 4.7 | 9.0 | 11.0 | — |
已知Li2CO3和CaCO3在不同温度下的Ksp:
| 20℃ | Ksp(Li2CO3)=2.5×10-2 | Ksp (CaCO3)=2.8×10-9 |
| 80℃ | Ksp (Li2CO3)=6.0×10-3 | Ksp (CaCO3)=4.0×10-9 |
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为
您最近一年使用:0次
名校
5 . 实验室里进行碘的提取,①向盛有KI(aq)的试管中加入少许CCl4后滴加氯水,振荡、静置后,CCl4层变成紫色。②分离出CCl4层,③继续向其中滴加新制氯水,充分振荡,CCl4层会逐渐变浅,最后变成无色。上层水溶液也呈无色。
(1)写出CCl4层由无色变成紫色的化学方程式:_______ 。
(2)分离出CCl4层使用的实验仪器匙:_______ 。
(3)取最终上层水溶液,滴加淀粉溶液,溶液不变蓝,说明:________ 。再经实验测定,最终碘元素以HIO3形式存在,请写出③反应的化学方程式并配平:_______ 。若使用新制氯水和淀粉溶液,请写出检验溶液中含有I-的实验过程:_______ 。
(4)向用硫酸酸化的NaI溶液中中逐滴加入NaBrO3溶液,当加入2.6molNaBrO3时,测得反应后溶液中溴元素和碘元素的存在形式及物质的量如表。
请根据氧化还原反应中化合价升高和降低的总数相等的原则,通过计算判断反应后的溶液中是否存在IO ?
?_______ 。若存在,则IO 的物质的最是多少
的物质的最是多少_______ ?写出计算过程。
(1)写出CCl4层由无色变成紫色的化学方程式:
(2)分离出CCl4层使用的实验仪器匙:
(3)取最终上层水溶液,滴加淀粉溶液,溶液不变蓝,说明:
(4)向用硫酸酸化的NaI溶液中中逐滴加入NaBrO3溶液,当加入2.6molNaBrO3时,测得反应后溶液中溴元素和碘元素的存在形式及物质的量如表。
| 粒子 | I2 | Br2 | IO |
| n/mol | 0.5 | 1.3 | 未知 |
 ?
? 的物质的最是多少
的物质的最是多少
您最近一年使用:0次
6 . 氮肥为粮食增产做出了重大贡献。目前,CO(NH2)2(尿素)是使用最多的氮肥之一。尿素进入土壤后,在脲酶作用下生成 和
和 。尿素的某些性质如下表所示。
。尿素的某些性质如下表所示。
1.尿素易溶于水,可能的原因是:尿素_______。
2.根据上表信息,使用尿素的注意事项是:_______ 。(写2点)
3. 与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测
与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测 的空间结构及其中心原子杂化轨道类型_______。
的空间结构及其中心原子杂化轨道类型_______。
4.简述检验溶液中存在 的实验操作。
的实验操作。_______ 。
过量使用尿素会造成水体中氨氮( 和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。
和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。
可利用生成沉淀去除水体中的氨氮。向酸性废水中加入适量Fe2(SO4)3溶液,氨氮转化为NH4Fe3(SO4)2(OH)6沉淀。

5.写出上述反应的离子方程式。_______ 。
6.氨氮去除率随溶液pH的变化如下图所示,分析氨氮去除率随pH增大,先升高后降低的原因。_______ 。

氧化可更彻底去除水体中的氨氮。向水体中加入NaClO溶液,氨氮被氧化为N2而除去。n(ClO–)/n(氨氮)对氨氮去除率和总氮去除率的影响如下图所示。

7.n(ClO–)/n(氨氮)较大时,氨氮去除率较高,但总氮去除率有所下降。n(ClO–)/n(氨氮)较大时,留在水体中的含氮微粒可能是_______。(不定项)
8.某废水中氨氮浓度为2800mg·L-1,先用Fe2(SO4)3溶液将氨氮转化为沉淀,氨氮去除率为81%。过滤后再向滤液中加入NaClO溶液,氨氮浓度下降为20mg·L-1,则处理每升废水需要NaClO物质的量_______ (写出计算过程)。
注:①氮元素只被氧化为N2;②废水1L,去除氨氮后溶液体积为2L。
 和
和 。尿素的某些性质如下表所示。
。尿素的某些性质如下表所示。| 熔点 | 沸点 | 溶解度(20℃) | 光稳定性 |
| 132.7℃ | 196.6℃ | 105g/100g水 | 见光易分解 |
1.尿素易溶于水,可能的原因是:尿素_______。
| A.是极性分子 | B.属于无机物 |
| C.能与水分子形成氢键 | D.分子间能形成氢键 |
3.
 与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测
与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测 的空间结构及其中心原子杂化轨道类型_______。
的空间结构及其中心原子杂化轨道类型_______。| A.平面三角形sp2杂化 | B.正四面体形sp3杂化 |
| C.三角锥形sp3杂化 | D.直线形sp杂化 |
 的实验操作。
的实验操作。过量使用尿素会造成水体中氨氮(
 和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。
和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。可利用生成沉淀去除水体中的氨氮。向酸性废水中加入适量Fe2(SO4)3溶液,氨氮转化为NH4Fe3(SO4)2(OH)6沉淀。

5.写出上述反应的离子方程式。
6.氨氮去除率随溶液pH的变化如下图所示,分析氨氮去除率随pH增大,先升高后降低的原因。

氧化可更彻底去除水体中的氨氮。向水体中加入NaClO溶液,氨氮被氧化为N2而除去。n(ClO–)/n(氨氮)对氨氮去除率和总氮去除率的影响如下图所示。

7.n(ClO–)/n(氨氮)较大时,氨氮去除率较高,但总氮去除率有所下降。n(ClO–)/n(氨氮)较大时,留在水体中的含氮微粒可能是_______。(不定项)
A. | B. | C.NO2 | D. |
注:①氮元素只被氧化为N2;②废水1L,去除氨氮后溶液体积为2L。
您最近一年使用:0次
7 . Ⅰ.卤素单质及其化合物在科研和工农业生产中有着广泛的应用。
(1)下列叙述错误 的是______
(2)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:

下列说法错误 的是______
(3)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。消毒效率常以单位质量的消毒剂得到的电子数表示,ClO2的消毒效率是Cl2的___________ 倍(保留2位小数)。
Ⅱ.氯气产量是衡量国家工业发展的一个重要指标。
(4)1774年,瑞典化学家舍勒发现软锰矿与浓盐酸混合加热,会产生一种令人感到窒息的黄绿色气体。请据此写出相关的化学反应方程式并标出电子转移的方向和数目___________ 。
Ⅲ.工业上采取电解饱和食盐水制备氯气。
(5)配制饱和食盐水的食盐必须精制,精制过程中需要除去Ca2+、Mg2+、 等杂质离子,先后加入的除杂试剂依次为
等杂质离子,先后加入的除杂试剂依次为___________ 。
(6)除去食盐水中少量的KNO3,实验步骤依次为:___________ 、___________ 、___________ 。
(7)①下图是电解饱和食盐水示意图,写出其化学反应方程式___________ 。
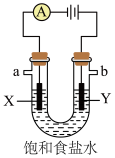
②检验Y极产物的试剂为___________ ,涉及的离子方程式为___________ 。
(1)下列叙述
| A.使用含氟牙膏能预防龋齿 | B.食盐不可作食品防腐剂 |
| C.碘酒可用于皮肤外用消毒 | D.“84”消毒液具有漂白性 |
(2)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:

下列说法
A.加入的 在还原工序中被还原 在还原工序中被还原 |
B.还原工序逸出的 可用 可用 溶液吸收 溶液吸收 |
| C.除杂工序中可用过滤操作除去产生的滤渣 |
D.中和工序中的化学反应为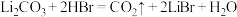 |
(3)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。消毒效率常以单位质量的消毒剂得到的电子数表示,ClO2的消毒效率是Cl2的
Ⅱ.氯气产量是衡量国家工业发展的一个重要指标。
(4)1774年,瑞典化学家舍勒发现软锰矿与浓盐酸混合加热,会产生一种令人感到窒息的黄绿色气体。请据此写出相关的化学反应方程式并标出电子转移的方向和数目
Ⅲ.工业上采取电解饱和食盐水制备氯气。
(5)配制饱和食盐水的食盐必须精制,精制过程中需要除去Ca2+、Mg2+、
 等杂质离子,先后加入的除杂试剂依次为
等杂质离子,先后加入的除杂试剂依次为(6)除去食盐水中少量的KNO3,实验步骤依次为:
(7)①下图是电解饱和食盐水示意图,写出其化学反应方程式

②检验Y极产物的试剂为
您最近一年使用:0次
解题方法
8 . “太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生H2.如常见的铁氧化物循环制氢过程如图所示。

(1)写出反应Ⅰ的化学方程式:
(2)若该反应生成标准状况下5.6 L氢气,转移电子数目为:
您最近一年使用:0次
名校
9 . 实验室制备 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: 配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目_______ 。

 与
与 用作消毒剂时均被还原为
用作消毒剂时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的_______ 倍(保留小数点后2位,消毒能力可以用氧化剂转移电子数来衡量)。
 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: 配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
 与
与 用作消毒剂时均被还原为
用作消毒剂时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的
您最近一年使用:0次
名校
10 . 氯气和一些含氯化合物常用作消毒剂。 制备流程可表述如下:
制备流程可表述如下:
① 与
与 作用生成
作用生成 ;
;
②在75℃左右, 进一步完全转化为
进一步完全转化为 ,
,
此步方程式为 (未配平)
(未配平)
(1)写出①生成 的化学方程式
的化学方程式_______ 。漂粉精久置空气中会变质,在变质过程中不会涉及的性质是_______
A. 的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
(2)若某学生在上述流程中发现某含钙离子盐的化学式为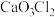 ,试根据盐的定义写出构成这种盐的酸根离子的符号
,试根据盐的定义写出构成这种盐的酸根离子的符号_______ 。
(3)若每一步反应均完全进行,且没有其他副产物,最终 与
与 的物质的量之比为
的物质的量之比为_______ 。
 制备流程可表述如下:
制备流程可表述如下:①
 与
与 作用生成
作用生成 ;
;②在75℃左右,
 进一步完全转化为
进一步完全转化为 ,
,此步方程式为
 (未配平)
(未配平)(1)写出①生成
 的化学方程式
的化学方程式A.
 的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性(2)若某学生在上述流程中发现某含钙离子盐的化学式为
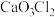 ,试根据盐的定义写出构成这种盐的酸根离子的符号
,试根据盐的定义写出构成这种盐的酸根离子的符号(3)若每一步反应均完全进行,且没有其他副产物,最终
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次



