名校
解题方法
1 . 硅及其化合物在生产生活中有重要用途。
(1)用氮化硅 陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为
陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为 。
。
① 的电子式为
的电子式为___________ 。
②若该反应转移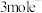 ,生成
,生成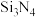 的质量为
的质量为___________ g。
(2)芯片制作中的部分流程如图: 溶液与单晶硅反应生成
溶液与单晶硅反应生成 溶液,
溶液, 溶液俗称水玻璃,水玻璃可用作
溶液俗称水玻璃,水玻璃可用作___________ 。
②扩散制结过程发生反应I. ;反应Ⅱ.
;反应Ⅱ.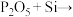
 。
。
配平反应Ⅱ.___________ 
___________ Si=___________ SiO2+___________ P,该反应的反应类型为___________ (填四大基本反应类型)。
③去除磷硅玻璃即除去扩散制结过程中产生的 ,下列试剂合适的为
,下列试剂合适的为___________ (填标号),写出其化学方程式:___________ 。
a.浓硫酸 b.氢氟酸 c.稀硝酸
(1)用氮化硅
 陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为
陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为 。
。①
 的电子式为
的电子式为②若该反应转移
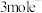 ,生成
,生成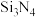 的质量为
的质量为(2)芯片制作中的部分流程如图:

 溶液与单晶硅反应生成
溶液与单晶硅反应生成 溶液,
溶液, 溶液俗称水玻璃,水玻璃可用作
溶液俗称水玻璃,水玻璃可用作②扩散制结过程发生反应I.
 ;反应Ⅱ.
;反应Ⅱ.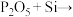
 。
。配平反应Ⅱ.

③去除磷硅玻璃即除去扩散制结过程中产生的
 ,下列试剂合适的为
,下列试剂合适的为a.浓硫酸 b.氢氟酸 c.稀硝酸
您最近一年使用:0次
2024-04-28更新
|
50次组卷
|
2卷引用:辽宁省部分高中2023-2024学年高一下学期4月月考化学试题
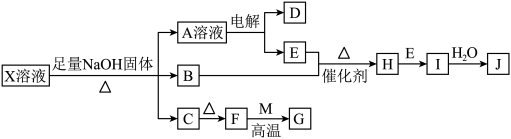
2 . 某些无机物的转化关系(部分反应物和生成物未列出)如图。已知常温常压下,M为有毒气体,D为密度最小的气体,单质E为无色气体,F可用作红色颜料,G是常见的金属单质,气体B能使湿润的红色石蕊试纸变蓝。___________ ;X溶液可以确定含有的阳离子为___________ (填离子符号)。
(2)检验NaOH中阳离子的方法为___________ 。
(3)写出B和E反应生成H的化学方程式:___________ 。
(4)B和H在一定条件下反应能生成一种单质,则该反应中氧化产物与还原产物的物质的量之比为___________ 。
(5)F→G在工业上的应用为___________ 。
(6)过量G和J的稀溶液反应的离子方程式为___________ ,该反应中J体现的性质为___________ 。
(2)检验NaOH中阳离子的方法为
(3)写出B和E反应生成H的化学方程式:
(4)B和H在一定条件下反应能生成一种单质,则该反应中氧化产物与还原产物的物质的量之比为
(5)F→G在工业上的应用为
(6)过量G和J的稀溶液反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . V2O5(五氧化二钒)可作化学工业中的催化剂。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
②部分含钒物质常温下在水中的溶解性如表所示:
③ +2OH-
+2OH-
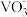 +H2O
+H2O
回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为___________ 。
(2)在第Ⅱ步中需要加入氨水,请结合 +2OH-
+2OH-
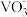 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为___________ 。
(3)需在流动空气中加热NH4VO3的原因可能是___________ 。
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___________ (保留4位有效数字)。(已知:I2+2 Na2S2O3= Na2S4O6+2NaI,写出计算过程)

②部分含钒物质常温下在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
 +2OH-
+2OH-
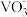 +H2O
+H2O回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为
(2)在第Ⅱ步中需要加入氨水,请结合
 +2OH-
+2OH-
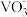 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为(3)需在流动空气中加热NH4VO3的原因可能是
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为
您最近一年使用:0次
名校
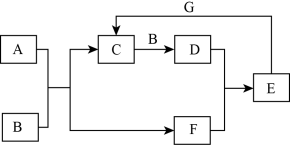
4 . 在如图所示的物质转化关系中,A是常见的气态氢化物,也是一种重要的化工产品、化工原料,B是能使带火星的木条复燃的无色、无味气体,E的相对分子质量比D的大17,合成A以及制取E的流程示意图如图所示,G是一种紫红色金属单质(反应条件和部分生成物未列出)。_______ 。
(2)反应A+B→C的化学方程式_______ 。
(3)反应E+G→C的离子反应方程式_______ 。
(4)D+F→E中氧化剂和还原剂的物质的量之比为_______ 。
(5)实验室保存E的浓溶液时用棕色试剂瓶,请用化学方程式解释原因__________ 。
(6)有一瓶稀硫酸和稀硝酸的混合溶液,其中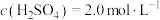 ,
,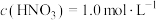 。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为
。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为_______ L。
(2)反应A+B→C的化学方程式
(3)反应E+G→C的离子反应方程式
(4)D+F→E中氧化剂和还原剂的物质的量之比为
(5)实验室保存E的浓溶液时用棕色试剂瓶,请用化学方程式解释原因
(6)有一瓶稀硫酸和稀硝酸的混合溶液,其中
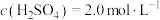 ,
,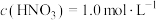 。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为
。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为
您最近一年使用:0次
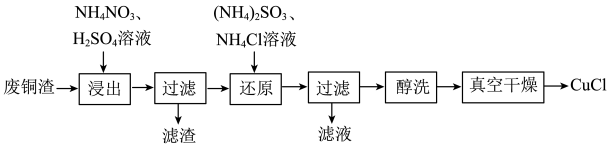
5 . 氯化亚铜(CuCl)微溶于水,难溶于乙醇,易被氧化,广泛应用于医药、有机合成催化剂等工业。以废铜渣(主要含Cu、CuO,还有少量其他难溶物)为原料制备CuCl的工艺流程如图所示。 被还原为
被还原为 ,该过程中发生氧化还原反应的离子方程式为
,该过程中发生氧化还原反应的离子方程式为____________ 。
(2)若“浸出”过程中0.2 mol 参加反应时,转移1 mol电子,则还原产物为
参加反应时,转移1 mol电子,则还原产物为______ (填化学式)。
(3)“还原”过程中逐滴加入 、
、 溶液,初始时生成沉淀反应的离子方程式是
溶液,初始时生成沉淀反应的离子方程式是____________ 。“还原”过程中 溶液加入至过量的原因:一是让
溶液加入至过量的原因:一是让 全部被还原,二是
全部被还原,二是____________ 。
(4)“还原”过程中加入 溶液的体积(V)与溶液pH的关系如图所示。
溶液的体积(V)与溶液pH的关系如图所示。 溶液体积大于一定量时,溶液pH增大的原因是
溶液体积大于一定量时,溶液pH增大的原因是____________ 。
(5)用无水乙醇洗涤CuCl的优点是____________ (填一条)。
 被还原为
被还原为 ,该过程中发生氧化还原反应的离子方程式为
,该过程中发生氧化还原反应的离子方程式为(2)若“浸出”过程中0.2 mol
 参加反应时,转移1 mol电子,则还原产物为
参加反应时,转移1 mol电子,则还原产物为(3)“还原”过程中逐滴加入
 、
、 溶液,初始时生成沉淀反应的离子方程式是
溶液,初始时生成沉淀反应的离子方程式是 溶液加入至过量的原因:一是让
溶液加入至过量的原因:一是让 全部被还原,二是
全部被还原,二是(4)“还原”过程中加入
 溶液的体积(V)与溶液pH的关系如图所示。
溶液的体积(V)与溶液pH的关系如图所示。
 溶液体积大于一定量时,溶液pH增大的原因是
溶液体积大于一定量时,溶液pH增大的原因是(5)用无水乙醇洗涤CuCl的优点是
您最近一年使用:0次
6 . 硝酸镍、硝酸钠在陶瓷、玻璃工业应用广泛。以废弃镍板(含有少量的氧化铝杂质)生产硝酸镍、硝酸钠工艺流程如下:
(1)工业生产普通玻璃的主要原料有石英砂、__________ 、__________ 。
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是__________ ;若温度太高,可能导致的后果是__________ 。
(3)假如Ni与浓硝酸反应产生的混合气体中 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)向“浸取液”中加入 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为_______ 。__________ 。
(6)向“转化器”中加入稀硝酸的目的是__________ 。
(7)已知:①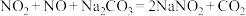 ;
;
②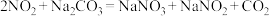 。
。
若将一定体积的 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为__________ 。

(1)工业生产普通玻璃的主要原料有石英砂、
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是
(3)假如Ni与浓硝酸反应产生的混合气体中
 ,该反应的离子方程式为
,该反应的离子方程式为(4)向“浸取液”中加入
 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为__________+
 +
+ __________
__________ +
+ _________+
_________+
 。
。
(6)向“转化器”中加入稀硝酸的目的是
(7)已知:①
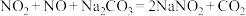 ;
;②
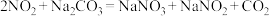 。
。若将一定体积的
 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
您最近一年使用:0次
名校
解题方法
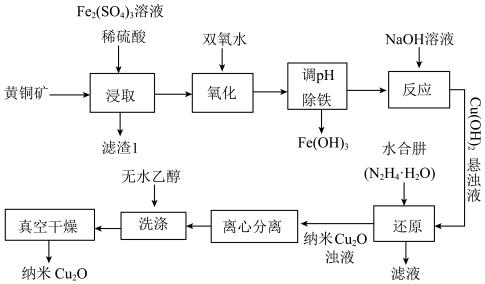
7 . 氧化亚铜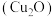 是一种半导体材料。纳米
是一种半导体材料。纳米 还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为
还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为 ,含少量
,含少量 的氧化物、
的氧化物、 等)为原料制备纳米
等)为原料制备纳米 的工艺流程如图。
的工艺流程如图。
已知: (砖)红色粉末状固体,几乎不溶于水和乙醇;
(砖)红色粉末状固体,几乎不溶于水和乙醇;
 在潮湿的空气中会慢慢氧化生成
在潮湿的空气中会慢慢氧化生成 。
。___________ 和 。
。
(2)写出浸取时发生反应的离子方程式___________ 。
(3)“还原”过程中,产生无色无味的气体。写出该过程中发生反应的化学反应方程式___________ ,每生成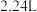 (标准状况下)
(标准状况下) ,转移电子数为
,转移电子数为___________ 。
(4)洗涤过程中,用无水乙醇洗涤的目的是___________ 。
(5)证明得到的 是纳米级微粒的具体方法是
是纳米级微粒的具体方法是___________ 。
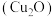 是一种半导体材料。纳米
是一种半导体材料。纳米 还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为
还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为 ,含少量
,含少量 的氧化物、
的氧化物、 等)为原料制备纳米
等)为原料制备纳米 的工艺流程如图。
的工艺流程如图。已知:
 (砖)红色粉末状固体,几乎不溶于水和乙醇;
(砖)红色粉末状固体,几乎不溶于水和乙醇; 在潮湿的空气中会慢慢氧化生成
在潮湿的空气中会慢慢氧化生成 。
。
 。
。(2)写出浸取时发生反应的离子方程式
(3)“还原”过程中,产生无色无味的气体。写出该过程中发生反应的化学反应方程式
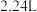 (标准状况下)
(标准状况下) ,转移电子数为
,转移电子数为(4)洗涤过程中,用无水乙醇洗涤的目的是
(5)证明得到的
 是纳米级微粒的具体方法是
是纳米级微粒的具体方法是
您最近一年使用:0次
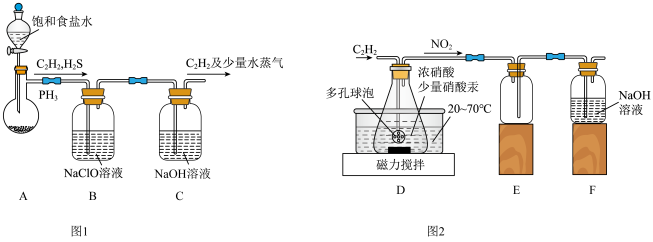
8 . 草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。___________ (写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为___________ 。该过程中,可能产生新的杂质气体Cl2,其原因是:___________ (用离子方程式回答)。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是___________ 。
②装置D中生成H2C2O4的化学方程式为___________ 。
③从装置D中得到产品,还需经过___________ (填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是___________ 。
②产品中H2C2O4·2H2O的质量分数为___________ (列出含 m、c、V 的表达式)。
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是
②装置D中生成H2C2O4的化学方程式为
③从装置D中得到产品,还需经过
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是
②产品中H2C2O4·2H2O的质量分数为
您最近一年使用:0次
名校
解题方法
9 . I.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式___________ 。
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为___________ 。
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是___________ ,其中 H2S在该反应中___________ (填序号)。
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是___________ (填“还原性”或“氧化性”)。
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:___________ 。
(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式___________ 。
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是___________ 。
(8)比较④与⑨的简单气态氢化物的稳定性___________ >___________ (填化学式)。
(9)由下列元素形成的化合物中含有离子键的是___________。
(10)写出⑤在空气中燃烧产物的电子式:___________ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:

(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是
(8)比较④与⑨的简单气态氢化物的稳定性
(9)由下列元素形成的化合物中含有离子键的是___________。
| A.①③ | B.②③ | C.①④ | D.⑥⑨ |
您最近一年使用:0次
名校
10 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。___________ (写化学式),该物质是工业制备硅的原料,写出该物质与焦炭反应制备硅的化学方程式:___________ 。
(2)FeS2在空气中煅烧的化学方程式为___________ 。
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将 转化为
转化为 外,还能
外,还能___________ 。若将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200mL FeSO4溶液和5.2g固体沉淀物。
FeSO4溶液和5.2g固体沉淀物。
①5.2g固体沉淀物的成份为___________ (写化学式)。
②原Fe2(SO4)3溶液的物质的量浓度是___________ 。(写出计算过程)
(4)检验 是否完全被还原的实验操作是
是否完全被还原的实验操作是___________ 。
(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:___________ 。
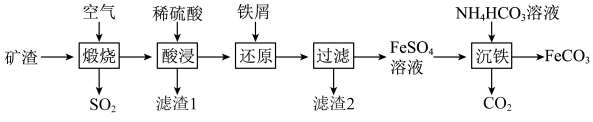
(2)FeS2在空气中煅烧的化学方程式为
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将
 转化为
转化为 外,还能
外,还能 FeSO4溶液和5.2g固体沉淀物。
FeSO4溶液和5.2g固体沉淀物。①5.2g固体沉淀物的成份为
②原Fe2(SO4)3溶液的物质的量浓度是
(4)检验
 是否完全被还原的实验操作是
是否完全被还原的实验操作是(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:
您最近一年使用:0次



