名校
解题方法
1 . 铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。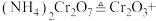
_______ +_______ 。
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___________ (列式表示)。
③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线__________________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为____________ 。
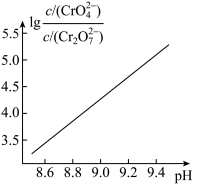
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)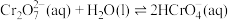
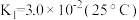
(ⅱ)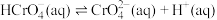

 溶液的说法正确的有
溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时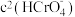 与
与 的比值保持不变
的比值保持不变
②25℃时,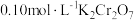 溶液中
溶液中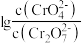 随pH的变化关系如图。当
随pH的变化关系如图。当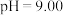 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为____________  ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度__________ (写出计算过程,结果保留两位有效数字)。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
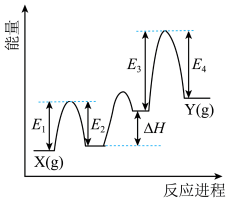
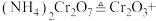
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线
(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
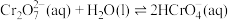
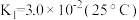
(ⅱ)
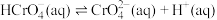

 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
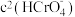 与
与 的比值保持不变
的比值保持不变②25℃时,
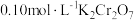 溶液中
溶液中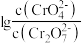 随pH的变化关系如图。当
随pH的变化关系如图。当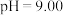 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为 ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度
您最近一年使用:0次
22-23高一下·广东深圳·期中
名校
解题方法
2 . A、B、D、E、X是原子序数依次增大的五种短周期元素。A是周期表中相对原子质量最小的元素,A、B能形成两种液态化合物 和
和 ,D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。
,D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。
(1)E在周期表中的位置是___________ ; 的电子式为
的电子式为___________ 。
(2)D、E、X的非金属性由强到弱的顺序是___________ (填元素符号);D、E、X形成的最简单离子中,离子半径由大到小的顺序是___________ (填离子符号)。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质相互反应的离子方程式为___________ 。
(4)镓( )与E为同主族元素,氮化镓(GaN)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。下列相关说法中,正确的是
)与E为同主族元素,氮化镓(GaN)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。下列相关说法中,正确的是___________ 。
A.Ga位于元素周期表的第四周期
B.GaN中Ga的化合价为+3
C. 的离子半径小于
的离子半径小于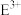 的离子半径
的离子半径
(5) 是一种高效消毒剂,工业上用其处理偏中性废救中的锰,使
是一种高效消毒剂,工业上用其处理偏中性废救中的锰,使 转化为
转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为___________ 。
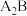 和
和 ,D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。
,D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。(1)E在周期表中的位置是
 的电子式为
的电子式为(2)D、E、X的非金属性由强到弱的顺序是
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质相互反应的离子方程式为
(4)镓(
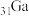 )与E为同主族元素,氮化镓(GaN)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。下列相关说法中,正确的是
)与E为同主族元素,氮化镓(GaN)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。下列相关说法中,正确的是A.Ga位于元素周期表的第四周期
B.GaN中Ga的化合价为+3
C.
 的离子半径小于
的离子半径小于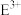 的离子半径
的离子半径(5)
 是一种高效消毒剂,工业上用其处理偏中性废救中的锰,使
是一种高效消毒剂,工业上用其处理偏中性废救中的锰,使 转化为
转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 实验室可由软锰矿(主要成分为 )制备
)制备 方法如下:
方法如下:
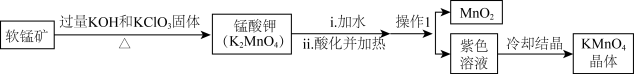
下列说法不正确的是
 )制备
)制备 方法如下:
方法如下:
下列说法不正确的是
A.软锰矿制锰酸钾时, 发生反应转移电子 发生反应转移电子 |
| B.实验室进行“操作1”时,玻璃棒的作用主要是引流 |
C.锰酸钾酸化过程氧化剂和还原剂的物质的量之比为 |
| D.酸化高锰酸钾溶液可用于消毒杀菌 |
您最近一年使用:0次
4 . 某小组同学利用以下装置制备干燥的氯气并对氯气的性质进行探究:

(1)仪器a中发生反应的化学方程式为___________ 。D中的收集装置选择___________ (填序号)。

(2)仪器b的名称为___________ 。该套实验装置存在一处明显的不足,其改进措施为___________ 。
(3)下列有关该实验的说法中不正确的是___________ (填标号)。
A.将仪器b中液体换为稀盐酸,同样可以产生大量的氯气
B.装置C中试剂是浓硫酸,目的是干燥氯气
C.装置E和F中的红色布条均不褪色
(4)用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口瓶中数据,得到如下图曲线。解释曲线中氯离子的浓度和氧气体积分数变化的原因:___________ (用离子方程式表示)。

(5)实验室还可用等物质的量的 与
与 的水溶液反应制取
的水溶液反应制取 气体,同时生成
气体,同时生成 和
和 ,反应的化学方程式为
,反应的化学方程式为___________ 。
(6)已知氯气和 溶液在一定温度下能同时发生反应:
溶液在一定温度下能同时发生反应:
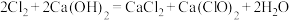

某温度下,将氯气通入Ca(OH)2溶液中,经测定 与
与 的个数比为1:1,则氯气与氢氧化钙反应时,被还原的氯原子和被氧化的氯原子的个数比为
的个数比为1:1,则氯气与氢氧化钙反应时,被还原的氯原子和被氧化的氯原子的个数比为___________ 。

(1)仪器a中发生反应的化学方程式为

(2)仪器b的名称为
(3)下列有关该实验的说法中不正确的是
A.将仪器b中液体换为稀盐酸,同样可以产生大量的氯气
B.装置C中试剂是浓硫酸,目的是干燥氯气
C.装置E和F中的红色布条均不褪色
(4)用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口瓶中数据,得到如下图曲线。解释曲线中氯离子的浓度和氧气体积分数变化的原因:

(5)实验室还可用等物质的量的
 与
与 的水溶液反应制取
的水溶液反应制取 气体,同时生成
气体,同时生成 和
和 ,反应的化学方程式为
,反应的化学方程式为(6)已知氯气和
 溶液在一定温度下能同时发生反应:
溶液在一定温度下能同时发生反应: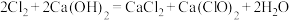

某温度下,将氯气通入Ca(OH)2溶液中,经测定
 与
与 的个数比为1:1,则氯气与氢氧化钙反应时,被还原的氯原子和被氧化的氯原子的个数比为
的个数比为1:1,则氯气与氢氧化钙反应时,被还原的氯原子和被氧化的氯原子的个数比为
您最近一年使用:0次
名校
解题方法
5 . 一种利用废旧镀锌铁皮制备磁性Fe3O4纳米粒子的工艺流程如图所示,已知锌与铝化学性质相似。下列有关说法不正确的是
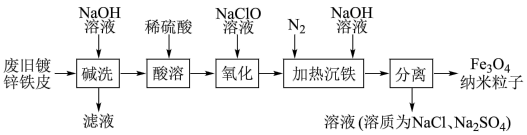

| A.用激光笔照射“加热沉铁”后所得分散系,产生丁达尔效应 |
| B.“氧化”时发生反应的离子方程式为2Fe2++ClO-+2H+=2Fe2++Cl-+H2O |
| C.“氧化”后的溶液中金属阳离子主要有Fe2+、Fe3+、Na+ |
| D.“碱洗”是为了去除废旧镀锌铁皮表面的油污 |
您最近一年使用:0次
名校
6 . 中国科学院科研团队研究表明,在常温、常压和可见光下,基于LDH(一种固体催化剂)合成 的原理示意图如图。下列说法错误的是
的原理示意图如图。下列说法错误的是
 的原理示意图如图。下列说法错误的是
的原理示意图如图。下列说法错误的是
| A.氧化剂与还原剂的物质的量之比为3∶1 |
| B.该过程中涉及极性键和非极性键的断裂与生成 |
C.上述生成 的过程属于氮的固定 的过程属于氮的固定 |
| D.原料氮气可通过分离液态空气获得 |
您最近一年使用:0次
2024-04-23更新
|
182次组卷
|
2卷引用:广东省深圳市翠园中学、龙城高级中学2023-2024学年高一下学期第一次月考化学试题
名校
7 . 三氯化六氨合钻[Co(NH3)6]Cl3是一种重要的化工原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图所示:

已知:①“酸浸”过滤后的滤液中含有Co2+、Fe2+、Fe3+、Al3+等。
②Ksp[Co(OH)2]=1×10-14.2、Ksp[Co(OH)3]=1×10-43.7、Ksp[Fe(OH)3]=1×10-37.4、Ksp[Al(OH)3]=1×10-32.9。溶液中金属离子物质的量浓度低于1.0×10-5 mol/L时,可认为沉淀完全。
③Co2+还原性较弱,但[Co(NH3)6]2+具有较强还原性。
回答下列问题:
(1)Co位于元素周期表_______ ,基态Co2+价层电子的电子排布图为_______ 。
(2)写出除杂过程中NaClO3参与反应的化学方程式_______ 。
(3)“除杂”过程中加Na2CO3调节pH后会生成两种沉淀,同时得到含c(Co2+)=0.1 mol/L的滤液,调节pH的范围为_______ 。
(4)下列说法错误的是_______。
(5)含量测定。通过碘量法可测定产品中的钻元素的含量。称取0.10 g产品加入稍过量的NaOH溶液并加热,将Co完全转化为难溶的Co(OH)3,过滤洗涤后将滤渣完全溶于硫酸中,向所得的溶液中加入过量的KI和2~3滴淀粉溶液,再用0.010 mol/L的Na2S2O3溶液滴定(反应原理:Co3++I-→Co2++I2、I2+ →I-+
→I-+ ),达到滴定终点时消耗Na2S2O3溶液24.00 mL,以下说法正确的是
),达到滴定终点时消耗Na2S2O3溶液24.00 mL,以下说法正确的是_______ 。
A.装有Na2S2O3溶液的酸式滴定管装液前要先检漏、蒸馏水洗、标准液润洗
B.滴定时要适当控制滴定速度,边滴边摇动锥形瓶(接近终点时改为滴加半滴Na2S2O3溶液),直到溶液颜色从无色变为蓝色,达到滴定终点
C.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
(6)计算产品中钴元素的含量为_______ 。(答案保留三位有效数字)

已知:①“酸浸”过滤后的滤液中含有Co2+、Fe2+、Fe3+、Al3+等。
②Ksp[Co(OH)2]=1×10-14.2、Ksp[Co(OH)3]=1×10-43.7、Ksp[Fe(OH)3]=1×10-37.4、Ksp[Al(OH)3]=1×10-32.9。溶液中金属离子物质的量浓度低于1.0×10-5 mol/L时,可认为沉淀完全。
③Co2+还原性较弱,但[Co(NH3)6]2+具有较强还原性。
回答下列问题:
(1)Co位于元素周期表
(2)写出除杂过程中NaClO3参与反应的化学方程式
(3)“除杂”过程中加Na2CO3调节pH后会生成两种沉淀,同时得到含c(Co2+)=0.1 mol/L的滤液,调节pH的范围为
(4)下列说法错误的是_______。
A.制备[Co(NH3)6]3+时,“混合”过程中加入NH4C1的作用是抑制NH3·H2O的电离,防止生成Co(OH)2沉淀,同时参与反应提供 |
| B.稳定常数是指中心原子(或离子)与配体发生反应形成配合物的平衡常数,用K稳表示,K稳值越大,表示生成的配合物越稳定。[Co(NH3)6]2+的K稳值比[Co(NH3)6]3+小 |
| C.“氧化”过程后分离提纯时,将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸的目的是:增大c(Cl-),降低[Co(NH3)6]Cl3在水中的溶解度,有利于其结晶析出 |
| D.为了得到较大颗粒的[Co(NH3)6]Cl3晶体,可采取的措施是将滤液快速冷却 |
 →I-+
→I-+ ),达到滴定终点时消耗Na2S2O3溶液24.00 mL,以下说法正确的是
),达到滴定终点时消耗Na2S2O3溶液24.00 mL,以下说法正确的是A.装有Na2S2O3溶液的酸式滴定管装液前要先检漏、蒸馏水洗、标准液润洗
B.滴定时要适当控制滴定速度,边滴边摇动锥形瓶(接近终点时改为滴加半滴Na2S2O3溶液),直到溶液颜色从无色变为蓝色,达到滴定终点
C.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
(6)计算产品中钴元素的含量为
您最近一年使用:0次
名校
8 . 为探究新制氯水的性质,某学生做了如下实验。其中说法正确的是
| 实验 | 装置 | 试剂X | 现象 |
| ① |  | 滴有酚酞的 溶液 溶液 | 溶液红色褪色 |
| ② |  溶液 溶液 | 产生气泡 | |
| ③ |  酸化的 酸化的 溶液 溶液 | 产生白色沉淀 | |
| ④ |  溶液 溶液 | 产生黄色沉淀 |
| A.实验①:氯水具有漂白性 |
B.实验②: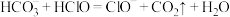 |
C.实验③:可用 溶液检验 溶液检验 中的 中的 气体 气体 |
D.实验④: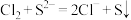 |
您最近一年使用:0次
解题方法
9 . “五步产盐法”起源于山西运城,其生产工艺主要以集卤蒸发为主,盐池的浓卤水经过箩、调配、储卤、结晶、铲出五个步骤即可得到纯度高且颗粒大的食盐.《天工开物》中也有类似描述,“凡引水种盐,春间即为之,久则水成赤色.待夏秋之交,南风大起,则一宵结成.……但成盐时日,与不借南风则大异也”.已知:
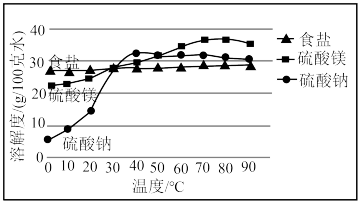
运城盐池卤水中三种主要成分溶解度随温度变化示意图
回答下列问题:
(1)为除去食盐中可能含有的少量 和
和 ,将其溶解后依次加入
,将其溶解后依次加入_________ 、 溶液后过滤,再加入适量的盐酸,蒸发结晶.
溶液后过滤,再加入适量的盐酸,蒸发结晶.
(2)运城盐池素有“夏产盐冬产硝”的说法,“夏产盐”的原理是___________________ (填操作名称,下同),“冬产硝”(主要成分为 )的原理是
)的原理是_______________ .“五步产盐法”最独特的妙处之一是在出盐前于卤水中浇洒适量淡水,由此得到的食盐晶体“质坚、粒大”且纯度较高,此法得到的食盐晶体粒大、质坚的原因是__________________________________________________ .
(3)经提纯得到的 与煤粉(主要成分为C)高温还原可制取一种重要的化工原料
与煤粉(主要成分为C)高温还原可制取一种重要的化工原料 ,同时生成无污染气体,该反应的化学方程式为
,同时生成无污染气体,该反应的化学方程式为________________________________ .
(4) 与
与 混合溶液中通入
混合溶液中通入 即可制得
即可制得 ,装置如图所示:
,装置如图所示:
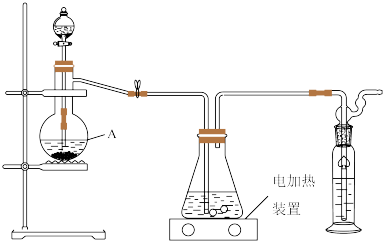
实验过程如下:打开分液漏斗活塞慢慢滴入70%的硫酸溶液,使产生的气体均匀通入 与
与 混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
①仪器A的名称是____________ .
②锥形瓶内的反应大致可分为三步进行:
第一步:
第二步:
第三步:生成 反应的化学方程式为
反应的化学方程式为_________________ ,该实验过程中 的比例太低会导致产率过低的原因是
的比例太低会导致产率过低的原因是_________________________ .

运城盐池卤水中三种主要成分溶解度随温度变化示意图
回答下列问题:
(1)为除去食盐中可能含有的少量
 和
和 ,将其溶解后依次加入
,将其溶解后依次加入 溶液后过滤,再加入适量的盐酸,蒸发结晶.
溶液后过滤,再加入适量的盐酸,蒸发结晶.(2)运城盐池素有“夏产盐冬产硝”的说法,“夏产盐”的原理是
 )的原理是
)的原理是(3)经提纯得到的
 与煤粉(主要成分为C)高温还原可制取一种重要的化工原料
与煤粉(主要成分为C)高温还原可制取一种重要的化工原料 ,同时生成无污染气体,该反应的化学方程式为
,同时生成无污染气体,该反应的化学方程式为(4)
 与
与 混合溶液中通入
混合溶液中通入 即可制得
即可制得 ,装置如图所示:
,装置如图所示:
实验过程如下:打开分液漏斗活塞慢慢滴入70%的硫酸溶液,使产生的气体均匀通入
 与
与 混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.①仪器A的名称是
②锥形瓶内的反应大致可分为三步进行:
第一步:

第二步:

第三步:生成
 反应的化学方程式为
反应的化学方程式为 的比例太低会导致产率过低的原因是
的比例太低会导致产率过低的原因是
您最近一年使用:0次
2023·福建·一模
解题方法
10 .  法常用于处理汽车尾气中的
法常用于处理汽车尾气中的 。发动机工作时在稀燃(
。发动机工作时在稀燃( 充足、燃油较少)和富燃(
充足、燃油较少)和富燃( 不足、燃油较多)条件下交替进行,通过
不足、燃油较多)条件下交替进行,通过 和
和 的相互转化实现
的相互转化实现 的储存和还原,原理如图所示。下列说法错误的是
的储存和还原,原理如图所示。下列说法错误的是

 法常用于处理汽车尾气中的
法常用于处理汽车尾气中的 。发动机工作时在稀燃(
。发动机工作时在稀燃( 充足、燃油较少)和富燃(
充足、燃油较少)和富燃( 不足、燃油较多)条件下交替进行,通过
不足、燃油较多)条件下交替进行,通过 和
和 的相互转化实现
的相互转化实现 的储存和还原,原理如图所示。下列说法错误的是
的储存和还原,原理如图所示。下列说法错误的是
A.“稀燃”过程中 表面反应: 表面反应: |
B.燃油含硫时,“稀燃”过程生成的 会使 会使 吸收 吸收 能力下降 能力下降 |
C. 吸收 吸收 的反应中,氧化剂与还原剂的物质的量之比为 的反应中,氧化剂与还原剂的物质的量之比为 |
D.“富燃”过程中 表面反应: 表面反应: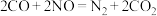 |
您最近一年使用:0次



