名校
1 . 用图所示实验装置可以完成中学化学实验中的一些实验。
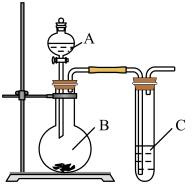
(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称________ ,A中试剂________ ,B中试剂________
②C中发生反应的化学方程式:________________________________
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入________ 溶液(填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是________________________________ ,反应完全后,将C试管加热一 段时间发生的现象是________________________
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于________ (选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有________ 溶液的洗气瓶。
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:________________________________

(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称
②C中发生反应的化学方程式:
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:
您最近一年使用:0次
2020-04-19更新
|
586次组卷
|
5卷引用:广东省揭阳市揭西县河婆中学2020-2021学年高一下学期第一次月考化学试题
2 . 请回答下列问题
(1)配平化学方程式。__ FeCl3+__ SO2+__ H2O=__ FeCl2+__ H2SO4+__ HCl。
(2)除去括号中的杂质,写出除杂反应的离子方程式
①Na2SO4溶液(Na2CO3):_______________________________________________ 。
②Ca(NO3)2溶液(CaCl2):_______________________________________________ 。
(3)写出下列反应的离子方程式:
①向烧碱溶液中通入少量CO2气体:_______________________________________________ 。
②向澄清石灰水中滴加足量的碳酸氢钠溶液:_______________________________________________ 。
(4)实验室中,制取Fe(OH)3胶体的离子方程式是_______________________________________________ ,
证明胶体已经制成的方法是_______________________________________________ 。
(1)配平化学方程式。
(2)除去括号中的杂质,写出除杂反应的离子方程式
①Na2SO4溶液(Na2CO3):
②Ca(NO3)2溶液(CaCl2):
(3)写出下列反应的离子方程式:
①向烧碱溶液中通入少量CO2气体:
②向澄清石灰水中滴加足量的碳酸氢钠溶液:
(4)实验室中,制取Fe(OH)3胶体的离子方程式是
证明胶体已经制成的方法是
您最近一年使用:0次
名校
3 . 某学习小组设计实验探究CuSO4分解产物
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。
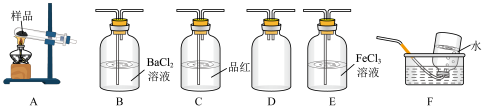
回答下列有关问题
(1)上述装置按气流从左至右排序为A、D、___________ E、F(填代号)。
(2)装置D的作用是______________________ ;能证明有SO3生成的实验现象是______________________ 。
(3)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有___________ ;待C中有明显现象后,F开始收集气体,F装置中集气瓶收集到了少量气体,该气体是___________ (填化学式)。
(4)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a.滴加少量的NH4SCN溶液 b.滴加少量的K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加盐酸酸化的BaCl2溶液
其中,方案合理的有___________ (填代号),写出E装置中可能发生反应的离子方程式:________________ 。
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)查阅资料知,铜有+2、+1价,且分解产物中不含0价的铜。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(5)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是___________ 。
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(6)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:______________ 。
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。

回答下列有关问题
(1)上述装置按气流从左至右排序为A、D、
(2)装置D的作用是
(3)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有
(4)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a.滴加少量的NH4SCN溶液 b.滴加少量的K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加盐酸酸化的BaCl2溶液
其中,方案合理的有
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)查阅资料知,铜有+2、+1价,且分解产物中不含0价的铜。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(5)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(6)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:
您最近一年使用:0次
名校
4 . 草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:探究草酸的制备
实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示:
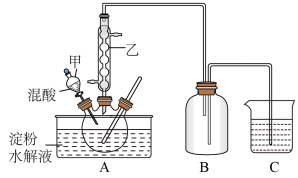
硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3 → 3H2C2O4+9NO2↑+3NO↑+9H2O。
(1)上图实验装置中仪器乙的名称为:____ ,B装置的作用______
(2)检验淀粉是否完全水解所需要的试剂为:______ 。
实验Ⅱ:探究草酸的不稳定性
已知:草酸晶体(H2C2O4·2H2O)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2。草酸的酸性比碳酸强,其钙盐难溶于水。
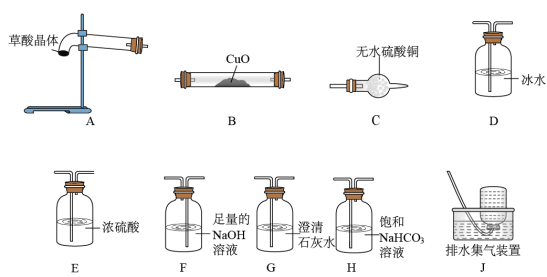
(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:A→___ →____ →____ →___ →E→B→G→____ 。
(4)若实验结束后测得B管质量减轻4.8g,则至少需分解草酸晶体的质量为_____ g(已知草酸晶体的M=126g/mol)。
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
(5)该实验中草酸表现______ 性,离子方程式_______ 该反应的反应速率先慢后快的主要原因可能是_________ 。
(6)设计实验证明草酸是弱酸。实验方案:______________ (提供的药品及仪器:蒸馏水、0.1mol·L-1NaOH溶液、pH计、0.1mol·L-1草酸溶液,其它仪器自选)
实验Ⅰ:探究草酸的制备
实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示:

硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3 → 3H2C2O4+9NO2↑+3NO↑+9H2O。
(1)上图实验装置中仪器乙的名称为:
(2)检验淀粉是否完全水解所需要的试剂为:
实验Ⅱ:探究草酸的不稳定性
已知:草酸晶体(H2C2O4·2H2O)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2。草酸的酸性比碳酸强,其钙盐难溶于水。

(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:A→
(4)若实验结束后测得B管质量减轻4.8g,则至少需分解草酸晶体的质量为
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
(5)该实验中草酸表现
(6)设计实验证明草酸是弱酸。实验方案:
您最近一年使用:0次
5 . 高铁酸盐是优良的多功能水处理剂。某实验小组采用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。
[资料]KFeO4为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为______________________ 。
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为___________ ,充分反应后得到紫色固体,反应方程式为___________ 。反应中KOH必须过量的原因是___________ 。
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用___________ 。
a.冰水b.KOH溶液c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的CN-氧化为CNO-,实验表明,pH=9时CN-去除效果最佳。配平反应离子方程式:____ FeO42-+____ CN-+____ H2O→____ Fe(OH)3↓+____ CNO-+___ OH-。
现处理含CN-离子浓度为13mg/L的废水1m3,至少需要K2FeO4___________ g。
(5)资料表明,酸性溶液中氧化性FeO42->MnO4-。验证实验:将少K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有MnO4-___________ 。
[资料]KFeO4为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用
a.冰水b.KOH溶液c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的CN-氧化为CNO-,实验表明,pH=9时CN-去除效果最佳。配平反应离子方程式:
现处理含CN-离子浓度为13mg/L的废水1m3,至少需要K2FeO4
(5)资料表明,酸性溶液中氧化性FeO42->MnO4-。验证实验:将少K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有MnO4-
您最近一年使用:0次
2019-02-27更新
|
531次组卷
|
3卷引用:【区级联考】广东省广州市天河区2019届高三毕业班综合测试(二)理科综合化学试题
【区级联考】广东省广州市天河区2019届高三毕业班综合测试(二)理科综合化学试题(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略2020届高考化学二轮复习大题精准训练 ——定性分析探究实验题
名校
解题方法
6 . (1)我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料。请用离子方程式来证明它是一种两性氧化物:___________ 、_________________ .
(2)取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁,铝的物质的量之比为___________ 。
(3)Cl2O为国际公认高效安全灭菌消毒剂,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,补充完整并配平方程式:__ Cl2+ Na2CO3+ — NaHCO3+ NaCl+ Cl2O。
(2)取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁,铝的物质的量之比为
(3)Cl2O为国际公认高效安全灭菌消毒剂,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,补充完整并配平方程式:
您最近一年使用:0次
名校
解题方法
7 . 二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________ 。
(2)滤液1中加入H2O2溶液的目的是________________________________ 。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为________________ 。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式 ___________________________________ 。
(5)由滤液2生成Ce(OH)4的离子方程式 _____________________ 。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:______________________________ ,相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________ (填“增强”或“降低”)。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是
(2)滤液1中加入H2O2溶液的目的是
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的
(5)由滤液2生成Ce(OH)4的
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:
您最近一年使用:0次
2017-09-07更新
|
531次组卷
|
2卷引用:广东省汕头市金山中学2018届高三摸底考试理科综合化学试题
名校
解题方法
8 . 从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______ (填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________ 。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为____________ 。
③步骤iv中,生成FeCO3的离子方程式是_________________ 。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________ 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________ 。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ii的离子方程式是________________ 。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:
_____________________ 。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):

回答下列问题:
①在步骤i中产生的有毒气体可能有
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为
③步骤iv中,生成FeCO3的离子方程式是
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:
您最近一年使用:0次
2017-03-13更新
|
1442次组卷
|
5卷引用:广东省汕头市潮阳实验学校2020届高三下学期3月线上统一考试理科综合化学试题
解题方法
9 .
(1)海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:

操作Ⅱ发生反应的离子方程式为____________________ ;
可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为_________________ 。
(2)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

下表为苯、溴和溴苯的相关数据:
回答下列问题:
在A中加入30.0 mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①A的容积最适合的是________ (填编号)。
a.25 mL b.50 mL c.100 mL d.250 mL
②收集溴苯时,应根据________ (填“C1”或“C2”)所显示的温度,其温度应为__________________ 。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有___________ (填化学式)。
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案________ (填“合理”或“不合理”),理由是___________________________ 。
(1)海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:

操作Ⅱ发生反应的离子方程式为
可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为
(2)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

下表为苯、溴和溴苯的相关数据:
| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在A中加入30.0 mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①A的容积最适合的是
a.25 mL b.50 mL c.100 mL d.250 mL
②收集溴苯时,应根据
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案
您最近一年使用:0次
14-15高三上·广东汕头·期末
10 . 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
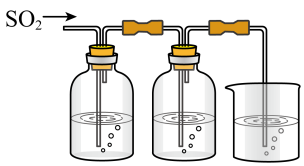
FeCl3溶液含有淀粉的碘水NaOH溶液
ABC
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在_________ 中,再加水稀释,这样操作的目的是_____________________________ 。
(2)装置C的作用是____________________________________________ 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、__________ 、自然干燥,在这一系列操作中没有用到的仪器有________________________ (填序号)。
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式_____________________________ ;
②请设计实验方案检验有Fe2+生成____________________________________ ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO 。该做法
。该做法_________ (填“合理”或“不合理”),理由是______________________ 。
(5)能表明I-的还原性弱于SO2的现象是_____________________________________________ 。

FeCl3溶液含有淀粉的碘水NaOH溶液
ABC
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在
(2)装置C的作用是
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式
②请设计实验方案检验有Fe2+生成
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO
 。该做法
。该做法(5)能表明I-的还原性弱于SO2的现象是
您最近一年使用:0次
2016-12-09更新
|
441次组卷
|
4卷引用:2014届广东省汕头市高三上学期期末考试理综化学试卷
(已下线)2014届广东省汕头市高三上学期期末考试理综化学试卷2015届甘肃省武威第五中学高三11月月考化学试卷2015届天津市河北区高三总复习质量检测一化学试卷2015届四川省德阳市高三4月模拟练习化学试卷



