名校
1 . Ⅰ.电解质溶液导电的能力的强弱主要由自由移动的离子的浓度的大小决定,离子浓度越大,导电能力越强,向一定体积的稀硫酸中逐滴加入氢氧化钡溶液,反应混合液的导电能力随时间变化的曲线如图所示。

(1)ac段发生的反应的离子方程式为:_________ 。
(2)下列说法正确的是_________。
Ⅱ. 是国际公认的高效安全杀菌消毒剂,工业制备
是国际公认的高效安全杀菌消毒剂,工业制备 的反应原理如下:
的反应原理如下:
(3)该反应中,氧化产物是_________ (填化学式),还原剂是_________ (填化学式),依据氧化还原反应规律判断,氧化性强弱为
_________  (填>、<或=)。
(填>、<或=)。
(4)亚氯酸钠 是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:

请将流程中反应①的离子方程式中所缺的物质补充完整并配平:_________ 。

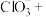

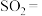


 _________
_________

(1)ac段发生的反应的离子方程式为:
(2)下列说法正确的是_________。
| A.b处溶液呈碱性,d处溶液呈酸性 |
B.c处主要成分是 和 和 |
| C.c时刻溶液的导电能力约为零,说明溶液中几乎没有自由移动的离子 |
| D.ce段溶液的导电能力不断增大,主要是由于过量的氢氧化钡电离出的离子导电 |
Ⅱ.
 是国际公认的高效安全杀菌消毒剂,工业制备
是国际公认的高效安全杀菌消毒剂,工业制备 的反应原理如下:
的反应原理如下:
(3)该反应中,氧化产物是

 (填>、<或=)。
(填>、<或=)。(4)亚氯酸钠
 是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
请将流程中反应①的离子方程式中所缺的物质补充完整并配平:

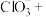

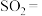


 _________
_________
您最近一年使用:0次
名校
解题方法
2 . 下列实验中,能够正确描述反应的离子方程式的是
A.磁性氧化铁溶于稀 : :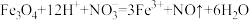 |
B.海水提溴工艺中,用纯碱溶液富集 : : |
C.用石灰乳制漂白粉: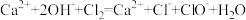 |
D.用足量 的碱性溶液除去水中的 的碱性溶液除去水中的 : :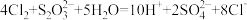 |
您最近一年使用:0次
2022-09-29更新
|
224次组卷
|
5卷引用:广东省开平市忠源纪念中学2022-2023学年高三上学期一轮复习阶段性检测化学试题
名校
3 . 铁与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图所示,下列说法错误的是
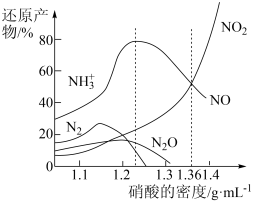
| A.其他条件相同,铁与足量密度为1.23g/mL的硝酸反应,还原产物主要为NO |
| B.一定量的铁粉与足量密度为1.36g/mL的HNO3反应,得到气体2.24L(标准状况),则参加反应的硝酸的物质的量为0.3mol |
| C.足量铁与一定量密度为1.36g/mL的硝酸反应,反应的化学方程式始终为:2Fe+6HNO3=2Fe(NO3)2+NO↑+NO2↑+3H2O |
| D.硝酸的密度越大,其还原产物中高价态的成分所占比例越多 |
您最近一年使用:0次
2022-04-21更新
|
1072次组卷
|
7卷引用:广东省江门市第一中学2023-2024学年高一下学期第一次段考化学试题
名校
4 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,以下是氯元素的“价类二维图”的部分信息。请回答下列问题:

(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。
(2)已知高氯酸( )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式_______ 。
(3)氯气既有氧化性又有还原性,结合上图说明理由_______ 
(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式_______ ,该反应中盐酸表现_______ (填字母)。
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为 ,下列有关该反应说法
,下列有关该反应说法不正确 的是_______。
(6)某游泳池常用 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式_______ 。

(1)根据图中信息写出Y、Z的化学式
(2)已知高氯酸(
 )是强酸,写出高氯酸与铁反应的离子方程式
)是强酸,写出高氯酸与铁反应的离子方程式(3)氯气既有氧化性又有还原性,结合上图说明理由

(4)实验室可用二氧化锰与浓盐酸在加热条件下制得氯气。写出该反应的化学方程式
A.酸性 B.氧化性 C.还原性 D. 挥发性
(5)84消毒液使用说明中特别提醒不可与洁厕灵混合使用,否则会产生氯气,有关反应方程式为
 ,下列有关该反应说法
,下列有关该反应说法| A.n(氧化剂):n(还原剂)=1:1 | B.n(氧化剂):n(还原剂)=1:2 |
C.氧化性: | D. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
 来抑制藻类生长,工作人员一次错用
来抑制藻类生长,工作人员一次错用 消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了
消毒,因两种物质相互反应,使游泳池的藻类疯长。已知该反应产生了 和
和 ,写出相应的化学方程式
,写出相应的化学方程式
您最近一年使用:0次
2022-03-20更新
|
1095次组卷
|
3卷引用:广东省江门市第二中学2022-2023学年高一上学期期中考试化学试题
广东省江门市第二中学2022-2023学年高一上学期期中考试化学试题河北省三河市第二中学2021-2022学年高一上学期期末考试化学试题(已下线)第二章《 海水中的重要元素----钠和氯》基础过关单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
名校
5 . 钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示,下列说法不正确的是
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O→Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O→Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
| A.碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |
| B.反应①、②是氧化还原反应,③不是氧化还原反应 |
| C.反应②配平后,H2O的化学计量数是6 |
| D.整个反应过程中,每有16.8gFe参加反应转移0.8mol电子 |
您最近一年使用:0次
2022-02-24更新
|
314次组卷
|
4卷引用:广东省江门市广雅中学2023-2024学年高一上学期12月月考化学试题B卷
广东省江门市广雅中学2023-2024学年高一上学期12月月考化学试题B卷广东省东莞市东华高级中学2021-2022学年高一上学期期末考试化学试题(已下线)1.3.3 氧化还原反应方程式配平(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)广东省汕头市潮阳实验学校2023-2024学年高一上学期第二次月考化学试题
名校
6 . 氮化镓(GaN)是支撑5G、人工智能、工业互联网等“新基建”的核心材料,以氮化镓和碳化硅(SiC)为首的第三代半导体及以氧化镓和金刚石为代表的第四代半导体材料,近年来愈发受到关注。
(1)金刚石、石墨、C60都是碳元素形成的几种性质不同的单质,互称___ 。
(2)GaN是由Ga3+和___ 构成,写出Ga的氧化物化学式___ 。
(3)利用金属Ga与氨气(NH3)在高温的环境中可制得GaN和H2,化学方程式为___ 。
(4)镓和铝的性质相似。如图是描述金属镓和稀硫酸反应的微观示意图,请仿照图中信息补充完整生成物的微观示意图,并作必要的标注___ 。

(1)金刚石、石墨、C60都是碳元素形成的几种性质不同的单质,互称
(2)GaN是由Ga3+和
(3)利用金属Ga与氨气(NH3)在高温的环境中可制得GaN和H2,化学方程式为
(4)镓和铝的性质相似。如图是描述金属镓和稀硫酸反应的微观示意图,请仿照图中信息补充完整生成物的微观示意图,并作必要的标注

您最近一年使用:0次
名校
7 . 在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成球。冷定毁罐取出。……即倭铅也。……以其似铅而性猛,故名之曰‘倭’云。”(注:炉甘石的主要成分是碳酸锌。)
(1)请完成上述火法炼锌反应的化学方程式:ZnCO3+ _______ _______ + _______ CO↑
_______ + _______ CO↑
_______
(2)在该反应中,还原剂是_______ (填化学式,下同),被还原的是_______ 。
(1)请完成上述火法炼锌反应的化学方程式:ZnCO3+ _______
 _______ + _______ CO↑
_______ + _______ CO↑(2)在该反应中,还原剂是
您最近一年使用:0次
2021-10-25更新
|
913次组卷
|
5卷引用:广东省江门市新会陈经纶中学2020-2021学年高一上学期期中考试化学试题
广东省江门市新会陈经纶中学2020-2021学年高一上学期期中考试化学试题甘肃省庆阳市第六中学2021-2022学年高一上学期第一次月考化学试题人教2019版必修第一册课后习题 第一章 物质及其变化复习与提高(已下线)第04练 第一章章末质量检测-2022年【寒假分层作业】高一化学(人教版2019)北京市第八中学2023-2024学年高一上学期11月期中考试化学试题
名校
8 . 把图b的碎纸片补充到图a中,可得到一个完整的离子方程式。下列有关该离子方程式的说法正确的是
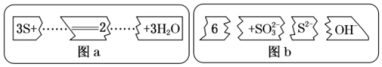

| A.配平后的化学计量数依次为3、1、2、6、3 |
| B.若有1 mol S被氧化,则生成2 mol S2- |
| C.氧化剂与还原剂的物质的量之比为1:2 |
| D.3mol S参加反应有8mol电子发生转移 |
您最近一年使用:0次
2021-09-09更新
|
152次组卷
|
3卷引用:广东省江门市第二中学2021-2022学年高一上学期第一次月考化学试题
广东省江门市第二中学2021-2022学年高一上学期第一次月考化学试题安徽省滁州市定远育才学校2021-2022学年高二上学期开学摸底考试化学试题(已下线)4.2.2 氧化还原反应的配平-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)
名校
9 . 工业上,可用活性炭法还原氮氧化物,其主要原理为C(s)+2NO(g) N2(g)+CO2(g),以降低氮氧化物对环境的污染。根据相关信息,回答下面问题:
N2(g)+CO2(g),以降低氮氧化物对环境的污染。根据相关信息,回答下面问题:
(1)在实验室中,通常用铜和稀硝酸反应来制备一氧化氮。完成该反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+___________ ,最合理的收集NO的装置为___________ 。(填字母)

(2)谚语“雷雨发庄稼”是指打雷放电时,空气的中N2可转化为NO,其反应的方程式为___________ 。
(3)在密闭容器中充入一定量活性炭和NO,发生反应:C(s)+2NO (g) N2(g)+CO2(g)。在 T1℃时,反应进行到不同时间测得各物质的浓度(mol•L-1)如表所示:
N2(g)+CO2(g)。在 T1℃时,反应进行到不同时间测得各物质的浓度(mol•L-1)如表所示:
①反应在 ___________ 分钟,该反应达到平衡状态。
②10min内该反应的平均反应速率v(CO2)=___________ mol•L-1•min-1。
 N2(g)+CO2(g),以降低氮氧化物对环境的污染。根据相关信息,回答下面问题:
N2(g)+CO2(g),以降低氮氧化物对环境的污染。根据相关信息,回答下面问题:(1)在实验室中,通常用铜和稀硝酸反应来制备一氧化氮。完成该反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+

(2)谚语“雷雨发庄稼”是指打雷放电时,空气的中N2可转化为NO,其反应的方程式为
(3)在密闭容器中充入一定量活性炭和NO,发生反应:C(s)+2NO (g)
 N2(g)+CO2(g)。在 T1℃时,反应进行到不同时间测得各物质的浓度(mol•L-1)如表所示:
N2(g)+CO2(g)。在 T1℃时,反应进行到不同时间测得各物质的浓度(mol•L-1)如表所示: 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.40 | 0.40 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.30 | 0.30 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.30 | 0.30 |
②10min内该反应的平均反应速率v(CO2)=
您最近一年使用:0次
名校
解题方法
10 . 已知实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:
(1)该反应中氧化剂是__________ (填化学式,下同),被氧化的元素是_______ 元素,氧化产物是__________ 。
(2)若反应中生成1mol Cl2,则转移的电子为_____ mol。
(3)用单线桥法表示电子转移的方向和数目:_______________ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)有一种“地康法”制取氯气的反应原理如下所示:
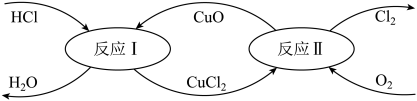
反应Ⅰ:CuO + 2HCl=CuCl2 + H2O
反应Ⅱ:2CuCl2 + O2 =2CuO + 2Cl2
①反应Ⅰ的离子方程式为______________________________________________________ 。
②反应Ⅱ属于____________ 反应。(填四种基本反应类型之一)
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:____________________________________________________ 。
 MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:(1)该反应中氧化剂是
(2)若反应中生成1mol Cl2,则转移的电子为
(3)用单线桥法表示电子转移的方向和数目:
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(4)有一种“地康法”制取氯气的反应原理如下所示:

反应Ⅰ:CuO + 2HCl=CuCl2 + H2O
反应Ⅱ:2CuCl2 + O2 =2CuO + 2Cl2
①反应Ⅰ的离子方程式为
②反应Ⅱ属于
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:
您最近一年使用:0次
2020-10-21更新
|
233次组卷
|
2卷引用:广东省江门市第二中学2020-2021学年高一上学期第一次月考化学试题



