1 . NaHSO3是常见的亚硫酸盐,在潮湿的空气中易被氧化,在工业生产和实验室都有着广泛的应用。为探究NaHSO3溶液的性质,甲同学配制了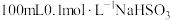 溶液。做了如下实验:
溶液。做了如下实验:
(1)配制溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、_____ 、_____ 。
(2)常温下,用pH计测量新配制的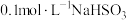 溶液的pH,测得pH约为4.1。
溶液的pH,测得pH约为4.1。
①若在实验室用pH试纸测量溶液的pH,其简单操作为_____ 。
②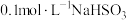 溶液呈酸性,说明H2SO3的第二步电离常数Ka2
溶液呈酸性,说明H2SO3的第二步电离常数Ka2_____ (填“>”、“<”或“=”) 的第二步水解常数
的第二步水解常数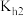 。
。
(3)将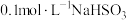 溶液与
溶液与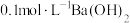 溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:
溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:_____ 。
探究白色沉淀的成分:
提出猜想:
a.只有BaSO3 b.只有BaSO4 c._____
验证猜想:
乙同学认为猜想b不正确,原因为_____
将白色沉淀加入足量盐酸中,若有气泡生成,且沉淀全部溶解,证明猜想a正确;若_____ ,证明猜想c正确。
(4)将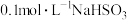 溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:_____ 。该现象说明NaHSO3溶液具有_____ (填“氧化性”、“还原性”或“氧化性和还原性”)。
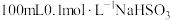 溶液。做了如下实验:
溶液。做了如下实验:(1)配制溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、
(2)常温下,用pH计测量新配制的
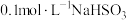 溶液的pH,测得pH约为4.1。
溶液的pH,测得pH约为4.1。①若在实验室用pH试纸测量溶液的pH,其简单操作为
②
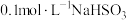 溶液呈酸性,说明H2SO3的第二步电离常数Ka2
溶液呈酸性,说明H2SO3的第二步电离常数Ka2 的第二步水解常数
的第二步水解常数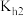 。
。(3)将
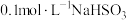 溶液与
溶液与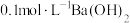 溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:
溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:探究白色沉淀的成分:
提出猜想:
a.只有BaSO3 b.只有BaSO4 c.
验证猜想:
乙同学认为猜想b不正确,原因为
将白色沉淀加入足量盐酸中,若有气泡生成,且沉淀全部溶解,证明猜想a正确;若
(4)将
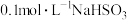 溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
您最近一年使用:0次
2023-10-02更新
|
96次组卷
|
2卷引用:广东省江门市2024届高三上学期9月金太阳联考化学试题
名校
2 . 铁元素存在多种价态,且不同价态的铁元素在一定条件下可以相互转化。回答下列问题:
(1)基态Fe3+的简化电子排布式为_____
(2)向2mL 1mol/L的Fe(NO3)2,溶液中加入2mol/L的H2SO4溶液至Fe2+恰好转化为Fe3+,该反应的离子方程式为:_____
(3)K2FeO4是新型水处理剂,将KOH溶液、KClO溶液与Fe2(SO4)3溶液混合可得到K2FeO4。K2FeO4中铁元素的化合价为:_____ ,该反应的离子方程式为:_____ ,当有3mol K2FeO4生成时,反应中转移电子的数目为:_____ NA。
(4)某同学设计如图装置制备一定量的Fe(OH)2,并使其能在较长时间内存在。

①仪器X的名称是:_____ ,装置3的作用是_____ 。
②实验开始时,开关K2应_____ (填“打开”或“关闭”),这样操作的目的是_____ 。
(1)基态Fe3+的简化电子排布式为
(2)向2mL 1mol/L的Fe(NO3)2,溶液中加入2mol/L的H2SO4溶液至Fe2+恰好转化为Fe3+,该反应的离子方程式为:
(3)K2FeO4是新型水处理剂,将KOH溶液、KClO溶液与Fe2(SO4)3溶液混合可得到K2FeO4。K2FeO4中铁元素的化合价为:
(4)某同学设计如图装置制备一定量的Fe(OH)2,并使其能在较长时间内存在。

①仪器X的名称是:
②实验开始时,开关K2应
您最近一年使用:0次
名校
3 . 下列变化对应的离子方程式正确的是
A.室温下用稀硝酸溶解铜: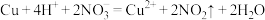 |
B.碘化亚铁溶液中滴加少量稀硝酸: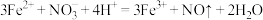 |
C.用漂白粉溶液脱除废气中的少量SO2: |
D.硅酸钠溶液通入过量CO2: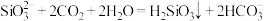 |
您最近一年使用:0次
名校
解题方法
4 . 铁及其化合物在生产生活中有着广泛的用途。
(1)纳米零价铁可用于去除水体中的硝酸盐等污染物。
①完成制备纳米零价铁的化学方程式: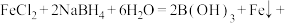
______ 。
②相同条件下,向水样Ⅰ和Ⅱ(含少量( )中分别加入等量纳米铁粉,水样中
)中分别加入等量纳米铁粉,水样中 随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是______ 。
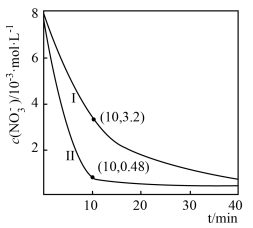
③在0~10 min内,Ⅱ中 的平均反应速率为
的平均反应速率为______ 。
(2)KSCN溶液可检验水样中的 .发生的反应为
.发生的反应为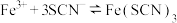 ,下列有关该反应说法正确的有______。(填标号)。
,下列有关该反应说法正确的有______。(填标号)。
(3)邻苯二酚类配体(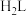 )与
)与 形成的配合物可应用于医药、水处理和材料等研究领域。某
形成的配合物可应用于医药、水处理和材料等研究领域。某 溶液体系中含铁元素的微粒组分为
溶液体系中含铁元素的微粒组分为 、
、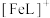 、
、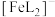 、
、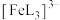 、
、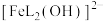 。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
已知: 及
及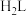 的起始浓度分别为
的起始浓度分别为 mol⋅L
mol⋅L ,
,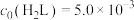 mol⋅L
mol⋅L 。
。
常温下,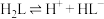
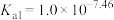 ,
,
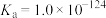 。
。
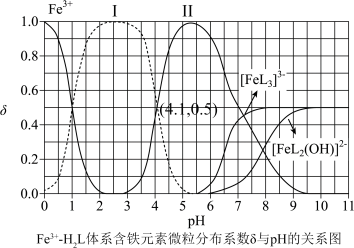
①苯酚酸性比邻甲基苯酚______ (填“强”“弱”或“无法判断”),邻苯二酚的熔点比对苯二酚低的原因为______ 。
②图中代表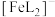 的曲线是
的曲线是______ (填“Ⅰ”或“Ⅱ”)。计算该温度下溶液中反应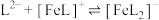 的平衡常数
的平衡常数
______ (写出计算过程)。
(1)纳米零价铁可用于去除水体中的硝酸盐等污染物。
①完成制备纳米零价铁的化学方程式:
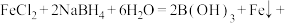
②相同条件下,向水样Ⅰ和Ⅱ(含少量(
 )中分别加入等量纳米铁粉,水样中
)中分别加入等量纳米铁粉,水样中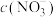 随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
③在0~10 min内,Ⅱ中
 的平均反应速率为
的平均反应速率为(2)KSCN溶液可检验水样中的
 .发生的反应为
.发生的反应为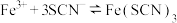 ,下列有关该反应说法正确的有______。(填标号)。
,下列有关该反应说法正确的有______。(填标号)。| A.增大KSCN溶液的浓度,平衡常数增大 |
B.加入少量铁粉,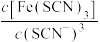 减小 减小 |
| C.加水稀释,平衡向左移动,溶液颜色变浅 |
D.加入少量 固体,平衡向右移动 固体,平衡向右移动 |
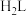 )与
)与 形成的配合物可应用于医药、水处理和材料等研究领域。某
形成的配合物可应用于医药、水处理和材料等研究领域。某 溶液体系中含铁元素的微粒组分为
溶液体系中含铁元素的微粒组分为 、
、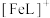 、
、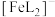 、
、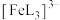 、
、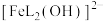 。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。已知:
 及
及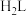 的起始浓度分别为
的起始浓度分别为 mol⋅L
mol⋅L ,
,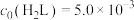 mol⋅L
mol⋅L 。
。常温下,
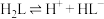
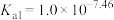 ,
,
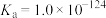 。
。
①苯酚酸性比邻甲基苯酚
②图中代表
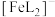 的曲线是
的曲线是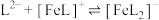 的平衡常数
的平衡常数
您最近一年使用:0次
2023-09-08更新
|
437次组卷
|
3卷引用:广东省江门市新会第一中学2023-2024学年高三上学期期中考试化学试题
5 . 镓(Ga)是一种重要的稀散金属,广泛应用于半导体制造行业。一种从黄磷电尘灰[主要含Ga2O3、ZnO、PbO、Al2O3、MgO、Ca5(PO4)3OH、SiO2]中回收镓并分离特定金属的工艺路线如图所示:
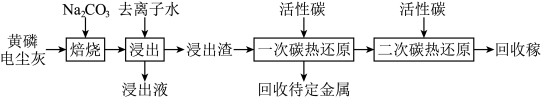
请回答下列问题:
(1)Ga是与Al同主族的第四周期元素,其价电子排布式为______ :
(2)“焙烧”过程中,Ca5(PO4)3OH转化为可溶性的Na3PO4,SiO2与Na2CO3反应生成可溶性钠盐。
①为使焙烧充分,可采取的措施是______ (写一点)。
②写出SiO2与Na2CO3反应的化学方程式__________________ 。
(3)“浸出”时,浸出液中溶质转化为Na2HPO4和NaOH的离子方程式为____________ 。Na2HPO4和NaOH的溶解度曲线如图所示,不考虑其他溶质,将浸出液蒸发浓缩、冷却结晶,先析出的物质是______ (填化学式)。

(4)“碳热还原”时,活性炭将金属氧化物还原为相应的金属单质。反应过程中,相关金属在不同压强下的起始生成温度和沸点如下表所示:
①“一次碳热还原”和“二次碳热还原”是反应温度不同的两步反应。从促进反应发生和实现工序目的的角度出发,“一次碳热还原”时,下列反应条件中最合理的是______ (填标号)。
A.1173K、10Pa B.1173K、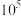 Pa C.1473K、10Pa D.1473K、
Pa C.1473K、10Pa D.1473K、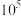 Pa
Pa
②“二次碳热还原”中,少量副产物Ga2O与产物Ga一起挥发出来。冷凝时(惰性气体作保护气),在产物Ga中检测出少量的Ga2O3,可能的原因是__________________ (用化学方程式表示)。
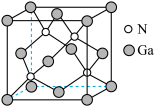
(5)氮化镓是用于高科技领域的半导体材料,其立方晶胞结构如图所示,晶胞参数为a nm。Ga的配位数为______ ,两个氮原子间的最近距离是______ nm。氮化镓的晶胞密度为______ g·cm (列出计算式即可,
(列出计算式即可, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

请回答下列问题:
(1)Ga是与Al同主族的第四周期元素,其价电子排布式为
(2)“焙烧”过程中,Ca5(PO4)3OH转化为可溶性的Na3PO4,SiO2与Na2CO3反应生成可溶性钠盐。
①为使焙烧充分,可采取的措施是
②写出SiO2与Na2CO3反应的化学方程式
(3)“浸出”时,浸出液中溶质转化为Na2HPO4和NaOH的离子方程式为

(4)“碳热还原”时,活性炭将金属氧化物还原为相应的金属单质。反应过程中,相关金属在不同压强下的起始生成温度和沸点如下表所示:
| 压强/Pa | 起始生成温度/K | 金属沸点/K | ||||||||
| Zn | Pb | Al | Mg | Ga | Zn | Pb | Al | Mg | Ga | |
| 10 | 784 | 657 | >1473 | >1473 | 918 | 681 | 1110 | 1566 | 783 | 1453 |
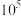 | 1223 | 1038 | >1473 | >1473 | 1284 | 1180 | 2013 | 2600 | 1380 | 2676 |
A.1173K、10Pa B.1173K、
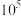 Pa C.1473K、10Pa D.1473K、
Pa C.1473K、10Pa D.1473K、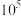 Pa
Pa②“二次碳热还原”中,少量副产物Ga2O与产物Ga一起挥发出来。冷凝时(惰性气体作保护气),在产物Ga中检测出少量的Ga2O3,可能的原因是
(5)氮化镓是用于高科技领域的半导体材料,其立方晶胞结构如图所示,晶胞参数为a nm。Ga的配位数为
 (列出计算式即可,
(列出计算式即可, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-09-08更新
|
364次组卷
|
3卷引用:广东省江门市新会第一中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
6 . 氯化钴(CoCl2)在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。某钴矿石的主要成分包括CoO、MnO、Fe2O3和SiO2。由该矿石制CoCl2∙6H2O固体的方法如图(部分分离操作省略):
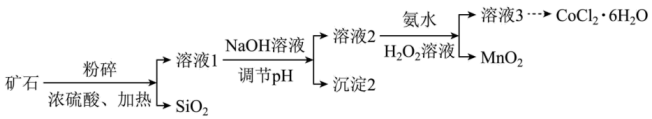
资料:Mn2+生成Mn(OH)2,开始沉淀时pH=8.2,完全沉淀时pH=10.2。
(1)上述矿石溶解过程中,能够加快化学反应速率的措施有_____ (写出一条即可)。
(2)CoO溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括H+、Mn2+和_____ 。
(3)调节溶液的pH至2.8时,得到的沉淀2是_____ 。
(4)溶液2中含有Co2+和Mn2+。
ⅰ.已知:25℃时Ksp[Co(OH)2]≈1×10−15,当c(Co2+)≤1×10−5 mol∙L−1时可认为Co2+完全沉淀。若向溶液2中加入碱溶液,常温下,当pH=_____ 时,Co2+完全沉淀。由此可知,通过调节pH无法将Mn2+和Co2+完全分离。
ⅱ.溶液2中加入氨水和H2O2溶液,发生的反应为:_____ 。(完成离子方程式)
______Mn2++______H2O2+______NH3∙H2O=______+______NH +______
+______

资料:Mn2+生成Mn(OH)2,开始沉淀时pH=8.2,完全沉淀时pH=10.2。
(1)上述矿石溶解过程中,能够加快化学反应速率的措施有
(2)CoO溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括H+、Mn2+和
(3)调节溶液的pH至2.8时,得到的沉淀2是
(4)溶液2中含有Co2+和Mn2+。
ⅰ.已知:25℃时Ksp[Co(OH)2]≈1×10−15,当c(Co2+)≤1×10−5 mol∙L−1时可认为Co2+完全沉淀。若向溶液2中加入碱溶液,常温下,当pH=
ⅱ.溶液2中加入氨水和H2O2溶液,发生的反应为:
______Mn2++______H2O2+______NH3∙H2O=______+______NH
 +______
+______
您最近一年使用:0次
名校
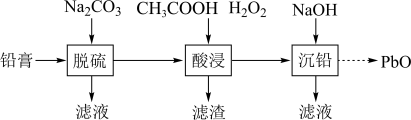
7 . 废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量BaSO4、Fe2O3、Al2O3等。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。
已知:i.一些难溶电解质的溶度积常数如表:
ii.浓度为0.1mol•L-1的一些金属离子生成氢氧化物沉淀时的pH如表:
回答下列问题:
(1)在“脱硫”中,PbSO4发生转化反应的离子方程式为______ 。
(2)在“酸浸”中,除加入CH3COOH,还要加入H2O2。
①H2O2除了能将Fe(II)转化为Fe(III),还能促进金属Pb在醋酸中转化为(CH3COO)2Pb溶液。H2O2在反应中表现_____ 性。
②H2O2也能使PbO2化为(CH3COO)2Pb溶液,反应中生成的氧化产物是_____ 。(填化学式)
③“酸浸”时,为了加快反应速率,可适当加热。但温度不宜过高,原因可能是______ (写出1条)。
(3)“酸浸”后调节溶液的pH约为4.9,则滤渣的主要成分是______ 。
(4)“沉铅”时,0.1mol/LPb2+在pH=9.1完全沉淀时的浓度是1×10-5mol/L,则Pb(OH)2的Ksp=_____ mol3/L3。

已知:i.一些难溶电解质的溶度积常数如表:
| 难溶电解质 | PbSO4 | PbCO3 | BaSO4 | BaCO3 |
| Ksp | 2.5×10-8 | 7.4×10-14 | 1.1×10-10 | 2.6×10-9 |
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Pb(OH)2 |
| 开始沉淀的pH | 1.5 | 6.3 | 3.3 | 7.1 |
| 完全沉淀的pH | 2.8 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中,PbSO4发生转化反应的离子方程式为
(2)在“酸浸”中,除加入CH3COOH,还要加入H2O2。
①H2O2除了能将Fe(II)转化为Fe(III),还能促进金属Pb在醋酸中转化为(CH3COO)2Pb溶液。H2O2在反应中表现
②H2O2也能使PbO2化为(CH3COO)2Pb溶液,反应中生成的氧化产物是
③“酸浸”时,为了加快反应速率,可适当加热。但温度不宜过高,原因可能是
(3)“酸浸”后调节溶液的pH约为4.9,则滤渣的主要成分是
(4)“沉铅”时,0.1mol/LPb2+在pH=9.1完全沉淀时的浓度是1×10-5mol/L,则Pb(OH)2的Ksp=
您最近一年使用:0次
2023-01-13更新
|
227次组卷
|
2卷引用:广东省江门市第一中学2022-2023学年高二上学期期末考试(线上考试)化学试题
8 . ClO2是新一代饮用水的消毒剂,许多发达国家采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下图所示:
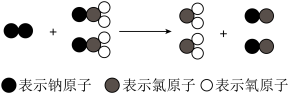
下列有关该反应的叙述中不正确的是

下列有关该反应的叙述中不正确的是
| A.该反应是氧化还原反应 |
| B.该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl |
| C.反应中Cl2既是氧化剂,又是还原剂 |
| D.生成2个ClO2时转移的电子数为2个 |
您最近一年使用:0次
9 . 双碱法脱硫过程如图所示。下列说法不正确的是
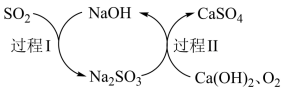
| A.过程I中,SO2表现还原性 |
| B.过程II中,1个O2可氧化2个Na2SO3 |
| C.双碱法脱硫过程中,NaOH可以循环利用 |
| D.总反应为2Ca(OH)2+2SO2+O2=2CaSO4+2H2O |
您最近一年使用:0次
2022-11-29更新
|
490次组卷
|
15卷引用:广东省台山市第一中学2022-2023学年高二上学期期末考试化学试题
广东省台山市第一中学2022-2023学年高二上学期期末考试化学试题北京市朝阳区2021届高三上学期期末考试化学试题广东省广州市2021-2022学年高三上学期12月调研考试化学试题(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)广东省惠州市2022届高三第二次调研考试化学试题北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题广东省华南师范大学附属中学2023届高三上学期第一次月考化学试题湖南省永州市第一中学2022-2023学年高三上学期第三次月考化学试题广东实验中学2022-2023学年高一上学期期中考试化学试题(已下线)3.3.1 硫循环-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题广东省深圳市福田区福田中学2022-2023学年高三上学期第三次考试化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)化学-2023年高考押题预测卷01(广东卷)(含考试版、全解全析、参考答案、答题卡)广东省广州市第一一三中学2023-2024学年高一上学期10月月考化学试题
名校
10 . 某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”,
已知:① 溶液存在平衡:
溶液存在平衡:
②含铬元素的离子在溶液中的颜色: (橙色),
(橙色), (黄色),
(黄色), (绿色)。
(绿色)。

(1)ⅰ可证明反应 的正反应是
的正反应是_______ (填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_______ (填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的_______ (填“能”或“不能”),理由是_______ 。
然后根据实验Ⅱ中不同现象,可以得出的结论是在酸性条件下,K2Cr2O7的氧化性更强。继续进行实验Ⅲ
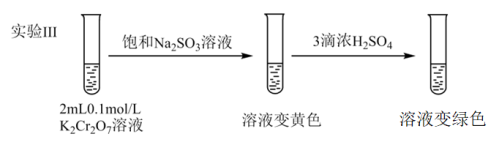
(4)解释溶液变黄的主要原因是 中存在平衡:
中存在平衡: ,加入
,加入 溶液以后,
溶液以后,_______ (离子)可以和_______ (离子)结合,平衡正向移动,溶液变为黄色。
(5)溶液变绿色,该反应的离子方程式是_______ 。
已知:①
 溶液存在平衡:
溶液存在平衡:
②含铬元素的离子在溶液中的颜色:
 (橙色),
(橙色), (黄色),
(黄色), (绿色)。
(绿色)。
(1)ⅰ可证明反应
 的正反应是
的正反应是(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的
然后根据实验Ⅱ中不同现象,可以得出的结论是在酸性条件下,K2Cr2O7的氧化性更强。继续进行实验Ⅲ

(4)解释溶液变黄的主要原因是
 中存在平衡:
中存在平衡: ,加入
,加入 溶液以后,
溶液以后,(5)溶液变绿色,该反应的离子方程式是
您最近一年使用:0次



