名校
1 . 现有下列10种物质:①铝,②纯醋酸,③CO2,④H2SO4,⑤Ba(OH)2,⑥红褐色的氢氧化铁胶体,⑦稀盐酸,⑧NaHSO4,⑨碳酸钙,⑩乙醇,请按要求书写离子方程式或化学方程式,
(1)上述物质中属于电解质的有_______ ,属于非电解质的有_______ ,既不属于电解质也不属于非电解质的有_______ (填序号)。
(2)写出⑧在水中的电离方程式为_______ 。
(3)向沸水中逐滴加入饱和FeCl3溶液,至液体呈透明的红褐色,写出化学方程式_______ 。
(4)已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为_______ 。
(5)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O 还原为Cr3+,该过程的离子方程式为
还原为Cr3+,该过程的离子方程式为_______ 。
(1)上述物质中属于电解质的有
(2)写出⑧在水中的电离方程式为
(3)向沸水中逐滴加入饱和FeCl3溶液,至液体呈透明的红褐色,写出化学方程式
(4)已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为
(5)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O
 还原为Cr3+,该过程的离子方程式为
还原为Cr3+,该过程的离子方程式为
您最近一年使用:0次
2021-10-29更新
|
212次组卷
|
2卷引用:宁夏吴忠中学2021-2022学年高三上学期线上教学测试化学试题
名校
解题方法
2 . HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是_______ (填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,能用来区分NaNO2和NaCl的是_______ (填序号)。
A.分别溶于水看溶解情况
B.在酸性条件下加入KI淀粉溶液来区别
C.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______ 。
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是_______ (填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑,_____ ,若有1molFeSO4反应,则反应中转移____ mol电子。
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,能用来区分NaNO2和NaCl的是
A.分别溶于水看溶解情况
B.在酸性条件下加入KI淀粉溶液来区别
C.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑,
您最近一年使用:0次
3 . 某离子反应涉及H2O、ClO-、 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
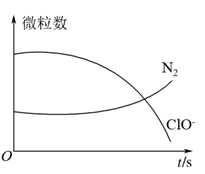
 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
| A.该反应中Cl-为氧化产物 |
| B.消耗1个还原剂微粒,转移6e- |
C. 被ClO-氧化成N2 被ClO-氧化成N2 |
| D.反应后溶液的酸性减弱 |
您最近一年使用:0次
2020-10-02更新
|
1134次组卷
|
8卷引用:宁夏回族自治区石嘴山市平罗中学2020届高三上学期期中考试化学试题
名校
解题方法
4 . 黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
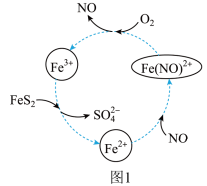
(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2做__ (填“催化剂”“氧化剂”或“还原剂”,下同)。该转化过程中NO的作用是__ 。
②写出图1中Fe3+与FeS2反应的离子方程式:__ 。
(2)Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。
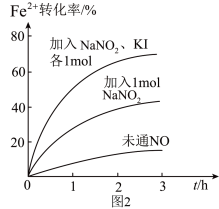
①加入NaNO2发生反应:2H++3NO =NO
=NO +2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为
+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为__ mol。
②加入NaNO2、KI发生反应:4H++2NO +2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:__ 。

(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2做
②写出图1中Fe3+与FeS2反应的离子方程式:
(2)Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。

①加入NaNO2发生反应:2H++3NO
 =NO
=NO +2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为
+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为②加入NaNO2、KI发生反应:4H++2NO
 +2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
您最近一年使用:0次
2020-08-16更新
|
311次组卷
|
6卷引用:宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题
宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题河北省承德市各县第一中学2018届高三上学期期末考试化学试题(已下线)第08讲 氧化还原反应的基本概念和规律(精练)——2021年高考化学一轮复习讲练测(已下线)第03讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省沈阳市辽中区第二高级中学2021-2022学年高二下学期摸底考试化学试题(已下线)第4讲 氧化还原反应的基本概念与规律
解题方法
5 . 主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
(1)在基态14C原子中,核外存在________ 对自旋相反的电子,基态氮原子的价层电子排布图为________ 。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___ ,其中氧原子的杂化方式为_____ 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=_______ 。CO与N2结构相似,CO分子内σ键与π键个数之比为_________ 。
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是______ 。
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释H2SeO4比H2SeO3酸性强的原因:__________ ;
(6)已知Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有__________ 个铜原子。
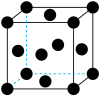
(7)用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00 g·cm-3,Cu的原子半径为________ cm(阿伏伽德罗常数为NA,只要求列式表示)。
(1)在基态14C原子中,核外存在
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释H2SeO4比H2SeO3酸性强的原因:
(6)已知Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有
(7)用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00 g·cm-3,Cu的原子半径为

您最近一年使用:0次
11-12高三·宁夏银川·阶段练习
解题方法
6 . HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为 Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是____________ (填序号)。
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是____________ (填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:____________________ 。
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是___________ (填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
__________________________________
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是______________________ 。
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为 Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是
您最近一年使用:0次
2016-12-09更新
|
287次组卷
|
6卷引用:2013届宁夏银川一中高三第一次月考理综化学试卷
(已下线)2013届宁夏银川一中高三第一次月考理综化学试卷(已下线)2013届吉林省榆树市第一高级中学高三第一次月考化学试卷2016届四川省宜宾三中高三上学期第一次月考化学试卷12016届福建省福州市第一中学高三上学期期中测试化学试卷2016届四川省宜宾三中高三上学期第一次月考化学试卷2黑龙江省佳木斯学校(佳木斯市实验中学)2021-2022学年高三上学期第二次月考化学试题



