名校
解题方法
1 . Ⅰ.明胶是水溶性蛋白质混合物,溶于水形成胶体。工业明胶含有重金属 ,对人体有害。
,对人体有害。
(1)已知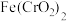 中
中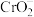 是一种酸根离子,则
是一种酸根离子,则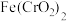 属于
属于___________ (填“酸”“碱”“盐”或“氧化物”),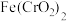 中铁元素的化合价为
中铁元素的化合价为___________ 价。
(2)明胶的水溶液和 溶液共同具有的性质是
溶液共同具有的性质是___________ (填字母)。
A.都不稳定,密封放置会产生沉淀 B.两者均有丁达尔效应 C.分散质粒子都可通过滤纸
Ⅱ. 是银白色金属,化学性质稳定,
是银白色金属,化学性质稳定, 价和
价和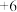 价为常见价态。工业上以铬铁矿(主要成分为
价为常见价态。工业上以铬铁矿(主要成分为 ,含
,含
 等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠
等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠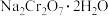 ,其主要工艺流程如下。
,其主要工艺流程如下。

查阅资料:常温下, 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为 。
。
(3)工业上常采用热还原法制备金属铬,写出以 为原料,利用铝热反应制取金属铬的化学方程式:
为原料,利用铝热反应制取金属铬的化学方程式:___________ 。
(4)酸化滤液D时,用硫酸而不用盐酸,可能的原因是___________ 。
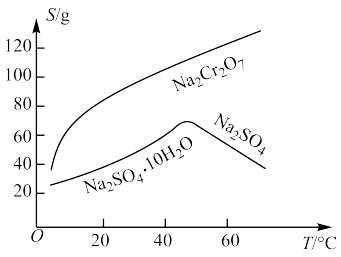
(5)固体E的主要成分是 ,根据下图分析操作a为
,根据下图分析操作a为___________ 、___________ 。
(6)电镀厂产生的镀铜废水中往往含有一定量的 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:

① 的化学性质与
的化学性质与 相似。在上述生产过程中加入
相似。在上述生产过程中加入 溶液时要控制溶液的
溶液时要控制溶液的 不能过高,是因为
不能过高,是因为___________ (用离子方程式表示)。
②下列溶液中可以代替上述流程中 溶液的是
溶液的是___________ (填字母)。
A.浓硫酸 B.酸性 溶液 C.
溶液 C. 溶液
溶液
③上述流程中,每消耗0.1mol 转移0.8mole-,则加入
转移0.8mole-,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为___________ 。
 ,对人体有害。
,对人体有害。(1)已知
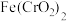 中
中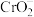 是一种酸根离子,则
是一种酸根离子,则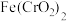 属于
属于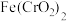 中铁元素的化合价为
中铁元素的化合价为(2)明胶的水溶液和
 溶液共同具有的性质是
溶液共同具有的性质是A.都不稳定,密封放置会产生沉淀 B.两者均有丁达尔效应 C.分散质粒子都可通过滤纸
Ⅱ.
 是银白色金属,化学性质稳定,
是银白色金属,化学性质稳定, 价和
价和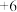 价为常见价态。工业上以铬铁矿(主要成分为
价为常见价态。工业上以铬铁矿(主要成分为 ,含
,含
 等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠
等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠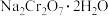 ,其主要工艺流程如下。
,其主要工艺流程如下。
查阅资料:常温下,
 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为 。
。(3)工业上常采用热还原法制备金属铬,写出以
 为原料,利用铝热反应制取金属铬的化学方程式:
为原料,利用铝热反应制取金属铬的化学方程式:(4)酸化滤液D时,用硫酸而不用盐酸,可能的原因是
(5)固体E的主要成分是
 ,根据下图分析操作a为
,根据下图分析操作a为
(6)电镀厂产生的镀铜废水中往往含有一定量的
 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:
①
 的化学性质与
的化学性质与 相似。在上述生产过程中加入
相似。在上述生产过程中加入 溶液时要控制溶液的
溶液时要控制溶液的 不能过高,是因为
不能过高,是因为②下列溶液中可以代替上述流程中
 溶液的是
溶液的是A.浓硫酸 B.酸性
 溶液 C.
溶液 C. 溶液
溶液③上述流程中,每消耗0.1mol
 转移0.8mole-,则加入
转移0.8mole-,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为
您最近一年使用:0次
2021-12-04更新
|
86次组卷
|
2卷引用:宁夏石嘴山市平罗中学2021-2022学年高三上学期期中考试化学试题
名校
2 . 氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①其中还原剂为___ ,还原产物为___ 。
②若有0.8mol还原剂被氧化,则转移电子的物质的量是___ 。
(2)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
__ NaClO+__ NH3·H2O→___ N2H4+___ NaCl+___ H2O
①请配平上述化学方程式。
②NH3·H2O在上述反应中显示出来的性质是___ 。
A.氧化性 B.还原性
C.酸性 D.碱性
(3)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为____ ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式_____ 。
(4)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为____ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为___ 。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①其中还原剂为
②若有0.8mol还原剂被氧化,则转移电子的物质的量是
(2)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
①请配平上述化学方程式。
②NH3·H2O在上述反应中显示出来的性质是
A.氧化性 B.还原性
C.酸性 D.碱性
(3)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(4)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为
您最近一年使用:0次
2019-10-20更新
|
404次组卷
|
6卷引用:宁夏银川市第二中学2021-2022学年高一上学期期末考试化学试题
名校
3 . 在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。
(1)完成并配平下列化学方程式:_____________
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________ mol。
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为
您最近一年使用:0次
2018-12-11更新
|
125次组卷
|
4卷引用:宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题
宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题(已下线)2010年福建省厦门市杏南中学高三上学期10月月考化学卷福建省惠安惠南中学2019届高三上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题
4 . 金属钠及其化合物在人类生产、生活中起着重要作用。诸回答下列问题:
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为___________ ,采用空气和Na为原料可直接制备Na2O2.空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)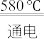 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
①配平上述离子方程式___________ 。
②该反应说明Na2O2具有___________ (选填“氧化性”“还原性"或“漂白性”)。
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为___________ 。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
A.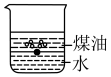 | B.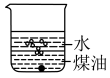 |
C. | D. |
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)
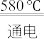 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O①配平上述离子方程式
②该反应说明Na2O2具有
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为
您最近一年使用:0次
名校
5 . 作为食品添加剂时,亚硝酸钠 可以增加肉类的鲜度,抑制微生物,保持肉制品的结构和营养价值;但是过量振入会导致中毒。某实验小组设计实验制备亚硝酸钠并进行含量测定。
可以增加肉类的鲜度,抑制微生物,保持肉制品的结构和营养价值;但是过量振入会导致中毒。某实验小组设计实验制备亚硝酸钠并进行含量测定。
Ⅰ 制备
制备
实验室以木炭、浓硝酸、 为主要原料按照如图所示装置制备亚硝酸钠
为主要原料按照如图所示装置制备亚硝酸钠 加热装置及部分夹持装置已略去
加热装置及部分夹持装置已略去 ,反应原理为:
,反应原理为:
回答下列问题:
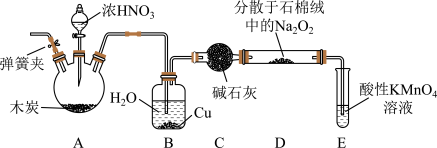
(1)连接好装置之后,下一步实验操作是______ 。
(2) 装置中铜的作用是
装置中铜的作用是______ 。
(3) 装置用于尾气处理,E中反应的离子方程式为
装置用于尾气处理,E中反应的离子方程式为______ 。
(4)实验结束阶段,熄灭酒精灯之后继续通入 直至装置冷却。此时通入
直至装置冷却。此时通入 的目的是
的目的是______ 。
Ⅱ 含量的测定
含量的测定
查阅资料可知:酸性 溶液可将
溶液可将 氧化为
氧化为 ,
, 还原成
还原成 。
。
(5)溶液配制:称取装置D中反应后的固体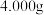 ,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至250mL的
,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至250mL的______ 中,加蒸馏水至______ 。
滴定:取 溶液于锥形瓶中,用
溶液于锥形瓶中,用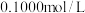 酸性
酸性 溶液进行滴定,实验数据如下表所示:
溶液进行滴定,实验数据如下表所示:
(6)第4组实验数据出现异常,造成这种异常的原因可能是______  双项选择
双项选择 。
。
A.锥形瓶洗净后未干燥 滴定终了仰视读数
滴定终了仰视读数
C.滴定终了俯视读数 酸式滴定管用蒸馏水洗净后未用标准液润洗
酸式滴定管用蒸馏水洗净后未用标准液润洗
(7)根据表中数据,计算所得固体中亚硝酸钠的质量分数______ 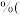 保留2位小数
保留2位小数 。
。
 可以增加肉类的鲜度,抑制微生物,保持肉制品的结构和营养价值;但是过量振入会导致中毒。某实验小组设计实验制备亚硝酸钠并进行含量测定。
可以增加肉类的鲜度,抑制微生物,保持肉制品的结构和营养价值;但是过量振入会导致中毒。某实验小组设计实验制备亚硝酸钠并进行含量测定。Ⅰ
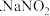 制备
制备实验室以木炭、浓硝酸、
 为主要原料按照如图所示装置制备亚硝酸钠
为主要原料按照如图所示装置制备亚硝酸钠 加热装置及部分夹持装置已略去
加热装置及部分夹持装置已略去 ,反应原理为:
,反应原理为:
回答下列问题:

(1)连接好装置之后,下一步实验操作是
(2)
 装置中铜的作用是
装置中铜的作用是(3)
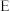 装置用于尾气处理,E中反应的离子方程式为
装置用于尾气处理,E中反应的离子方程式为(4)实验结束阶段,熄灭酒精灯之后继续通入
 直至装置冷却。此时通入
直至装置冷却。此时通入 的目的是
的目的是Ⅱ
 含量的测定
含量的测定查阅资料可知:酸性
 溶液可将
溶液可将 氧化为
氧化为 ,
, 还原成
还原成 。
。(5)溶液配制:称取装置D中反应后的固体
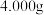 ,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至250mL的
,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至250mL的滴定:取
 溶液于锥形瓶中,用
溶液于锥形瓶中,用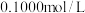 酸性
酸性 溶液进行滴定,实验数据如下表所示:
溶液进行滴定,实验数据如下表所示:| 滴定次数 | 1 | 2 | 3 | 4 |
 溶液体积 溶液体积 | 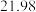 | 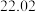 |  | 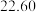 |
 双项选择
双项选择 。
。A.锥形瓶洗净后未干燥
 滴定终了仰视读数
滴定终了仰视读数C.滴定终了俯视读数
 酸式滴定管用蒸馏水洗净后未用标准液润洗
酸式滴定管用蒸馏水洗净后未用标准液润洗(7)根据表中数据,计算所得固体中亚硝酸钠的质量分数
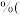 保留2位小数
保留2位小数 。
。
您最近一年使用:0次
2020-11-14更新
|
144次组卷
|
2卷引用:宁夏石嘴山市平罗中学2021-2022学年高三上学期期中考试化学试题
6 . 请回答:
(1)Na2O2的电子式___________ 。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由___________ 。
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______
① 请配平上述化学方程式。___________
② 浓盐酸在反应中显示出来的性质是___________
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为___________ 。
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的___________ 倍。
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________ 。
(1)Na2O2的电子式
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______

① 请配平上述化学方程式。
② 浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
7 . 储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为:C+K2Cr2O7+H2SO4→CO2↑+K2SO4+Cr2(SO4)3+H2O(未配平)。回答下列问题。
(1)该反应中,还原剂是___________ (填化学式),被还原的元素是___________ (填元素符号)。
(2)该反应中,K2Cr2O7表现出___________ (选填“氧化性”或“还原性”),K2Cr2O7发生了___________ (选填“氧化反应”或“还原反应”)。
(3)H2SO4在该反应中表现出___________(填字母)。
(4)配平上述方程式:________ 。每生成2分子H2O,该反应转移_________ 个电子。
(1)该反应中,还原剂是
(2)该反应中,K2Cr2O7表现出
(3)H2SO4在该反应中表现出___________(填字母)。
| A.只有酸性 | B.只有氧化性 | C.酸性和氧化性 | D.酸性和还原性 |
您最近一年使用:0次
名校
8 . (1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下,请配平此氧化还原反应方程式:_____ FeS2+_____H++_____N =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________ 。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____________ (填字母)

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________ ,此反应的离子方程式:________ 。
 =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是
您最近一年使用:0次
2020-01-13更新
|
238次组卷
|
4卷引用:【全国百强校】宁夏回族自治区银川一中2018-2019学年高一上学期期末考试化学试题
名校
9 . 高铜酸钾是一种难溶于水的黑色粉末状固体,与高铁酸钾性质相似。可以由四羟基合铜酸钾和次溴酸在冰水浴中合成:①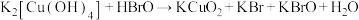 (未配平)。高铜酸钾在酸性条件下不稳定:②
(未配平)。高铜酸钾在酸性条件下不稳定:② (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是
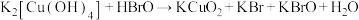 (未配平)。高铜酸钾在酸性条件下不稳定:②
(未配平)。高铜酸钾在酸性条件下不稳定:② (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是| A.①中氧化剂和还原剂的物质的量之比为1:2 |
B.②若有标况下5.6L 生成,转移电子 生成,转移电子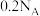 |
C.②中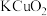 既表现氧化性,又表现还原性 既表现氧化性,又表现还原性 |
D.由①②可知氧化性强弱顺序为: |
您最近一年使用:0次
2022-06-07更新
|
962次组卷
|
6卷引用:宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题
宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题山东省德州市2022届高考三模化学试题(已下线)1.3.2 氧化性、还原性强弱的判断(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)(已下线)第03讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题
名校
解题方法
10 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题
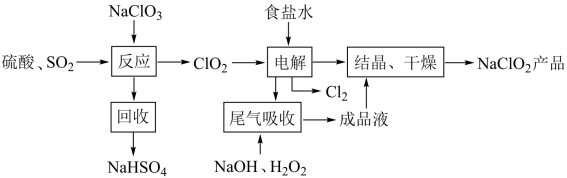
(1)NaClO2中Cl的化合价为______________________ .
(2)写出“反应”步骤中生成ClO2的化学方程式._______________________________ 。
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为_____________________ 、______________________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应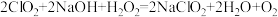 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为_________________ ,在标况下生成44.8LO2则转移电子的物质的量是____ .
(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式._____________________________ 。

(1)NaClO2中Cl的化合价为
(2)写出“反应”步骤中生成ClO2的化学方程式.
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应
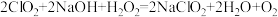 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式.
您最近一年使用:0次



