1 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。

(1)Na2Cr2O7中Cr元素的化合价是___________ ,在上述转化中,Cr元素化合价不变的步骤是___________ (填序号)。
(2)下列物质中能实现反应①转化的是___________ 。(填字母)
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生___________ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:___________ 。
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:___________ 。
(4)反应④在碱性条件下发生,反应的离子方程式为: ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式___________ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)下列物质中能实现反应①转化的是
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:
(4)反应④在碱性条件下发生,反应的离子方程式为:
 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
名校
2 . 高铁酸钾(K2FeO4)是一种高效的水处理剂,实验室制备K2FeO4的装置如图所示。(夹持装置略去)
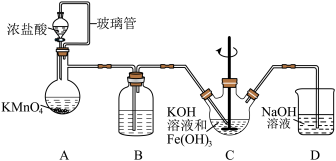
查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中KOH溶液过量的目的是___________ 。搅拌操作,除了防止因局部溶液碱性减弱,使K2FeO4与水反应产生Fe(OH)3和O2,另外的作用是___________ 。
(4)装置C中生成K2FeO4的离子方程式为___________ 。该反应放热,不利于K2FeO4固体析出,写出一条实验改进措施___________ 。
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用___________ 除水。(填标号)
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是___________ 。

查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是
(2)装置B中盛放的试剂是
(3)装置C中KOH溶液过量的目的是
(4)装置C中生成K2FeO4的离子方程式为
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是
您最近一年使用:0次
2023-09-07更新
|
581次组卷
|
3卷引用:宁夏石嘴山市平罗中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
3 . 配平下列方程式或完成下列问题
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO +______H2O。
+______H2O。________ 。
(2)______FeS2+______O2 ______Fe2O3+______SO2。
______Fe2O3+______SO2。________ 。
(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。________ 。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。________ 。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______ =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。________ 。
(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____________ 。
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:___________________________ 。
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为___________ 。
(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:
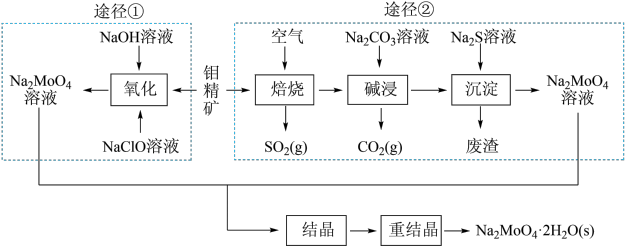
回答下列问题:
途径①制备钼酸钠溶液,同时有SO 生成,该反应的离子方程式为
生成,该反应的离子方程式为_____________ 。
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO
 +______H2O。
+______H2O。(2)______FeS2+______O2
 ______Fe2O3+______SO2。
______Fe2O3+______SO2。(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______
 =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的
 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:

回答下列问题:
途径①制备钼酸钠溶液,同时有SO
 生成,该反应的离子方程式为
生成,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 一种利用微生物从黄铜矿(主要成分为 )中提取铜元素的具体操作过程如图所示。下列说法正确的是
)中提取铜元素的具体操作过程如图所示。下列说法正确的是

 )中提取铜元素的具体操作过程如图所示。下列说法正确的是
)中提取铜元素的具体操作过程如图所示。下列说法正确的是
A.转化过程中 和 和 可以循环使用 可以循环使用 |
B.微生物的作用下, 作催化剂 作催化剂 |
C.若 中的铜元素最终全部转化为 中的铜元素最终全部转化为 ,当有2mol ,当有2mol 生成时,理论上消耗4.25mol 生成时,理论上消耗4.25mol |
D.在硫酸介质中用 替代 替代 也能高效实现将 也能高效实现将 氧化为 氧化为 |
您最近一年使用:0次
2023-04-11更新
|
388次组卷
|
5卷引用:宁夏回族自治区银川一中2023-2024学年高三上学期第一次月考理科综合化学试题
宁夏回族自治区银川一中2023-2024学年高三上学期第一次月考理科综合化学试题(已下线)化学押题卷(二)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)选择题6-10内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷
名校
解题方法
5 . 研究小组以 (绿色固体)、
(绿色固体)、 、THF(四氯呋喃,液体)等物质为原料制备固体配合物
、THF(四氯呋喃,液体)等物质为原料制备固体配合物 ,该配合物可作为有机反应的催化剂
,该配合物可作为有机反应的催化剂
(1)无水 (紫色固体,易升华)的制备装置如图所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图所示(夹持装置略)。

①仪器a的名称为________ 。
②本实验持续通入 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、________ 。
③反应管的温度升到660℃时发生反应,生成 和
和 (光气),其化学方程式为
(光气),其化学方程式为________ 。 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是________ (填化学式)。
④反应管右端有15cm在加热炉外,其作用是________________ 。
(2) 的合成装置如图所示(搅拌和夹持装置咯)
的合成装置如图所示(搅拌和夹持装置咯)

将制备的无水 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为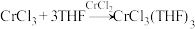 。
。
实验时烧瓶中THF受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与滤纸套筒内的物质接触。当液面达到虹吸管3顶端时,经虹吸管3返回双颈烧瓶.从而实现了THF与 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。
①锌粉的作用是________________ (用化学方程式表示)。
② 和
和 在THF的溶解性分别为
在THF的溶解性分别为________ 、________ (填“溶”或“不溶”)。
③合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品6.7410g。则该实验的产率为________ %。[已知: 的摩尔质量为152g/mol;
的摩尔质量为152g/mol; 的摩尔质量为374.5g/mol]
的摩尔质量为374.5g/mol]
 (绿色固体)、
(绿色固体)、 、THF(四氯呋喃,液体)等物质为原料制备固体配合物
、THF(四氯呋喃,液体)等物质为原料制备固体配合物 ,该配合物可作为有机反应的催化剂
,该配合物可作为有机反应的催化剂(1)无水
 (紫色固体,易升华)的制备装置如图所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图所示(夹持装置略)。
①仪器a的名称为
②本实验持续通入
 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、③反应管的温度升到660℃时发生反应,生成
 和
和 (光气),其化学方程式为
(光气),其化学方程式为 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是④反应管右端有15cm在加热炉外,其作用是
(2)
 的合成装置如图所示(搅拌和夹持装置咯)
的合成装置如图所示(搅拌和夹持装置咯)
将制备的无水
 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为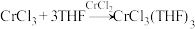 。
。实验时烧瓶中THF受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与滤纸套筒内的物质接触。当液面达到虹吸管3顶端时,经虹吸管3返回双颈烧瓶.从而实现了THF与
 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。①锌粉的作用是
②
 和
和 在THF的溶解性分别为
在THF的溶解性分别为③合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品6.7410g。则该实验的产率为
 的摩尔质量为152g/mol;
的摩尔质量为152g/mol; 的摩尔质量为374.5g/mol]
的摩尔质量为374.5g/mol]
您最近一年使用:0次
2023-03-14更新
|
689次组卷
|
4卷引用:宁夏回族自治区银川一中2023-2024学年高三上学期第五次月考理科综合试题
名校
6 . 利用如图装置测定ClO2气体的质量:在锥形瓶中加入足量的KI溶液,再加入3 mL硫酸溶液:在玻璃液封管中加入水:将生成的ClO2气体通进入锥形瓶中被吸收;将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至终点时消耗V mL( )。下列说法错误的是
)。下列说法错误的是
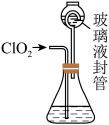
 )。下列说法错误的是
)。下列说法错误的是 
A. 与酸化的KI溶液反应为 与酸化的KI溶液反应为 |
B.玻璃液封管的作用是吸收残余的 气体、使锥形瓶内外压强相等 气体、使锥形瓶内外压强相等 |
C.测得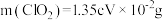 |
| D.滴定终点的现象是溶液由无色恰好变为蓝色,且半分钟内不变色 |
您最近一年使用:0次
2023-02-11更新
|
261次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期开学检测化学试题
7 . 阅读下面一段材料并回答问题。
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)制备 需要在
需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,不正确的是
的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)消毒净化 水,至少需要
水,至少需要 的质量为
的质量为_______ kg。
(5)高铁酸钠 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取:
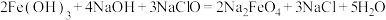
①该反应中氧化剂是_____ (用化学式表示,下同),____ 元素被氧化,还原产物为____ 。
②用双线桥法在方程式中标出电子转移的情况:_____ 。
(6)将 与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目
与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目____ 。
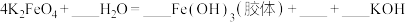
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气  通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mg  ,即可达到卫生标准 ,即可达到卫生标准…… |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,不正确的是
的说法中,不正确的是a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)消毒净化
 水,至少需要
水,至少需要 的质量为
的质量为(5)高铁酸钠
 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: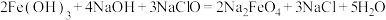
①该反应中氧化剂是
②用双线桥法在方程式中标出电子转移的情况:
(6)将
 与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目
与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目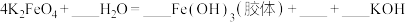
您最近一年使用:0次
名校
解题方法
8 . 物质集合M中含有常见物质Na2O2、NaHCO3、Al、SO2、Fe、NH3、Na、F2。这些物质按照以下方法进行分类后如图所示,请按照要求回答问题。
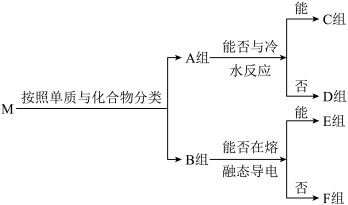
(1)B组物质中属于非电解质的物质为____ ,其中能作制冷剂的物质的电子式为____ 。
(2)C组物质中能与水反应生成还原性气体的化学方程式为____ 。
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:____ 。
(4)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:____ 。
(5)在密闭容器中,将E组中的两种物质加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为____ ;反应中氧化剂与还原剂的物质的量之比为____ 。

(1)B组物质中属于非电解质的物质为
(2)C组物质中能与水反应生成还原性气体的化学方程式为
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:
(4)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:
(5)在密闭容器中,将E组中的两种物质加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为
您最近一年使用:0次
2022-09-23更新
|
599次组卷
|
2卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题
名校
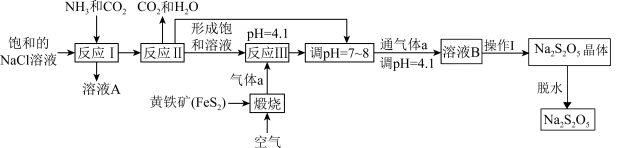
9 . 焦亚硫酸钠 在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
已知:① 过饱和溶液中更易形成
过饱和溶液中更易形成 ;
;
②焦亚硫酸钠 在空气中易氧化,受热易分解。
在空气中易氧化,受热易分解。
回答下列问题:
(1)反应I中先通入气体____ (填化学式),反应III中通入的气体a为_____ (填化学式)。
(2)溶液A中含有三种阳离子,分别为 、
、 和离子X。检验溶液A中离子X的方法是
和离子X。检验溶液A中离子X的方法是_______ 。
(3)反应III调节pH为4.1,发生反应的离子方程式为_______ 。
(4)再次通入气体a得到溶液B的目的是_______ 。
(5)操作I为:在氮气氛围中,_______ ,_______ ,过滤,洗涤。其中洗涤 晶体时依次用饱和
晶体时依次用饱和 水溶液、无水乙醇。用饱和
水溶液、无水乙醇。用饱和 水溶液洗涤的目的是
水溶液洗涤的目的是_______ 。
(6)久置的 固体中若含有
固体中若含有 杂质,其可能的原因是
杂质,其可能的原因是_______ 。(用化学反应方程式表示)
 在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
已知:①
 过饱和溶液中更易形成
过饱和溶液中更易形成 ;
;②焦亚硫酸钠
 在空气中易氧化,受热易分解。
在空气中易氧化,受热易分解。回答下列问题:
(1)反应I中先通入气体
(2)溶液A中含有三种阳离子,分别为
 、
、 和离子X。检验溶液A中离子X的方法是
和离子X。检验溶液A中离子X的方法是(3)反应III调节pH为4.1,发生反应的离子方程式为
(4)再次通入气体a得到溶液B的目的是
(5)操作I为:在氮气氛围中,
 晶体时依次用饱和
晶体时依次用饱和 水溶液、无水乙醇。用饱和
水溶液、无水乙醇。用饱和 水溶液洗涤的目的是
水溶液洗涤的目的是(6)久置的
 固体中若含有
固体中若含有 杂质,其可能的原因是
杂质,其可能的原因是
您最近一年使用:0次
2022-08-26更新
|
298次组卷
|
2卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期11月期中考试化学试题
名校
解题方法
10 . 碱式硫酸铁[Fe(OH)SO4]是一种絮疑剂,常用于污水处理。工业上利用废铁屑(含少量Al2O3、Fe2O3等)生产碱式硫酸铁的工艺流程如图所示。
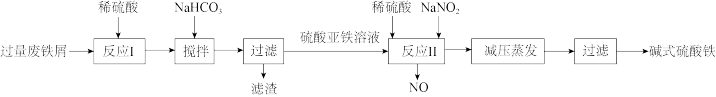
下列说法错误的是

下列说法错误的是
| A.“反应I”后的溶液中主要存在的阳离子有H+、Fe2+、Al3+ |
| B.“反应II”中加入稀硫酸可抑制Fe3+的水解 |
C.“反应II”对应的离子方程式为Fe2++NO +2H+=Fe3++NO↑+H2O +2H+=Fe3++NO↑+H2O |
| D.若用O2代替NaNO2,则每消耗112mL(标准状况)O2相当于节约了2.76gNaNO2 |
您最近一年使用:0次
2022-08-23更新
|
827次组卷
|
3卷引用:宁夏回族自治区石嘴山市第三中学2022-2023学年高三上学期第一次月考化学试题



