名校
1 . 铁与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图所示,下列说法错误的是
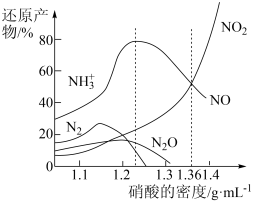
| A.其他条件相同,铁与足量密度为1.23g/mL的硝酸反应,还原产物主要为NO |
| B.一定量的铁粉与足量密度为1.36g/mL的HNO3反应,得到气体2.24L(标准状况),则参加反应的硝酸的物质的量为0.3mol |
| C.足量铁与一定量密度为1.36g/mL的硝酸反应,反应的化学方程式始终为:2Fe+6HNO3=2Fe(NO3)2+NO↑+NO2↑+3H2O |
| D.硝酸的密度越大,其还原产物中高价态的成分所占比例越多 |
您最近一年使用:0次
2022-04-21更新
|
1074次组卷
|
7卷引用:湖北省武汉市部分重点中学2021-2022学年高一下学期期中联考化学试题
2 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是___________ 。
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为___________ 。
(3)根据上述反应可推知___________。
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方向和数目:  。
。___________
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为
(3)根据上述反应可推知___________。
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
 。
。
您最近一年使用:0次
名校
3 . 据所学知识完成以下题目:
(1)在下列反应中,HCl做还原剂的是_______ ,HCl做氧化剂的是_______ 。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,_______ 。
②Mn2++ +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,_______ 。
(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,_______ 。
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是____ ;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂_____ mol,有_____ mol电子发生转移,相当于测出含钙元素的质量是_____ g。
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____ 。
(1)在下列反应中,HCl做还原剂的是
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓)
 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O④KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,
②Mn2++
 +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
您最近一年使用:0次
2020-12-24更新
|
1712次组卷
|
5卷引用:福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题
福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题05 氧化还原反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练 (已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)
4 . 低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:
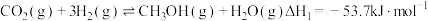
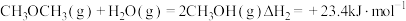
则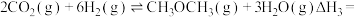
_______ kJ∙mol-1。
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: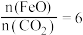 ,则
,则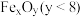 的化学式为
的化学式为_______ ,“热分解系统”中每转移 电子,需消耗
电子,需消耗
_______  。
。
(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子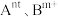 和负离子
和负离子 组成,该物质
组成,该物质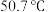 以上形成无序结构(高温相),
以上形成无序结构(高温相),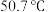 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示:_______ 。
ii.“高温相”具有良好的离子导电性,其主要原因是_______ 。
(4)铜基催化剂 (
( 为
为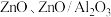 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 上发生反应的总化学方程式
上发生反应的总化学方程式_______ 。
(5)利用电解法在碱性或酸性条件下将 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: 和法拉第效率(
和法拉第效率(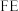 )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下:
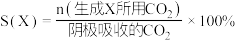

①实验测得,碱性条件生成 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是_______ 。
②实验测得,酸性条件生成 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是_______ 。
(1)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: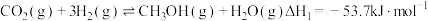
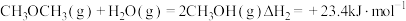
则
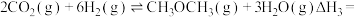
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由
 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: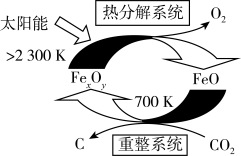
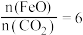 ,则
,则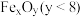 的化学式为
的化学式为 电子,需消耗
电子,需消耗
 。
。(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子
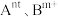 和负离子
和负离子 组成,该物质
组成,该物质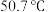 以上形成无序结构(高温相),
以上形成无序结构(高温相),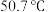 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示: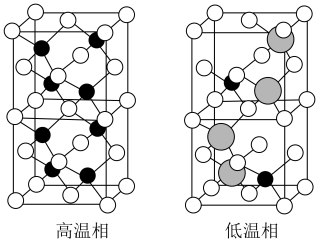
说明:图中,○球为负离子;高温相中的●深色球为正离子或空位;低温相中的 球为
球为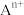 离子,●球为
离子,●球为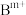 离子。
离子。
ii.“高温相”具有良好的离子导电性,其主要原因是
(4)铜基催化剂
 (
( 为
为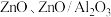 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 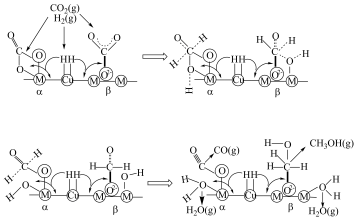
 上发生反应的总化学方程式
上发生反应的总化学方程式(5)利用电解法在碱性或酸性条件下将
 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: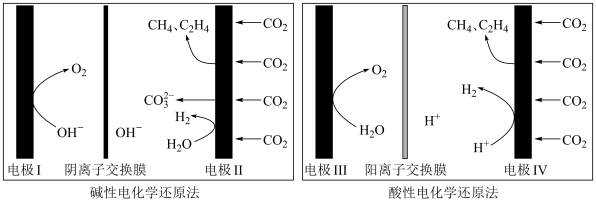
 和法拉第效率(
和法拉第效率(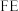 )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下: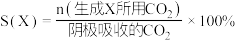

①实验测得,碱性条件生成
 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是②实验测得,酸性条件生成
 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是
您最近一年使用:0次
2024-03-11更新
|
425次组卷
|
4卷引用:江苏省常州市第一中学2023-2024学年高三下学期期初检测化学试卷
江苏省常州市第一中学2023-2024学年高三下学期期初检测化学试卷(已下线)大题预测卷(江西专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)江苏省扬州中学2024届高三下学期考前模拟化学试题江苏省常州市第一中2023-2024学年高二下学期5月月考化学试题
名校
5 . 氯气可用于制取漂白剂和自来水消毒。
(1)下图是实验室制备氯气的制备和除杂装置
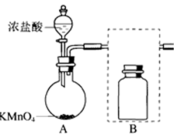
①A为氯气发生装置。A中反应方程式是_______ (锰被还原为 )。
)。
②将除杂装置B补充完整并标明所用试剂_______ 。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为_______ 。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的 ;
;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用 溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。
溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
已知,溶液中 、HClO和
、HClO和 物质的量分数
物质的量分数 随溶液pH变化的关系如下图所示:
随溶液pH变化的关系如下图所示:
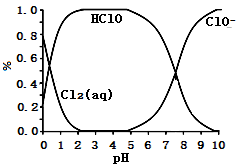
①由实验现象可得以下结论:溶液pH在4~10范围内,pH越大,红纸褪色_______ 。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是_______ 。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如 气体就是一种新型高效含氯消毒剂。
气体就是一种新型高效含氯消毒剂。
①一种制备 的方法是用
的方法是用 通入硫酸酸化的
通入硫酸酸化的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为_______ 。
②另一种制备 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 体积约占
体积约占 ,每生成
,每生成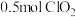 ,转移
,转移_______  。
。
③ 在杀菌消毒过程中会产生副产物亚氯酸盐
在杀菌消毒过程中会产生副产物亚氯酸盐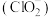 ,需将其转化为
,需将其转化为 除去。下列试剂中,可将
除去。下列试剂中,可将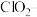 转化为
转化为 的是
的是_______ (填字母序号)。
a. b.
b. c.
c. d.KI
d.KI
(1)下图是实验室制备氯气的制备和除杂装置

①A为氯气发生装置。A中反应方程式是
 )。
)。②将除杂装置B补充完整并标明所用试剂
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的
 ;
;步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用
 溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。
溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
| 烧杯 | 溶液的pH | 现象 |
| a | 10 | 10min后,红纸基本不褪色;4h后红纸褪色 |
| b | 7 | 10min后,红纸颜色变浅;4h后红纸褪色 |
| c | 4 | 10min后,红纸颜色变得更浅;4h后红纸褪色 |
 、HClO和
、HClO和 物质的量分数
物质的量分数 随溶液pH变化的关系如下图所示:
随溶液pH变化的关系如下图所示:
①由实验现象可得以下结论:溶液pH在4~10范围内,pH越大,红纸褪色
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如
 气体就是一种新型高效含氯消毒剂。
气体就是一种新型高效含氯消毒剂。①一种制备
 的方法是用
的方法是用 通入硫酸酸化的
通入硫酸酸化的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为②另一种制备
 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 体积约占
体积约占 ,每生成
,每生成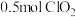 ,转移
,转移 。
。③
 在杀菌消毒过程中会产生副产物亚氯酸盐
在杀菌消毒过程中会产生副产物亚氯酸盐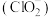 ,需将其转化为
,需将其转化为 除去。下列试剂中,可将
除去。下列试剂中,可将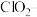 转化为
转化为 的是
的是a.
 b.
b. c.
c. d.KI
d.KI
您最近一年使用:0次
2023-01-07更新
|
450次组卷
|
2卷引用:北京市第八中学2022-2023学年高一上学期期末考试化学试题
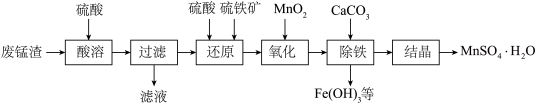
6 . 用废锰渣(主要成分为MnO2、MgO和Fe2O3)和硫铁矿(主要成分FeS2)制取MnSO4·H2O的工艺流程如下:___________ 。
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Mn(OH)2]=2×10-13,“氧化”后溶液中c(Mn2+)=0.2mol·L-1。
①欲使溶液中c(Fe3+)<10-5mol·L-1,“除铁”过程需控制溶液pH的范围是___________ 。
②写出“除铁”过程中生成Fe(OH)3反应的化学方程式:___________ 。
(3)氧化后溶液的Fe3+还可用P204(一种有机萃取剂,密度比水小)萃取除去,实验装置如图所示,从图示装置中得到Mn2+水溶液的实验操作方法是___________ 。 ,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数
,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数___________ 。(写出详细计算过程)。
C2O 发生的反应为
发生的反应为 (未配平)。
(未配平)。
②若实验测定MnSO4·H2O样品的纯度大于100%,可能的原因是___________ (忽略操作过程中的误差)。
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Mn(OH)2]=2×10-13,“氧化”后溶液中c(Mn2+)=0.2mol·L-1。
①欲使溶液中c(Fe3+)<10-5mol·L-1,“除铁”过程需控制溶液pH的范围是
②写出“除铁”过程中生成Fe(OH)3反应的化学方程式:
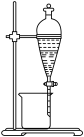
(3)氧化后溶液的Fe3+还可用P204(一种有机萃取剂,密度比水小)萃取除去,实验装置如图所示,从图示装置中得到Mn2+水溶液的实验操作方法是
 ,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数
,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数C2O
 发生的反应为
发生的反应为 (未配平)。
(未配平)。②若实验测定MnSO4·H2O样品的纯度大于100%,可能的原因是
您最近一年使用:0次
2023-06-05更新
|
432次组卷
|
3卷引用:江苏省扬州中学2023届高三下学期考前练习化学试题
名校
7 . 二氧化氯( )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: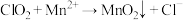 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: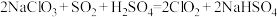 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
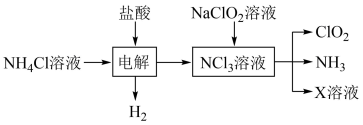
已知: 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法不 正确的是
 )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: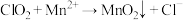 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: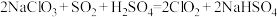 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
已知:
 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法A. 的空间构型为三角锥形 的空间构型为三角锥形 |
B.电解池中总反应的化学方程式为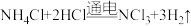 |
C.X溶液中主要存在的离子有: 、 、 、 、 |
D.饮用水制备过程中残留的 可用适量 可用适量 溶液去除 溶液去除 |
您最近一年使用:0次
2021-11-19更新
|
1346次组卷
|
4卷引用:江苏省无锡市2021-2022学年高三上学期期中教学质量调研测试化学试题
解题方法
8 . 化学实验中,如使某步反应中的有害产物作为另一步反应的反应物,形成一个循环,就可不再向环境排放该种有害物质。如图所示。
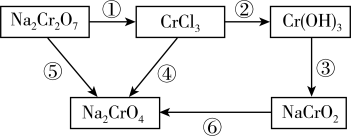
(1)配平反应方程式并回答问题,用单线桥标出两个反应的电子转移的方向和数目。
反应①: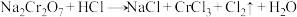 ,
,__________ ,氧化剂为__________ (填化学式,后同),氧化产物为__________ 。
反应⑥: ,
,__________ ,还原剂为__________ ,还原产物为__________ 。
(2)在上述有编号的步骤中,除了①⑥外,还需用到氧化剂的步骤是__________ (填编号)。

(1)配平反应方程式并回答问题,用单线桥标出两个反应的电子转移的方向和数目。
反应①:
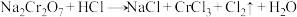 ,
,反应⑥:
 ,
,(2)在上述有编号的步骤中,除了①⑥外,还需用到氧化剂的步骤是
您最近一年使用:0次
2020-09-23更新
|
1598次组卷
|
5卷引用:高一必修第一册(鲁科2019)第2章 章末综合检测卷
高一必修第一册(鲁科2019)第2章 章末综合检测卷人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 方法帮高一必修第一册(苏教2019)专题4 第二单元 硫及其化合物的相互转化1(已下线)第05讲 氧化还原反应(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)第05讲 氧化还原反应(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )
9 . 从废旧磷酸铁锂电极材料(LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图,下列说法错误的是
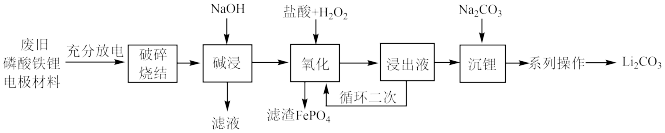
| A.旧电池拆解前进行充分放电是因为放电可使Li+在负极富集 |
| B.“氧化”时,H2O2可用KClO3代替 |
| C.“氧化”时发生的化学反应方程式为:2LiFePO4+H2O2+2HCl=2LiCl+2FePO4+2H2O |
| D.“系列操作”具体包括水浴加热、趁热过滤、洗涤、干燥 |
您最近一年使用:0次
2024-03-21更新
|
393次组卷
|
3卷引用:山东省济宁市2024届高三下学期一模考试化学试题
名校
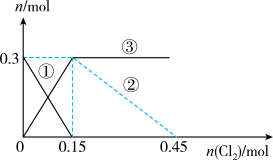
10 . 向100mL
 溶液中逐渐通入
溶液中逐渐通入 ,其中
,其中 、
、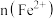 、
、 随通入
随通入 的物质的量
的物质的量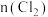 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是

 溶液中逐渐通入
溶液中逐渐通入 ,其中
,其中 、
、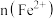 、
、 随通入
随通入 的物质的量
的物质的量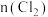 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是
A.②代表 ,③代表 ,③代表 |
B.还原性强弱: |
C. 时,溶液中 时,溶液中 |
D.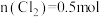 时,总的离子方程式为: 时,总的离子方程式为: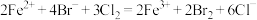 |
您最近一年使用:0次
2023-01-04更新
|
402次组卷
|
2卷引用:湖北省荆州市八县市2022-2023学年高一上学期期末联考化学试题



