解题方法
1 . I.A、B、C、D、E为中学常见化学物质,它们之间可发生如图所示的转化,反应条件和部分产物已略去。其中A、C、E含有同一种元素X;A、D是常见金属单质,B是一种黄绿色气体。
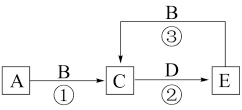
(1)物质B的化学式为_______ ;物质C中元素X的价态为_______ 。
(2)反应②可用于蚀刻铜电路板,其化学方程式为_______ 。
II.高铁酸钠是钠的六价铁酸盐,化学式为 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
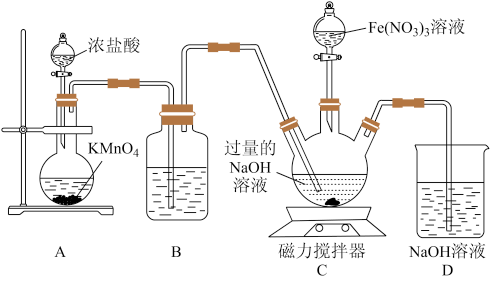
(3)装置A中,盛装浓盐酸的仪器名称为_______ ;若不考虑本实验条件限制,制备 时还可以将
时还可以将 替换为
替换为_______ (写出一种即可)。
(4)装置B中盛装液体的作用为_______ 。
(5)先向装置C的三颈烧瓶中通入一段时间 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。

(1)物质B的化学式为
(2)反应②可用于蚀刻铜电路板,其化学方程式为
II.高铁酸钠是钠的六价铁酸盐,化学式为
 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(3)装置A中,盛装浓盐酸的仪器名称为
 时还可以将
时还可以将 替换为
替换为(4)装置B中盛装液体的作用为
(5)先向装置C的三颈烧瓶中通入一段时间
 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为
您最近一年使用:0次
2 . 某同学做实验时白色衣服上沾了一些KMnO4,产生褐色斑点,如果用草酸(H2C2O4)的稀溶液洗涤马上可以复原,其离子方程式为: +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
 +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是| A.该反应的氧化产物是Mn2+ |
| B.离子方程式横线上的生成物是OH- |
| C.配平离子方程式,H+的计量数是6 |
| D.标准状况下,有5.6 LCO2生成时,转移电子的物质的量为0.5 mol |
您最近一年使用:0次
解题方法
3 . 下列过程对应的离子反应方程式书写正确的是
A. 溶液与过量澄清石灰水混合: 溶液与过量澄清石灰水混合: |
B.明矾溶液与过量氨水混合: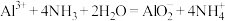 |
C.用 溶液吸收少量 溶液吸收少量 : : |
D.向水垢中滴加足量醋酸: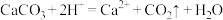 |
您最近一年使用:0次
2023-02-24更新
|
382次组卷
|
2卷引用:辽宁省葫芦岛市2022-2023学年高三上学期期末学业质量监测化学试题
名校
解题方法
4 . 下列化学反应表示正确的是
| A.向碘化钾中通入过量氯气:2I- + Cl2 = 2Cl- + I2 |
| B.向稀硝酸中加入过量铁粉:3Fe + 8HNO3=3Fe(NO3)2 + 2NO↑ +4H2O |
| C.氯化亚铁溶液中加入少量过氧化钠:4Fe2+ + 4Na2O2 + 6H2O =4Fe(OH)3↓ + 8Na+ + O2↑ |
D.硫酸铵溶液和氢氧化钡溶液反应:NH + SO + SO + Ba2+ + OH−= BaSO4↓+NH3·H2O + Ba2+ + OH−= BaSO4↓+NH3·H2O |
您最近一年使用:0次
名校
解题方法
5 . 正高碘酸(H5IO6)是白色结晶性粉末,溶于水,主要用作氧化剂和分析试剂。由NaI制取H5IO6的实验流程如图所示:
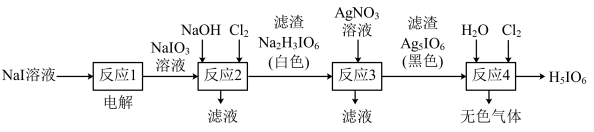
下列说法正确的是

下列说法正确的是
A.电解过程中阳极反应为:I-+6OH--6e-=IO +3H2O +3H2O |
| B.“反应2”中Cl2与NaIO3的物质的量之比为1∶1 |
| C.“反应3”的滤液中含有NaNO3,NaI等 |
| D.“反应4”为非氧化还原反应 |
您最近一年使用:0次
2022-12-17更新
|
191次组卷
|
3卷引用:辽宁省锦州市渤大附中2022-2023学年高三上学期期末考试化学试题
名校
解题方法
6 . 能正确表示下列反应的离子方程式的是
| A.向CuSO4溶液中加入金属钠:2Na+Cu2+=2Na++Cu |
B.向高锰酸钾溶液中滴加双氧水:2Mn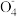 +3H2O2+6H+=2Mn2++4O2↑+6H2O +3H2O2+6H+=2Mn2++4O2↑+6H2O |
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使S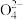 完全沉淀:N 完全沉淀:N +Al3++2S +Al3++2S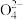 +2Ba2++4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ +2Ba2++4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.氢氧化铁与氢碘酸反应:Fe(OH)3+3H+=Fe3++3H2O |
您最近一年使用:0次
2022-12-13更新
|
171次组卷
|
3卷引用:辽宁省锦州市渤大附中2022-2023学年高三上学期期末考试化学试题
7 . 在高温高压的水溶液中,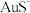 与
与 发生反应沉积出磁铁矿(主要成分
发生反应沉积出磁铁矿(主要成分 )和金矿(含单质
)和金矿(含单质 ),且硫元素全部转化为
),且硫元素全部转化为 气体放出。对于该反应的说法一定正确的是
气体放出。对于该反应的说法一定正确的是
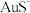 与
与 发生反应沉积出磁铁矿(主要成分
发生反应沉积出磁铁矿(主要成分 )和金矿(含单质
)和金矿(含单质 ),且硫元素全部转化为
),且硫元素全部转化为 气体放出。对于该反应的说法一定正确的是
气体放出。对于该反应的说法一定正确的是A.反应后溶液的 降低 降低 | B.每生成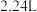 气体,转移电子数为 气体,转移电子数为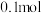 |
C. 既作氧化剂又作还原剂 既作氧化剂又作还原剂 | D.氧化剂和还原剂的物质的量之比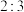 |
您最近一年使用:0次
2022-12-10更新
|
135次组卷
|
2卷引用:辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题
名校
解题方法
8 . 室温下,通过下列实验探究0.01000 mo/L  溶液的性质:
溶液的性质:
实验1:实验测得0.01000 mol/L 溶液pH为8.6
溶液pH为8.6
实验2:向溶液中滴加等体积0.01000 mol/L HCl溶液,pH由8.6降为4.8
实验3:向溶液中加入等体积0.0200 mo/L 溶液,出现白色沉淀
溶液,出现白色沉淀
实验4:向稀硫酸酸化的 溶液中滴加
溶液中滴加 溶液至溶液褪色
溶液至溶液褪色
下列说法不正确的是
 溶液的性质:
溶液的性质:实验1:实验测得0.01000 mol/L
 溶液pH为8.6
溶液pH为8.6实验2:向溶液中滴加等体积0.01000 mol/L HCl溶液,pH由8.6降为4.8
实验3:向溶液中加入等体积0.0200 mo/L
 溶液,出现白色沉淀
溶液,出现白色沉淀实验4:向稀硫酸酸化的
 溶液中滴加
溶液中滴加 溶液至溶液褪色
溶液至溶液褪色下列说法不正确的是
A.0.0100   溶液中满足: 溶液中满足: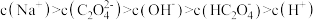 |
B.实验2滴加盐酸过程中存在某一点满足: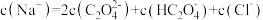 |
C.实验3所得上层清液中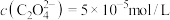 [已知室温时 [已知室温时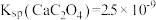 ] ] |
D.实验4发生反应的离子方程式为: |
您最近一年使用:0次
2022-09-02更新
|
601次组卷
|
5卷引用:辽宁省沈阳市五校协作体2021-2022学年高二上学期期末联考化学试题
解题方法
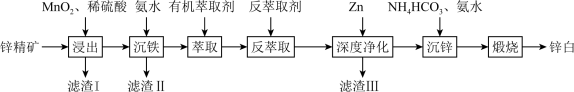
9 . 氧化锌又称锌白,作为添加剂在多种材料和产品中有广泛应用,一种以锌精矿(主要成分是ZnS,还有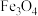 、CuO、
、CuO、 等杂质)为原料制备锌白的工艺流程如下:
等杂质)为原料制备锌白的工艺流程如下:
已知:25℃时相关物质的 如下表:
如下表:
回答下列问题:
(1)滤渣Ⅰ的主要成分除过量 外,还有S和
外,还有S和_______ (填化学式)。“浸出”时, 氧化ZnS的离子方程式为
氧化ZnS的离子方程式为_______ 。
(2)“沉铁”时,滴加氨水需要调节pH最低为_______ (通常认为残留在溶液中离子浓度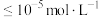 时,沉淀完全)。
时,沉淀完全)。
(3)“萃取,反萃取”时发生的反应是 。有机萃取剂能分离
。有机萃取剂能分离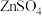 和
和 ,为了提高反萃取效率,反萃取剂应该呈
,为了提高反萃取效率,反萃取剂应该呈_______ (填“酸”“碱”或“中”)性。
(4)“深度净化”中加Zn的目的是_______ 。
(5)“沉锌”时,恰好完全反应,过滤、洗涤得到碱式碳酸锌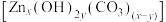 ,反应的离子方程式为
,反应的离子方程式为_______ 。检验沉淀洗涤干净的方法是_______ 。
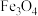 、CuO、
、CuO、 等杂质)为原料制备锌白的工艺流程如下:
等杂质)为原料制备锌白的工艺流程如下:
已知:25℃时相关物质的
 如下表:
如下表:| 物质 |  |  |  | 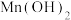 |  |
 | 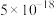 | 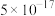 | 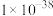 | 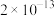 |  |
(1)滤渣Ⅰ的主要成分除过量
 外,还有S和
外,还有S和 氧化ZnS的离子方程式为
氧化ZnS的离子方程式为(2)“沉铁”时,滴加氨水需要调节pH最低为
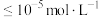 时,沉淀完全)。
时,沉淀完全)。(3)“萃取,反萃取”时发生的反应是
 。有机萃取剂能分离
。有机萃取剂能分离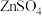 和
和 ,为了提高反萃取效率,反萃取剂应该呈
,为了提高反萃取效率,反萃取剂应该呈(4)“深度净化”中加Zn的目的是
(5)“沉锌”时,恰好完全反应,过滤、洗涤得到碱式碳酸锌
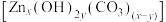 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
解题方法
10 . 某校化学实验小组学生为了验证非金属元素氯的非金属性强于硫和氮,设计了一套实验装置如图(已知氯气能把氨气氧化生成氮气和氯化氢)。
(1)配平A中反应的化学方程式:_______ _______HCl(浓)+_______KMnO4=_______MnCl2+_______KCl+_______Cl2↑+_______ H2O。该反应中氧化剂与还原剂物质的量之比为_______ 。
(2)B中浸有NaOH溶液的棉花团的作用为_______ ;B中的现象为_______ ,由该现象得非金属性:Cl>>S。
(3)E中反应化学方程式为_______ 。
(4)D中出现白烟,涉及的反应化学方程式为_______ 、_______ 。
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为_______ (填名称)。
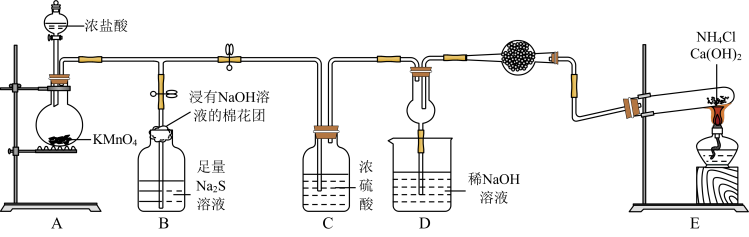
(1)配平A中反应的化学方程式:
(2)B中浸有NaOH溶液的棉花团的作用为
(3)E中反应化学方程式为
(4)D中出现白烟,涉及的反应化学方程式为
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为
您最近一年使用:0次
2022-07-14更新
|
299次组卷
|
3卷引用:辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题
辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题黑龙江省齐齐哈尔市八校联考2022-2023学年高一下学期期末考试化学试题(已下线)专题01 硫、氮、硅及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)



