解题方法
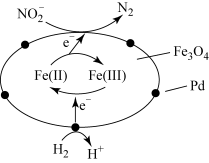
1 . 在催化剂作用下,H2可处理废水中的NO ,反应原理如图所示。下列说法错误的是
,反应原理如图所示。下列说法错误的是
 ,反应原理如图所示。下列说法错误的是
,反应原理如图所示。下列说法错误的是
| A.Fe3O4具有传递电子的作用 |
| B.Pd和Fe3O4均是该过程的催化剂 |
| C.处理后的废水中酸性增强 |
D.每消耗67.2L(标准状况下)H2,可还原2molNO |
您最近一年使用:0次
2 . 化学上常用标准电极电势数据φθ(氧化型/还原型)比较物质氧化能力。φθ值越高,氧化型物质氧化能力越强,φθ值与体系pH有关。利用表格所给数据分析,以下说法错误的是
| 氧化型/还原型 | φθ(Co3+/Co2+) | φθ(HClO/Cl— |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φθ[Co(OH)3/Co(OH)2] | φθ(ClO—/Cl—) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
2022-02-22更新
|
2303次组卷
|
14卷引用:辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题
辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题辽宁省大连市第二十四中学2023-2024学年高一上学期第二次统测化学试卷 河南省信阳市2022届高三第二次质量检测化学试题(已下线)专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题04氧化还原反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-三年(2020~2022)高考真题汇编(全国卷)湖南省长沙市雅礼中学2021-2022学年高三下学期5月模拟考试(二)化学试题(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题广东省广州市真光中学2022-2023学年高一上学期期中考化学试题湖南省株洲市九方中学2022-2023学年高一上学期期中考试化学试题河北省衡水中学2023届高三上学期三调考试化学试题 浙江省杭州第十四中学2023-2024学年高一上学期期中阶段性测试化学试题
名校
解题方法
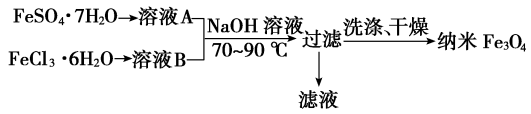
3 . 纳米级四氧化三铁是应用最为广泛的软磁性材料之一。 共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图所示:
下列说法错误的是

下列说法错误的是
| A.该制备反应类型不属于氧化还原反应 |
| B.共沉淀法中FeSO4·7H2O和FeCl3·6H2O的物质的量之比最好应为1:2 |
| C.若滤液进行焰色反应,火焰为黄色则说明氢氧化钠过量了 |
D.另一种水热法制备Fe3O4纳米颗粒的反应3Fe2++2S2O +O2+xOH-=Fe3O4↓+S4O +O2+xOH-=Fe3O4↓+S4O +2H2O每消耗3 molOH-,则有1.5 mol Fe2+被氧化 +2H2O每消耗3 molOH-,则有1.5 mol Fe2+被氧化 |
您最近一年使用:0次
2022-01-23更新
|
1016次组卷
|
6卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
名校
解题方法
4 . 从废旧铅蓄电池铅膏(含 和
和 等)中回收铅的工艺流程如下:
等)中回收铅的工艺流程如下:

下列说法错误的是
 和
和 等)中回收铅的工艺流程如下:
等)中回收铅的工艺流程如下:
下列说法错误的是
A.流程中 作氧化剂 作氧化剂 |
B.向废铅膏中加入 和 和 后,溶液温度不宜过高 后,溶液温度不宜过高 |
C.“滤液”中溶质主要是 |
| D.电解时,阳极、阴极材料可分别用石墨、铅 |
您最近一年使用:0次
解题方法
5 . 面对新冠病毒,VB空气防护卡也成了“网红”,成为人们讨论的话题。商品介绍卡片中含有的主要活性成分——亚氯酸钠,在接触空气时可以释放安全可靠的低浓度二氧化氯( ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
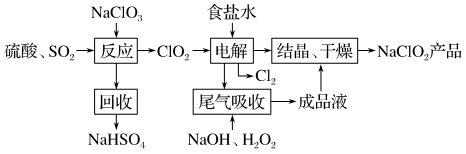
回答下列问题:
(1)写出“反应”步骤中生成 的化学反应方程式:
的化学反应方程式:_______ 。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 、
、 、
、 ,要加入的试剂分别为
,要加入的试剂分别为_______ 、_______ 、_______ ,为得到纯净的NaCl溶液还需加入_______ (以上填写相应物质的化学式)。
(3)“电解”产生的 可用于工业制漂白液,写出离子反应方程式:
可用于工业制漂白液,写出离子反应方程式:_______ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为_______ ,该反应中还原产物是_______ 。
(5)有同学推测VB空气防护卡原理是因为 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:_______ 。
 ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
回答下列问题:
(1)写出“反应”步骤中生成
 的化学反应方程式:
的化学反应方程式:(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 、
、 、
、 ,要加入的试剂分别为
,要加入的试剂分别为(3)“电解”产生的
 可用于工业制漂白液,写出离子反应方程式:
可用于工业制漂白液,写出离子反应方程式:(4)“尾气吸收”是吸收“电解”过程排出的少量
 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为(5)有同学推测VB空气防护卡原理是因为
 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:
您最近一年使用:0次
2022-01-19更新
|
504次组卷
|
2卷引用:辽宁省五校2021-2022学年高一上学期期末联考化学试题
解题方法
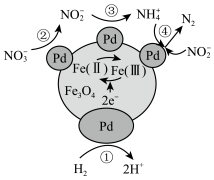
6 . 采用 双催化剂,可实现用
双催化剂,可实现用 消除酸性废水中的致癌阴离子
消除酸性废水中的致癌阴离子 、
、 ,
, 中Fe元素的两种价态分别表示为Fe(Ⅱ)、Fe(Ⅲ),其反应历程如图所示。下列说法错误的是
中Fe元素的两种价态分别表示为Fe(Ⅱ)、Fe(Ⅲ),其反应历程如图所示。下列说法错误的是
 双催化剂,可实现用
双催化剂,可实现用 消除酸性废水中的致癌阴离子
消除酸性废水中的致癌阴离子 、
、 ,
, 中Fe元素的两种价态分别表示为Fe(Ⅱ)、Fe(Ⅲ),其反应历程如图所示。下列说法错误的是
中Fe元素的两种价态分别表示为Fe(Ⅱ)、Fe(Ⅲ),其反应历程如图所示。下列说法错误的是
| A.反应历程中Fe(Ⅱ)与Fe(Ⅲ)总物质的量不变 |
B.过程②发生的反应为: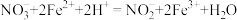 |
C.过程①中产生0.5mol 则消除46g 则消除46g |
| D.用该法处理后废水的酸性也会变弱 |
您最近一年使用:0次
名校
7 . 磁性纳米四氧化三铁在催化剂、 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
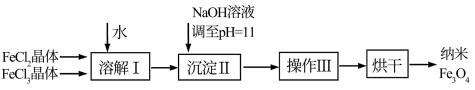
(1)Ⅱ中的反应温度需控制在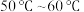 之间,生成
之间,生成 的离子方程式是
的离子方程式是_______ 。
(2)操作Ⅲ分离 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、_______ 、_______ 。
(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为_______ 。但实际操作时,却很难控制这一比例,原因是_______ 。
(4)经过多次实验发现,当混合溶液中 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全_______ 。
(5)以太阳能为热源分解 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
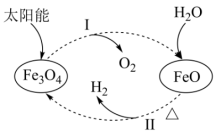
①下列叙述正确的是_______ (填字母)。
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中 为氧化剂
为氧化剂
C.过程中的 为碱性氧化物
为碱性氧化物
D.铁氧化合物循环制 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点
②请写出反应Ⅱ对应的化学方程式_______ 。
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: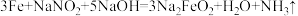 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。
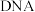 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
(1)Ⅱ中的反应温度需控制在
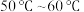 之间,生成
之间,生成 的离子方程式是
的离子方程式是(2)操作Ⅲ分离
 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米
 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为(4)经过多次实验发现,当混合溶液中
 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全(5)以太阳能为热源分解
 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
①下列叙述正确的是
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中
 为氧化剂
为氧化剂C.过程中的
 为碱性氧化物
为碱性氧化物D.铁氧化合物循环制
 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点②请写出反应Ⅱ对应的化学方程式
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成
 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: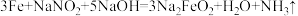 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。A. 的氧化性大于 的氧化性大于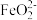 的氧化性 的氧化性 |
B.反应中转移电子 ,则生成还原产物 ,则生成还原产物 |
| C.枪支“发蓝”实质上是使铁表面钝化生成致密保护层导致难以生锈 |
D.上述反应中,若有 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) |
您最近一年使用:0次
2022-01-19更新
|
286次组卷
|
2卷引用:辽宁省抚顺市六校协作体2021-2022学年高一上学期期末考试化学试题
解题方法
8 . 下列反应对应的离子方程式正确的是
A.将 溶液与酸性 溶液与酸性 溶液混合: 溶液混合: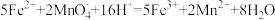 |
B.向稀硫酸中加入少量氧化亚铁: |
C.向稀盐酸中加入少量铁粉: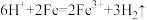 |
D.向氢氧化钠稀溶液中加入适量的铝片: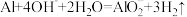 |
您最近一年使用:0次
解题方法
9 . 研究氮的循环和转化对生产、生活有重要的价值。
I.(1)实验室制备氨气的收集方法为___________ 。
Ⅱ.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
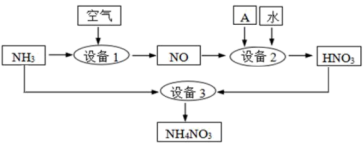
(2)设备1中发生反应的化学方程式为___________ ,设备2中通入的物质A是___________ 。
Ⅲ.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如下:
的形式存在。某工厂处理氨氮废水的流程如下:
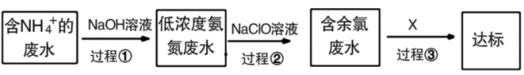
(3)过程①的目的是将 转化为
转化为 ,并通过鼓入大量空气将氨气吹出,写出
,并通过鼓入大量空气将氨气吹出,写出 转化为
转化为 的离子方程式
的离子方程式___________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质的化学式分别为___________ 、___________ 。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)___________ 。
a.KOH b. c.
c. d.NaCl
d.NaCl
I.(1)实验室制备氨气的收集方法为
Ⅱ.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。

(2)设备1中发生反应的化学方程式为
Ⅲ.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如下:
的形式存在。某工厂处理氨氮废水的流程如下:
(3)过程①的目的是将
 转化为
转化为 ,并通过鼓入大量空气将氨气吹出,写出
,并通过鼓入大量空气将氨气吹出,写出 转化为
转化为 的离子方程式
的离子方程式(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质的化学式分别为
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)
a.KOH b.
 c.
c. d.NaCl
d.NaCl
您最近一年使用:0次
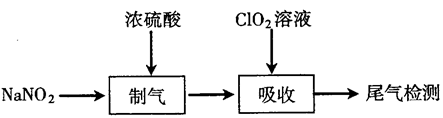
10 . 为探索稳定性 溶液对氮氧化物(
溶液对氮氧化物( )的处理效果,实验过程如下:
)的处理效果,实验过程如下:
已知: 具有强氧化性,且氧化性随着溶液的酸性增强而增强。
具有强氧化性,且氧化性随着溶液的酸性增强而增强。 和NaOH反应的化学方程式为:
和NaOH反应的化学方程式为: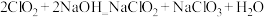 。
。 对氮氧化物具有强吸收效果。
对氮氧化物具有强吸收效果。
(1)“制气”阶段生成 、NO和
、NO和 。“制气”反应的化学方程式为
。“制气”反应的化学方程式为___________ 。
(2) 可以将NO氧化为
可以将NO氧化为 ,并进一步将
,并进一步将 氧化为
氧化为 ,
, 则被还原为
则被还原为 。吸收时,
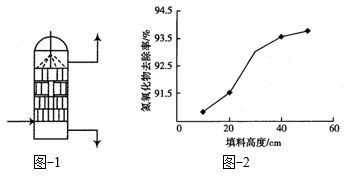
。吸收时, 溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。
溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。 的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
① 和
和 反应的离子方程式为
反应的离子方程式为___________ 。
②随着吸收器内填料高度增加, 去除率增高的原因是
去除率增高的原因是___________ 。
(3)通过加入盐酸或NaOH调节 溶液的pH,测得不同pH的
溶液的pH,测得不同pH的 溶液对
溶液对 吸收率的影响如图-3所示。
吸收率的影响如图-3所示。
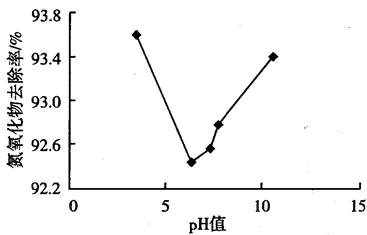
①当pH小于7时, 吸收率随pH增大而减小的原因是
吸收率随pH增大而减小的原因是___________ 。
②当pH大于7时, 吸收率随pH增大而增大的原因是
吸收率随pH增大而增大的原因是___________ 。
 溶液对氮氧化物(
溶液对氮氧化物( )的处理效果,实验过程如下:
)的处理效果,实验过程如下:
已知:
 具有强氧化性,且氧化性随着溶液的酸性增强而增强。
具有强氧化性,且氧化性随着溶液的酸性增强而增强。 和NaOH反应的化学方程式为:
和NaOH反应的化学方程式为: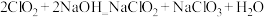 。
。 对氮氧化物具有强吸收效果。
对氮氧化物具有强吸收效果。(1)“制气”阶段生成
 、NO和
、NO和 。“制气”反应的化学方程式为
。“制气”反应的化学方程式为(2)
 可以将NO氧化为
可以将NO氧化为 ,并进一步将
,并进一步将 氧化为
氧化为 ,
, 则被还原为
则被还原为 。吸收时,
。吸收时, 溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。
溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。 的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
①
 和
和 反应的离子方程式为
反应的离子方程式为②随着吸收器内填料高度增加,
 去除率增高的原因是
去除率增高的原因是(3)通过加入盐酸或NaOH调节
 溶液的pH,测得不同pH的
溶液的pH,测得不同pH的 溶液对
溶液对 吸收率的影响如图-3所示。
吸收率的影响如图-3所示。
①当pH小于7时,
 吸收率随pH增大而减小的原因是
吸收率随pH增大而减小的原因是②当pH大于7时,
 吸收率随pH增大而增大的原因是
吸收率随pH增大而增大的原因是
您最近一年使用:0次
2021-06-27更新
|
469次组卷
|
2卷引用:辽宁省葫芦岛市普通高中2021-2022学年高一下学期期末学业质量监测化学试题



