解题方法
1 . 实验室利用SO2制备少量Na2SO3并检验其性质。

(1)ⅰ中发生反应的化学方程式为_____ ,体现了浓硫酸的_____ 性质。
(2)能够说明 具有漂白作用的实验现象为
具有漂白作用的实验现象为_____ 。
(3)取ⅳ中溶液分装在三支试管中,进行相关实验并记录现象如下:
①A中发生反应的离子方程式为_____
②甲同学为证明 和
和 能够反应,进行如下操作:取
能够反应,进行如下操作:取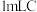 中溶液于试管中,先滴加足量
中溶液于试管中,先滴加足量_____ (填化学式,下同)溶液,再滴加少量_____ 溶液,产生白色沉淀,说明有 生成,故甲同学认为二者发生了反应:乙同学认为甲同学的实验方案有缺陷,你认为该缺陷可能为
生成,故甲同学认为二者发生了反应:乙同学认为甲同学的实验方案有缺陷,你认为该缺陷可能为_____ 。
(4)小组同学设计实验测定某葡萄酒中的含硫量(以 计):将100mL葡萄酒和足量硫酸共热,使
计):将100mL葡萄酒和足量硫酸共热,使 全部逸出并与
全部逸出并与 完全反应;除去过量的
完全反应;除去过量的 后,向混合溶液中滴加
后,向混合溶液中滴加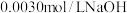 标准溶液,恰好完全反应时消耗
标准溶液,恰好完全反应时消耗 标准溶液
标准溶液 。据此计算,该葡萄酒中
。据此计算,该葡萄酒中 的含量为
的含量为_____ 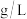 。
。

(1)ⅰ中发生反应的化学方程式为
(2)能够说明
 具有漂白作用的实验现象为
具有漂白作用的实验现象为(3)取ⅳ中溶液分装在三支试管中,进行相关实验并记录现象如下:
| 试管 | A | B | C |
| 所加试剂 | 酸性 溶液 溶液 |  溶液 溶液 | 双氧水 |
| 现象 | 紫红色溶液日褪色 | 产生淡黄色沉淀 | 无明显现象 |
②甲同学为证明
 和
和 能够反应,进行如下操作:取
能够反应,进行如下操作:取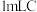 中溶液于试管中,先滴加足量
中溶液于试管中,先滴加足量 生成,故甲同学认为二者发生了反应:乙同学认为甲同学的实验方案有缺陷,你认为该缺陷可能为
生成,故甲同学认为二者发生了反应:乙同学认为甲同学的实验方案有缺陷,你认为该缺陷可能为(4)小组同学设计实验测定某葡萄酒中的含硫量(以
 计):将100mL葡萄酒和足量硫酸共热,使
计):将100mL葡萄酒和足量硫酸共热,使 全部逸出并与
全部逸出并与 完全反应;除去过量的
完全反应;除去过量的 后,向混合溶液中滴加
后,向混合溶液中滴加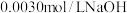 标准溶液,恰好完全反应时消耗
标准溶液,恰好完全反应时消耗 标准溶液
标准溶液 。据此计算,该葡萄酒中
。据此计算,该葡萄酒中 的含量为
的含量为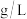 。
。
您最近一年使用:0次
解题方法
2 . 下列离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液: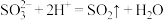 |
B.向Na2SiO3溶液中通入过量SO2: |
C.铅酸蓄电池放电时的正极反应: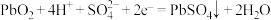 |
D.Fe3O4和足量稀硝酸反应: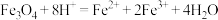 |
您最近一年使用:0次
名校
解题方法
3 . 污水处理厂处理含CN-废水的过程分两步进行:①向含CN-的废水中加入过量NaC1O将CN-转化为CNO-;②调节①所得溶液为酸性,使CNO-继续被NaC1O转化为两种无污染的气体。下列关于上述过程的叙述错误的是
A.CN-的电子式为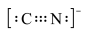 |
| B.过程①中,生成CNO-的反应中氧化剂与还原剂的物质的量之比为1:1 |
| C.过程②中,生成的两种无污染的气体为CO2和N2 |
| D.氧化性:CNO-<C1O- |
您最近一年使用:0次
2023-08-28更新
|
174次组卷
|
2卷引用:辽宁省沈阳市第二中学2023-2024学年高三上学期开学暑假阶段验收化学测试题
4 . 目前, 催化还原除去
催化还原除去 是一种非常有效的方法,发生的反应为:
是一种非常有效的方法,发生的反应为: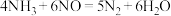 ,下列说法正确的是
,下列说法正确的是
 催化还原除去
催化还原除去 是一种非常有效的方法,发生的反应为:
是一种非常有效的方法,发生的反应为: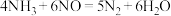 ,下列说法正确的是
,下列说法正确的是| A.反应过程中有非极性共价键的断裂与生成 |
B. 在反应过程中失去电子数目为 在反应过程中失去电子数目为 |
C.还原剂与氧化剂的物质的量之比为 |
D. 是氧化产物, 是氧化产物, 是还原产物 是还原产物 |
您最近一年使用:0次
2023-07-05更新
|
212次组卷
|
2卷引用:辽宁普通高中2023-2024学年高一下学期开学考试化学试题
名校
解题方法
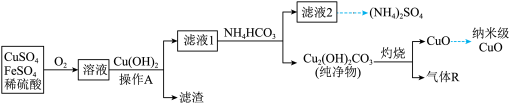
5 . 某酸性废水中含有大量的 和少量
和少量 ,利用该废水为原料制备纳米级
,利用该废水为原料制备纳米级 的流程如图:
的流程如图:
下列说法正确的是
 和少量
和少量 ,利用该废水为原料制备纳米级
,利用该废水为原料制备纳米级 的流程如图:
的流程如图:
下列说法正确的是
A.通 发生的反应: 发生的反应: |
B.流程中 可用 可用 替代 替代 |
C.开始向滤液1中加入 时,观察到有少量气泡产生,该气体为 时,观察到有少量气泡产生,该气体为 |
| D.该流程中使用了漏斗、玻璃棒、酒精灯、坩埚和分液漏斗等 |
您最近一年使用:0次
2023-05-04更新
|
365次组卷
|
2卷引用:辽宁省六校2023-2024学年高三上学期期初考试化学试题
名校
6 . 已知固体 受热分解生成两种正盐,实验流程和结果如下:
受热分解生成两种正盐,实验流程和结果如下:
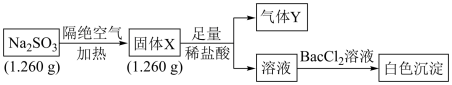
已知:气体Y是一种纯净物,在标准状况下密度为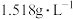 。请回答下列问题:
。请回答下列问题:
(1)气体Y的电子式为_______ 。
(2)实验流程中, 受热分解的化学方程式为
受热分解的化学方程式为_______ 。
(3)另取固体X试样和 混合,加适量蒸馏水溶解,再加入稀盐酸,立即有淡黄色沉淀产生。则产生淡黄色沉淀的离子方程式为
混合,加适量蒸馏水溶解,再加入稀盐酸,立即有淡黄色沉淀产生。则产生淡黄色沉淀的离子方程式为_______ (不考虑空气的影响))。
(4) 长期露置在空气中,会被氧化成
长期露置在空气中,会被氧化成 ,检验
,检验 是否变质的实验操作是
是否变质的实验操作是_______ 。
 受热分解生成两种正盐,实验流程和结果如下:
受热分解生成两种正盐,实验流程和结果如下:
已知:气体Y是一种纯净物,在标准状况下密度为
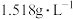 。请回答下列问题:
。请回答下列问题:(1)气体Y的电子式为
(2)实验流程中,
 受热分解的化学方程式为
受热分解的化学方程式为(3)另取固体X试样和
 混合,加适量蒸馏水溶解,再加入稀盐酸,立即有淡黄色沉淀产生。则产生淡黄色沉淀的离子方程式为
混合,加适量蒸馏水溶解,再加入稀盐酸,立即有淡黄色沉淀产生。则产生淡黄色沉淀的离子方程式为(4)
 长期露置在空气中,会被氧化成
长期露置在空气中,会被氧化成 ,检验
,检验 是否变质的实验操作是
是否变质的实验操作是
您最近一年使用:0次
2023-03-05更新
|
210次组卷
|
2卷引用:辽宁省沈阳市第一二〇中学2022-2023学年高一下学期期初质量监测化学试题
名校
解题方法
7 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
(1) 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:

①生成 的化学方程式是
的化学方程式是______ 。
② 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为______ ,生成标准状况下33.6 L气体,转移电子数为______ 。
③样液中加入 后产生能使带火星木条复燃的气体,说明
后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
与水反应的过程中还生成了______ (化学式)。
④滤液中加入 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有
样品中含有______ 杂质,生成白色沉淀的离子方程式是______ 。
(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
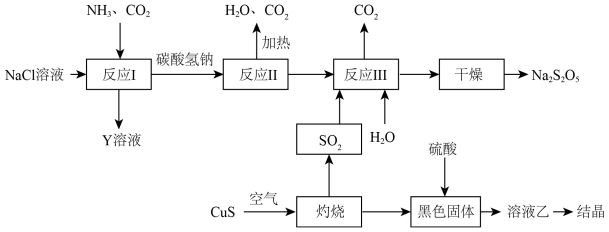
①反应I反应的化学方程式是______ 。
②关于该流程,下列说法正确的是______ (填字母)
a.反应反应I中应先通入 ,再通入
,再通入
b.反应II属于氧化还原反应
c.该流程中, 可以循环使用
可以循环使用
d.溶液乙的结晶产物是硫酸铜晶体
③反应III包含多步反应:
第一步:……
第二步: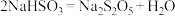
为了减少产品 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为______ 。
(3)已知 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为______ 。
(1)
 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:
①生成
 的化学方程式是
的化学方程式是②
 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为③样液中加入
 后产生能使带火星木条复燃的气体,说明
后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
与水反应的过程中还生成了④滤液中加入
 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有
样品中含有(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠(
 ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
①反应I反应的化学方程式是
②关于该流程,下列说法正确的是
a.反应反应I中应先通入
 ,再通入
,再通入
b.反应II属于氧化还原反应
c.该流程中,
 可以循环使用
可以循环使用d.溶液乙的结晶产物是硫酸铜晶体
③反应III包含多步反应:
第一步:……
第二步:
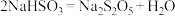
为了减少产品
 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为(3)已知
 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2023-02-09更新
|
882次组卷
|
3卷引用:辽宁省沈阳市第一二〇中学2022-2023学年高一下学期期初质量监测化学试题
8 . 为处理饮用水中过多的 ,可在碱性条件下加入铝粉,反应为:
,可在碱性条件下加入铝粉,反应为:
 (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是
 ,可在碱性条件下加入铝粉,反应为:
,可在碱性条件下加入铝粉,反应为:
 (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是| A.Al发生氧化反应 |
B.用金属钠处理饮用水中的 ,效果更好 ,效果更好 |
| C.氧化剂与还原剂的物质的量之比为3∶5 |
D.氧化性: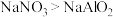 |
您最近一年使用:0次
2023-01-11更新
|
196次组卷
|
2卷引用:辽宁省沈阳市同泽高中2023-2024学年高一上学期开学考试化学试题
名校
9 . 化学科学可以帮助我们安全、合理、有效地开发自然资源和使用各种化学品,为建设美丽家园发挥重要价值。
Ⅰ.工业海水淡化及从海水中提取溴的过程如下:
(1)历史最久,技术和工艺也比较成熟,但成本较高的海水淡化的方法是_______ 法。
(2)步骤Ⅰ中已获得 Br2,步骤Ⅱ中又将 Br2还原为 Br-,其目的是_______ 。
(3)步骤Ⅱ用 SO2溶液吸收 Br2,反应的离子方程式为_______ 。
Ⅱ.亚硝酸钠(NaNO2)是生活中广泛应用的一种化学品,实验室可用如图装置制备(略去部分夹持仪器)。
②2NO2 + Na2O2 = 2NaNO3
③酸性条件下,NO、NO2和 NO 都能与 MnO
都能与 MnO 反应生成 NO
反应生成 NO 和 Mn2+
和 Mn2+
请回答下列问题:
(4)装置 A 中发生反应的化学方程式为_______ 。
(5)装置 C 的作用为_______ ,装置 E 的作用为_______ 。
(6)装置 F 中发生反应的离子方程式为_______ 。
(7)为测定亚硝酸钠的含量,进行如下操作:称取 3.000 g 样品溶于水配成 250 mL 溶液,取 25.00 mL溶液于锥形瓶中,再向锥形瓶中加入 0.1000mol·L-1酸性 KMnO4溶液 16.00 mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数为_______ (保留四位有效数字)。
Ⅰ.工业海水淡化及从海水中提取溴的过程如下:

(1)历史最久,技术和工艺也比较成熟,但成本较高的海水淡化的方法是
(2)步骤Ⅰ中已获得 Br2,步骤Ⅱ中又将 Br2还原为 Br-,其目的是
(3)步骤Ⅱ用 SO2溶液吸收 Br2,反应的离子方程式为
Ⅱ.亚硝酸钠(NaNO2)是生活中广泛应用的一种化学品,实验室可用如图装置制备(略去部分夹持仪器)。

②2NO2 + Na2O2 = 2NaNO3
③酸性条件下,NO、NO2和 NO
 都能与 MnO
都能与 MnO 反应生成 NO
反应生成 NO 和 Mn2+
和 Mn2+请回答下列问题:
(4)装置 A 中发生反应的化学方程式为
(5)装置 C 的作用为
(6)装置 F 中发生反应的离子方程式为
(7)为测定亚硝酸钠的含量,进行如下操作:称取 3.000 g 样品溶于水配成 250 mL 溶液,取 25.00 mL溶液于锥形瓶中,再向锥形瓶中加入 0.1000mol·L-1酸性 KMnO4溶液 16.00 mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数为
您最近一年使用:0次
名校
10 . 过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是由碳酸钠、过氧化氢和水三组分体系利用氢键所形成的不稳定的复合物,高温下容易分解,易溶于水。可以替代过氧化钙作为水产养殖业的供氧剂,给在储存运输过程中的鱼、虾等生物供氧保鲜,放氧速率高于过氧化钙。某实验小组模拟工业生产过碳酸钠,装置如图所示。
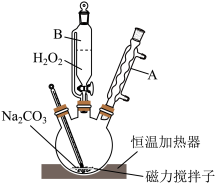
(1)装置中仪器B的名称为_______ ;仪器A的进水口为_______ (“上口”或“下口”)。
(2) 按图连接好装置后,先将饱和Na2CO3溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入30% H2O2溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
(3)反应过程中要控制温度不能太高,原因是_______ 。
(4)反应后向混合物中加入NaCl固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入NaCl固体的作用是_______ 。
(5)过碳酸钠样品中H2O2含量的测定。
取b g 2Na2CO3∙3H2O2(M=314 g∙mol−1)配成100 mL溶液,取25.00 mL溶液于锥形瓶,加入足量稀硫酸,用0.04000 mol∙L−1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。(已知:5H2O2+2KMnO4+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)
①实验达到滴定终点的现象是_______ 。
②该过氧碳酸钠的产品纯度为_______ (用字母表示)。
③滴定时间过长,测得过碳酸钠产品纯度将_______ (填“偏高”、“偏低”或“无影响”)。

(1)装置中仪器B的名称为
(2) 按图连接好装置后,先将饱和Na2CO3溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入30% H2O2溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
| A.FeCl3 | B.Na2SiO3 | C.MnO2 | D.Na2SO3 |
(4)反应后向混合物中加入NaCl固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入NaCl固体的作用是
(5)过碳酸钠样品中H2O2含量的测定。
取b g 2Na2CO3∙3H2O2(M=314 g∙mol−1)配成100 mL溶液,取25.00 mL溶液于锥形瓶,加入足量稀硫酸,用0.04000 mol∙L−1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。(已知:5H2O2+2KMnO4+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)
①实验达到滴定终点的现象是
②该过氧碳酸钠的产品纯度为
③滴定时间过长,测得过碳酸钠产品纯度将
您最近一年使用:0次
2022-09-14更新
|
682次组卷
|
5卷引用:辽宁省六校2023届高三上学期开学考试化学试题
辽宁省六校2023届高三上学期开学考试化学试题(已下线)2022年辽宁省高考真题变式题(11-15)辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题(已下线)2022年辽宁高考真题化学试题变式题(实验综合题)湖南省株洲市攸县第四中学2022-2023学年高三上学期第三次月考化学试题



