名校
解题方法
1 . 为解决国家“973计划”中钒、铬资源的利用问题,2013年6月攀钢成立“钒铬渣分离提取钒铬技术研究”课题组,2020年5月课题组公布了提取钒铬的工艺流程。
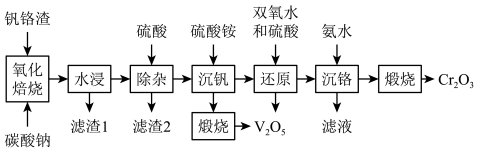
已知:
①钒铬渣中含有V2O3、Cr2O3、及SiO2、Fe2O3、FeO等
②“沉钒”时析出正五价含氧酸铵盐
③25℃时,Cr(OH)3的溶度积常数为6.4×10-31;lg4=0.6
回答下列问题:
(1)钒铬渣“氧化焙烧”之前通常要将原料粉碎,其目的是___ 。
(2)“氧化焙烧”时,钒铬渣中化合价发生变化三种元素的价层电子排布式为___ 、___ 、___ 。
(3)“除杂”产生的滤渣2的成分是____ (用化学式表示)。
(4)写出紧接“沉钒”的“煅烧”反应的化学方程式____ 。
(5)“还原”溶液中的Cr2O 时发生反应的离子方程式
时发生反应的离子方程式____ 。已知双氧水还原Cr2O 的效率在40℃时最高,解释原因
的效率在40℃时最高,解释原因____ 。
(6)“沉络”过程中,含铬元素的离子刚好完全沉淀时,溶液的pH=____ (已知溶液中离子浓度10-5mol/L时认为已完全沉淀)。

已知:
①钒铬渣中含有V2O3、Cr2O3、及SiO2、Fe2O3、FeO等
②“沉钒”时析出正五价含氧酸铵盐
③25℃时,Cr(OH)3的溶度积常数为6.4×10-31;lg4=0.6
回答下列问题:
(1)钒铬渣“氧化焙烧”之前通常要将原料粉碎,其目的是
(2)“氧化焙烧”时,钒铬渣中化合价发生变化三种元素的价层电子排布式为
(3)“除杂”产生的滤渣2的成分是
(4)写出紧接“沉钒”的“煅烧”反应的化学方程式
(5)“还原”溶液中的Cr2O
 时发生反应的离子方程式
时发生反应的离子方程式 的效率在40℃时最高,解释原因
的效率在40℃时最高,解释原因(6)“沉络”过程中,含铬元素的离子刚好完全沉淀时,溶液的pH=
您最近一年使用:0次
解题方法
2 . 以铜为原料可制备应用广泛的氧化亚铜。
方法I.先向CuCl2溶液中通入SO2可得CuCl沉淀,过滤后由CuCl 水解再热分解可得到纳米Cu2O。
(1)向CuCl2溶液中通入SO2可得CuCl 沉淀,该反应的氧化剂与还原剂的物质的量之比为___________ 。
(2)CuCl水解为: CuCl (s) +H2O(1) CuOH (s) +Cl-(aq) +H+ (aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、 Ksp (CuCl) 的关系为K=
CuOH (s) +Cl-(aq) +H+ (aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、 Ksp (CuCl) 的关系为K=___________ 。
方法II.电解法
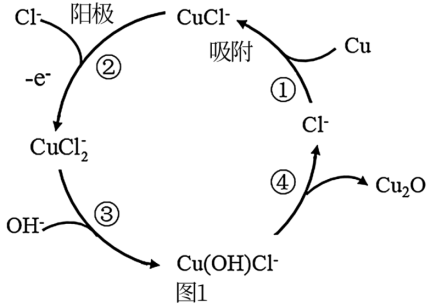
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图1所示。溶液中③、④二步总反应的离子方程式为:___________ 。
III.氧化亚铜的应用
(4)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g) +2H2(g) CH3OH(g) △H =a kJ∙mol−1。按
CH3OH(g) △H =a kJ∙mol−1。按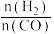 =2:1投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
=2:1投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。

①该反应的△H___________ 0 (填“<”或“>”),图中压强P1、P2、P3由大到小的关系是___________ 。
②恒容密闭容器中,以下描述标志此反应一定达平衡的是___________ 。
A.甲醇的体积分数不再随时间的改变而改变
B.氢气与一氧化碳的浓度比不再改变
C.混合气体的平均摩尔质量不再改变
③当反应达平衡时,温度为T1°C,压强为P3,此时反应的压强平衡常数Kp为___________ 。(用含有P3的代数式表达) (用平衡分压代替平衡浓度计算,分压=总压×体积分数)
方法I.先向CuCl2溶液中通入SO2可得CuCl沉淀,过滤后由CuCl 水解再热分解可得到纳米Cu2O。
(1)向CuCl2溶液中通入SO2可得CuCl 沉淀,该反应的氧化剂与还原剂的物质的量之比为
(2)CuCl水解为: CuCl (s) +H2O(1)
 CuOH (s) +Cl-(aq) +H+ (aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、 Ksp (CuCl) 的关系为K=
CuOH (s) +Cl-(aq) +H+ (aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、 Ksp (CuCl) 的关系为K=方法II.电解法
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图1所示。溶液中③、④二步总反应的离子方程式为:

III.氧化亚铜的应用
(4)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g) +2H2(g)
 CH3OH(g) △H =a kJ∙mol−1。按
CH3OH(g) △H =a kJ∙mol−1。按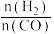 =2:1投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
=2:1投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
①该反应的△H
②恒容密闭容器中,以下描述标志此反应一定达平衡的是
A.甲醇的体积分数不再随时间的改变而改变
B.氢气与一氧化碳的浓度比不再改变
C.混合气体的平均摩尔质量不再改变
③当反应达平衡时,温度为T1°C,压强为P3,此时反应的压强平衡常数Kp为
您最近一年使用:0次
解题方法
3 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖,处理废旧的锂离子电池可得到的正极活性粉体中含有Li2O、NiO、 Co2O3、MnO2、Fe、C、Al、 Cu等。采用以下工艺流程可从废旧锂离子电池中分离回收钴、镍、锰,制备正极材料的前驱体(NiCO3·CoCO3· MnCO3)。
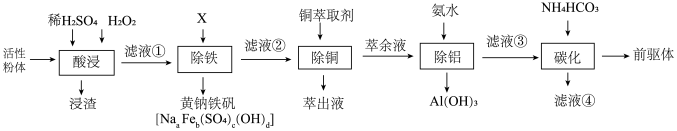
回答下列问题:
(1)“酸浸”温度为85°C,粉体中的钴(以Co2O3表示)还原浸出的离子方程式为___________ ,不能温度过高的原因是___________ 。
(2)“除铁”时需将溶液的pH调至3左右,加入的化合物X的物质名称是___________ 。
(3)“除铜”时获得萃余液的操作名称是___________ 。
(4)“除铝”时反应的离子方程式为___________ 。萃余液中Co2+的浓度为0. 30mol ·L-1,通过计算说明,常温下除铝控制溶液pH为4.0,是否造成Co的损失?___________ 。(列出算式并给出结论)已知: (Ksp[Co (OH)2] =5.9 ×10-15)
(5)碳化时加入NH4HCO3的目的是:___________ 。

回答下列问题:
(1)“酸浸”温度为85°C,粉体中的钴(以Co2O3表示)还原浸出的离子方程式为
(2)“除铁”时需将溶液的pH调至3左右,加入的化合物X的物质名称是
(3)“除铜”时获得萃余液的操作名称是
(4)“除铝”时反应的离子方程式为
(5)碳化时加入NH4HCO3的目的是:
您最近一年使用:0次
解题方法
4 . 面对新冠病毒,VB空气防护卡也成了“网红”,成为人们讨论的话题。商品介绍卡片中含有的主要活性成分——亚氯酸钠,在接触空气时可以释放安全可靠的低浓度二氧化氯( ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
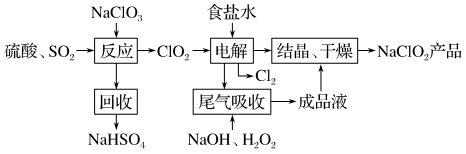
回答下列问题:
(1)写出“反应”步骤中生成 的化学反应方程式:
的化学反应方程式:_______ 。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 、
、 、
、 ,要加入的试剂分别为
,要加入的试剂分别为_______ 、_______ 、_______ ,为得到纯净的NaCl溶液还需加入_______ (以上填写相应物质的化学式)。
(3)“电解”产生的 可用于工业制漂白液,写出离子反应方程式:
可用于工业制漂白液,写出离子反应方程式:_______ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为_______ ,该反应中还原产物是_______ 。
(5)有同学推测VB空气防护卡原理是因为 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:_______ 。
 ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
回答下列问题:
(1)写出“反应”步骤中生成
 的化学反应方程式:
的化学反应方程式:(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 、
、 、
、 ,要加入的试剂分别为
,要加入的试剂分别为(3)“电解”产生的
 可用于工业制漂白液,写出离子反应方程式:
可用于工业制漂白液,写出离子反应方程式:(4)“尾气吸收”是吸收“电解”过程排出的少量
 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为(5)有同学推测VB空气防护卡原理是因为
 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:
您最近一年使用:0次
2022-01-19更新
|
504次组卷
|
2卷引用:辽宁省本溪满族自治县高级中学2021-2022学年高一下学期开学考试化学试题
名校
5 . 砷(As)与N、P是同主族元素,远古时期人们就开始开发利用砷的性质,现代技术中砷仍然起着非常重要的作用。请回答下列问题:
(1)砷只有一种稳定的同位素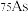 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多_______ (填数值)。
(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
(3)Marsh试砷法和Gutzeit试砷法是法医学上鉴定砷的重要方法。其原理是先将 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。
① 的电子式为
的电子式为_______ 。
②Gutzeit试砷法中 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为_______ ;砷化镓也可用于制造太阳能电池,该电池工作时的能量转化形式为_______ 。
(5)已知 的电离平衡常数分别为
的电离平衡常数分别为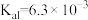 、
、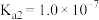 、
、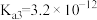 。
。
①25℃时,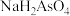 ,溶液中:
,溶液中: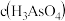
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②25℃时,向 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中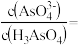
_______ 。
(1)砷只有一种稳定的同位素
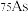 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
A.沸点: |
B.等物质的量浓度溶液的酸性: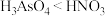 |
C.分解温度: |
D.相对分子质量: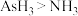 |
 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。①
 的电子式为
的电子式为②Gutzeit试砷法中
 被氧化的离子方程式为
被氧化的离子方程式为(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用
 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为(5)已知
 的电离平衡常数分别为
的电离平衡常数分别为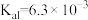 、
、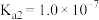 、
、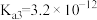 。
。①25℃时,
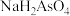 ,溶液中:
,溶液中: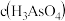
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②25℃时,向
 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中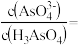
您最近一年使用:0次
2021-12-06更新
|
632次组卷
|
3卷引用:辽宁省凌源市 2021-2022学年高二下学期开学考试化学试题
名校
解题方法
6 . 已知 在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
 在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是| pH范围 | >7 | <7 |
| 产物 |  | NO、 、 、 中的一种 中的一种 |
A.碱性条件下, 与NaClO反应的离子方程式为 与NaClO反应的离子方程式为 |
B.向冷的 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 |
C.向冷的 溶液中通入 溶液中通入 可得到 可得到 |
D.低温时不用其它试剂即可区分 溶液与 溶液与 溶液 溶液 |
您最近一年使用:0次
2021-10-28更新
|
85次组卷
|
8卷引用:辽宁省六校协作体2017-2018学年高二下学期期初考试化学试题
名校
解题方法
7 . 已知: 是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与
是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与 反应制得。某同学利用下图装置制取
反应制得。某同学利用下图装置制取 ,然后制取
,然后制取 。已知:
。已知: 为红棕色液体,有刺激性臭味,熔点:
为红棕色液体,有刺激性臭味,熔点: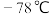 ,沸点:60℃,易水解。
,沸点:60℃,易水解。
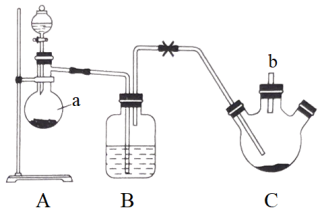
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成 。
。
②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得 。
。
试回答下列问题。
(1)仪器a的名称为_______ ,a中三氧化铬(还原产物中铬为+3价)可与浓盐酸快速反应制得氯气,写出反应的离子方程式_______ 。
(2)B装置中应选择的试剂为_______ 。制取 过程中,b导管末端应连接下图中的
过程中,b导管末端应连接下图中的_______ (填序号)。
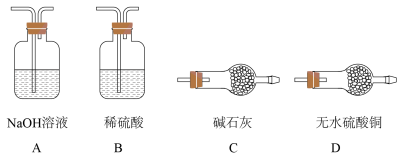
(3)向制得的 中通入
中通入 ,生成
,生成 的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式
的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式_______ 。所得产物分离后,检验所得盐中阳离子的具体操作步骤和现象_______ 。
(4) 在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定
在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定 的纯度。称取
的纯度。称取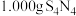 样品,加入NaOH溶液,并加热,释放出的氨气用足量
样品,加入NaOH溶液,并加热,释放出的氨气用足量 硼酸溶液吸收[反应方程式为
硼酸溶液吸收[反应方程式为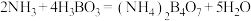 ,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用
,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用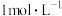 的盐酸[滴定反应方程式为
的盐酸[滴定反应方程式为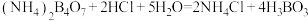 ]进行滴定,重复三次实验。实验数据记录如下表所示:
]进行滴定,重复三次实验。实验数据记录如下表所示:
则制得的 的纯度为
的纯度为_______ 。
 是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与
是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与 反应制得。某同学利用下图装置制取
反应制得。某同学利用下图装置制取 ,然后制取
,然后制取 。已知:
。已知: 为红棕色液体,有刺激性臭味,熔点:
为红棕色液体,有刺激性臭味,熔点: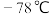 ,沸点:60℃,易水解。
,沸点:60℃,易水解。
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成
 。
。②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得
 。
。试回答下列问题。
(1)仪器a的名称为
(2)B装置中应选择的试剂为
 过程中,b导管末端应连接下图中的
过程中,b导管末端应连接下图中的
(3)向制得的
 中通入
中通入 ,生成
,生成 的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式
的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式(4)
 在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定
在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定 的纯度。称取
的纯度。称取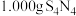 样品,加入NaOH溶液,并加热,释放出的氨气用足量
样品,加入NaOH溶液,并加热,释放出的氨气用足量 硼酸溶液吸收[反应方程式为
硼酸溶液吸收[反应方程式为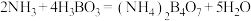 ,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用
,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用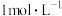 的盐酸[滴定反应方程式为
的盐酸[滴定反应方程式为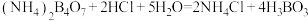 ]进行滴定,重复三次实验。实验数据记录如下表所示:
]进行滴定,重复三次实验。实验数据记录如下表所示:| 实验序号 | 初始读数 | 最终读数 |
| I | 0.10 | 20.14 |
| II | 0.50 | 24.75 |
| III | 1.00 | 20.96 |
 的纯度为
的纯度为
您最近一年使用:0次
2021-09-08更新
|
902次组卷
|
5卷引用:辽宁省朝阳市建平县实验中学2022届高三上学期第一次联考化学试题
辽宁省朝阳市建平县实验中学2022届高三上学期第一次联考化学试题福建省部分名校2021-2022学年高三上学期11月联合测评化学试题河北省石家庄市第二中学2021-2022学年高三上学期期中考试化学试题河北省衡水市2021-2022学年高三上学期三调化学试题(已下线)一轮巩固卷7-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)
名校
8 . 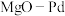 催化下温室气体
催化下温室气体 的转化如图所示,下列叙述错误的是
的转化如图所示,下列叙述错误的是

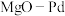 催化下温室气体
催化下温室气体 的转化如图所示,下列叙述错误的是
的转化如图所示,下列叙述错误的是
A.该循环过程中转化的总化学方程式为: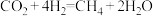 |
| B.MgOC是反应的中间产物 |
| C.反应过程中镁元素的化合价先升高后降低 |
D.生成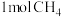 转移 转移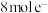 |
您最近一年使用:0次
解题方法
9 . 用含铬不锈钢废渣(含SiO2、Cr2O3、Fe2O3、Al2O3等)制取Cr2O3(铬绿)的工艺流程如图所示:
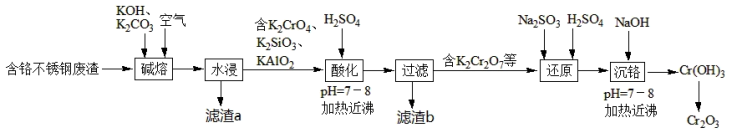
回答下列问题:
(1)Cr在元素周期表中的位置:___ 。
(2)K2CO3中的CO 的空间构型为
的空间构型为___ 。
(3)“水浸”时,碱熔渣中的KFeO2强烈水解生成的难溶物的化学式为___ 。
(4)常温下,“酸化”时溶液的pH=8,则c(Al3+)=___ mol/L。(已知:常温下,Ksp[Al(OH)3]=1.3×10-33)
(5)滤渣b的主要成分为___ 。
(6)“还原”时发生反应的离子方程式为___ 。
(7)若在实验室里完成Cr(OH)3制取铬绿的操作,需要的主要仪器有铁架台、玻璃棒、___ 。

回答下列问题:
(1)Cr在元素周期表中的位置:
(2)K2CO3中的CO
 的空间构型为
的空间构型为(3)“水浸”时,碱熔渣中的KFeO2强烈水解生成的难溶物的化学式为
(4)常温下,“酸化”时溶液的pH=8,则c(Al3+)=
(5)滤渣b的主要成分为
(6)“还原”时发生反应的离子方程式为
(7)若在实验室里完成Cr(OH)3制取铬绿的操作,需要的主要仪器有铁架台、玻璃棒、
您最近一年使用:0次
名校
10 . 利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是
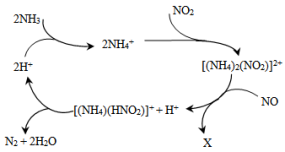
| A.X是N2O |
| B.汽车尾气中含有的氮氧化合物是由于汽油燃烧产生的 |
C.NH 中含有非极性共价键 中含有非极性共价键 |
D.上述历程的总反应为:2NH3+NO+NO2 2N2+3H2O 2N2+3H2O |
您最近一年使用:0次
2021-03-17更新
|
340次组卷
|
12卷引用:辽宁省沈阳市第一二〇中学2022-2023学年高一下学期期初质量监测化学试题
辽宁省沈阳市第一二〇中学2022-2023学年高一下学期期初质量监测化学试题江西省南昌市第二中学2020届高三第四次月考化学试题江西省顶级名校2020届高三第四次联考化学试题江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题新人教版必修2同步测试:5.2.1一氧化氮和二氧化氮河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题江西省奉新县第一中学2021届高三上学期第二次月考化学试题湖北省六校(恩施高中 郧阳中学 沙市中学 十堰一中 随州二中 襄阳三中)2021届高三11月联考化学试题专题7 第三单元综合拔高练-高中化学必修第二册苏教版2019北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题吉林省东北师范大学附属中学2021届高三第五次模拟考试理科综合化学试题(已下线)选择题7-12



