1 . 以软锰矿(主要成分MnO2,还含有Fe2O3、Al2O3、CaO、ZnO、SiO2)为原料生产纳米Mn3O4的工艺流程如图:
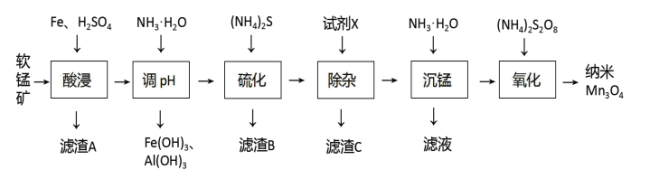
I.难溶物的Ksp如表:
II.Mn(OH)2+xNH3=[Mn(NH3)x]2++2OH-
回答下列问题:
(1)基态锰原子价层电子排布式为___ ,已知Mn3O4可与盐酸反应生成氯气(原理同MnO2),写出该反应离子方程式___ 。
(2)软锰矿“酸浸”需要控制温度为90℃左右,其主要成分发生反应的化学方程式为___ ,“滤渣A”主要成分为___ 。
(3)“硫化”后的滤液中c(Ca2+)=1.0×10-3mol/L,若要将其沉淀完全,则至少需要加入CaF2至溶液中的c(F-)=___ mol/L。
(4)“沉锰”过程中研究pH与Mn2+的沉降率关系见表,根据表格数据分析,应调节最佳pH为___ ,分析其原因为___ 。

I.难溶物的Ksp如表:
| 物质 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Zn(OH)2 | ZnS | MnS | CaF2 |
| Ksp | 4.0×10-38 | 4.5×10-33 | 1.9×10-13 | 2.0×10-15 | 1.6×10-24 | 2.5×10-13 | 4.0×10-11 |
回答下列问题:
(1)基态锰原子价层电子排布式为
(2)软锰矿“酸浸”需要控制温度为90℃左右,其主要成分发生反应的化学方程式为
(3)“硫化”后的滤液中c(Ca2+)=1.0×10-3mol/L,若要将其沉淀完全,则至少需要加入CaF2至溶液中的c(F-)=
(4)“沉锰”过程中研究pH与Mn2+的沉降率关系见表,根据表格数据分析,应调节最佳pH为
| pH | 氨水体积/mL | 残余率/% | 沉降率/% |
| 8.5 | 2.7 | 71.1 | 28.9 |
| 9.0 | 4.5 | 45.2 | 54.8 |
| 9.5 | 7.6 | 20.5 | 79.5 |
| 10.0 | 10.5 | 16.3 | 83.7 |
| 10.5 | 16.1 | 18.4 | 81.6 |
您最近一年使用:0次
名校
2 . 辉铜矿(主要成分是Cu2S)是提炼铜的重要矿物原料之一、以H2O2作为氧化剂在硫酸环境中对辉铜矿浸出生成CuSO4的模型如下:
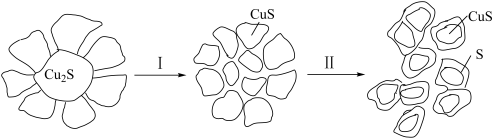
(1)根据上述转化关系,请回答。
①I和Ⅱ的转化过程中,被氧化的元素是_______ 。
②将过程Ⅰ的化学方程式补充完整:Cu2S+H2O2+_____=CuS+_____+____,_______ 。
③过程Ⅱ中,H2O2起主要作用,但加入Fe2(SO4)3可以提高浸出率。过程Ⅱ的浸出模型如图。结合难溶电解质的溶解平衡,解释加入Fe2(SO4)3的作用_______ 。
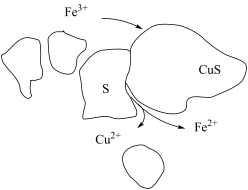
④在浸出过程中,Fe3+可以不断再生,其离子方程式是_______ 。
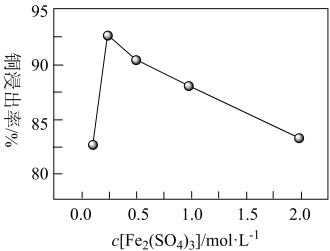
⑤在相同时间内,测得Fe2(SO4)3浓度对Cu2+浸出率的影响如下图所示。当c[Fe2(SO4)3]>0.25mol·L-1后,图中曲线下降的可能原因是_______ 。
(2)测定浸出液中Cu2+浓度,其过程如下:
i.取a mL浸出液,煮沸除尽过量H2O2,调节溶液的酸度。加入KF(除去Fe3+);
ii.加入过量KI溶液,与Cu2+反应生成CuI白色沉淀和I2
iii.用0.1000mol·L-1 Na2S2O3标准溶液滴定生成的I2,消耗Na2S2O3镕液b mL。(已知: )
)
①ii中反应的离子方程式是_______ 。
②浸出液中的c(Cu2+)=_____________ mol∙L-1。

(1)根据上述转化关系,请回答。
①I和Ⅱ的转化过程中,被氧化的元素是
②将过程Ⅰ的化学方程式补充完整:Cu2S+H2O2+_____=CuS+_____+____,
③过程Ⅱ中,H2O2起主要作用,但加入Fe2(SO4)3可以提高浸出率。过程Ⅱ的浸出模型如图。结合难溶电解质的溶解平衡,解释加入Fe2(SO4)3的作用

④在浸出过程中,Fe3+可以不断再生,其离子方程式是
⑤在相同时间内,测得Fe2(SO4)3浓度对Cu2+浸出率的影响如下图所示。当c[Fe2(SO4)3]>0.25mol·L-1后,图中曲线下降的可能原因是

(2)测定浸出液中Cu2+浓度,其过程如下:
i.取a mL浸出液,煮沸除尽过量H2O2,调节溶液的酸度。加入KF(除去Fe3+);
ii.加入过量KI溶液,与Cu2+反应生成CuI白色沉淀和I2
iii.用0.1000mol·L-1 Na2S2O3标准溶液滴定生成的I2,消耗Na2S2O3镕液b mL。(已知:
 )
)①ii中反应的离子方程式是
②浸出液中的c(Cu2+)=
您最近一年使用:0次
2021-03-06更新
|
342次组卷
|
3卷引用:辽宁省实验中学2023-2024学年高三上学期期初考试化学试题
解题方法
3 . ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,回答下列问题:
(1)该反应中还原产物的化学式是______ ,被氧化的元素是______ (填元素符号)。
(2)用双线桥标出上述反应的电子转移情况______ 。
(3)若反应共产生了8.96L(标准状况)气体,则反应转移的电子的物质的量为______ mol,消耗还原剂的物质的量为______ mol。
(4)标准状况下44.8mL的ClO2恰好能与50mL0.1mol•L-1的Na2SO3溶液完全反应,得到的产物之一为Na2SO4,氯元素在产物中的化合价为______ ,此过程说明ClO2具有______ (填“氧化”或“还原”)性。
(5)在硫化钠溶液中通入ClO2可发生如下反应,请完成配平:______ 。
ClO2+ S2- H2O= Cl-+ SO H+
H+
(1)该反应中还原产物的化学式是
(2)用双线桥标出上述反应的电子转移情况
(3)若反应共产生了8.96L(标准状况)气体,则反应转移的电子的物质的量为
(4)标准状况下44.8mL的ClO2恰好能与50mL0.1mol•L-1的Na2SO3溶液完全反应,得到的产物之一为Na2SO4,氯元素在产物中的化合价为
(5)在硫化钠溶液中通入ClO2可发生如下反应,请完成配平:
ClO2+ S2- H2O= Cl-+ SO
 H+
H+
您最近一年使用:0次
名校
4 . 交警常用一种“酒精检测仪”检查司机是否酒后驾车。其反应原理为C2H5OH + 4CrO3 + 6H2SO4= 2X + 2CO2↑+9H2O,反应中红色的CrO3转化为绿色的化合物X,则X的化学式为( )
| A.Cr2O3 | B.CrSO3 | C.Cr2(SO4)3 | D.Cr2S3 |
您最近一年使用:0次
2019高三·全国·专题练习
名校
解题方法
5 . 已知:还原性 ,氧化性
,氧化性 ,在含
,在含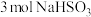 的溶液中逐滴加入
的溶液中逐滴加入 溶液,加入
溶液,加入 和析出上
和析出上 的物质的量的关系曲线如图所示。下列说法不正确的是( )
的物质的量的关系曲线如图所示。下列说法不正确的是( )
 ,氧化性
,氧化性 ,在含
,在含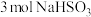 的溶液中逐滴加入
的溶液中逐滴加入 溶液,加入
溶液,加入 和析出上
和析出上 的物质的量的关系曲线如图所示。下列说法不正确的是( )
的物质的量的关系曲线如图所示。下列说法不正确的是( )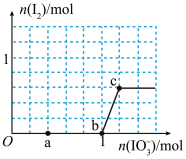
A.0~a间发生反应: |
B.a~b共消耗 的物质的量为 的物质的量为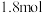 |
C.b~c间发生的反应中 仅是氧化产物 仅是氧化产物 |
D.当溶液中 与 与 的物质的量之比为 的物质的量之比为 时,加入的 时,加入的 为 为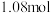 |
您最近一年使用:0次
2020-09-10更新
|
164次组卷
|
4卷引用:辽宁省实验中学东戴河分校2020届高三上学期期初摸底考试化学试题
辽宁省实验中学东戴河分校2020届高三上学期期初摸底考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【押题专练】黑龙江省哈尔滨市三中2020届高三第二次月考化学试题2024届攀枝花市第十五中学校高三上学期第2次统一考试理科综合试卷-高中化学
名校
解题方法
6 . 电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
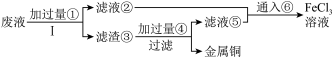
(1)写出FeCl3溶液与铜箔发生反应的离子方程式:____________ 。
(2)检验废腐蚀液中是否含有Fe3+所需试剂名称:________ ,实验现象:______________ 。
(3)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:___________ ,此转化的化学方程式为:______________ 。
(4)写出③中所含物质:________ ,⑥发生反应的离子方程式:_______ 。

(1)写出FeCl3溶液与铜箔发生反应的离子方程式:
(2)检验废腐蚀液中是否含有Fe3+所需试剂名称:
(3)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:
(4)写出③中所含物质:
您最近一年使用:0次
2020-09-04更新
|
244次组卷
|
2卷引用:辽宁省辽河油田第二高级中学2020-2021学年高一3月开学考试化学试题
名校
解题方法
7 . 黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
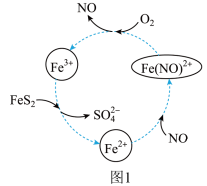
(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2做__ (填“催化剂”“氧化剂”或“还原剂”,下同)。该转化过程中NO的作用是__ 。
②写出图1中Fe3+与FeS2反应的离子方程式:__ 。
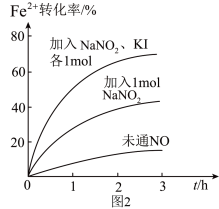
(2)Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。
①加入NaNO2发生反应:2H++3NO =NO
=NO +2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为
+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为__ mol。
②加入NaNO2、KI发生反应:4H++2NO +2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:__ 。

(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2做
②写出图1中Fe3+与FeS2反应的离子方程式:
(2)Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。

①加入NaNO2发生反应:2H++3NO
 =NO
=NO +2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为
+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为②加入NaNO2、KI发生反应:4H++2NO
 +2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
您最近一年使用:0次
2020-08-16更新
|
311次组卷
|
6卷引用:辽宁省沈阳市辽中区第二高级中学2021-2022学年高二下学期摸底考试化学试题
辽宁省沈阳市辽中区第二高级中学2021-2022学年高二下学期摸底考试化学试题河北省承德市各县第一中学2018届高三上学期期末考试化学试题(已下线)第08讲 氧化还原反应的基本概念和规律(精练)——2021年高考化学一轮复习讲练测(已下线)第03讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(新教材新高考)宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题(已下线)第4讲 氧化还原反应的基本概念与规律
名校
解题方法
8 . 超纯氢氟酸主要用作芯片材料清洗和蚀刻。回答下列问题:
(1)氢氟酸可保存在聚四氟乙烯容器中,聚四氟乙烯的结构简式为_____________________ 。
(2)工业氢氟酸生产超纯氢氟酸时,需经除杂质(AsF3)、气化、洗涤等步骤。
①除去AsF3的反应为4AsF3+4KMnO4=4MnO4+2As2O5+4KF+3O2↑,该反应的氧化产物为___________ 。
②CoF3可与H2O反应生成HF,该反应的化学方程式为___________________________ (CoF3还原为CoF2)
③在无水氟化氢汽化时,可向发生装置中掺入含有F2,NF3和OF2中的一种或多种的含氟气体,以氧化杂质。NF3的电子式为_________ ;OF2中氧元素的化合价为___________ ,OF2可由F2与稀NaOH溶液反应制取,该反应的离子方程式为____________________________ 。
(1)氢氟酸可保存在聚四氟乙烯容器中,聚四氟乙烯的结构简式为
(2)工业氢氟酸生产超纯氢氟酸时,需经除杂质(AsF3)、气化、洗涤等步骤。
①除去AsF3的反应为4AsF3+4KMnO4=4MnO4+2As2O5+4KF+3O2↑,该反应的氧化产物为
②CoF3可与H2O反应生成HF,该反应的化学方程式为
③在无水氟化氢汽化时,可向发生装置中掺入含有F2,NF3和OF2中的一种或多种的含氟气体,以氧化杂质。NF3的电子式为
您最近一年使用:0次
2020-02-19更新
|
485次组卷
|
4卷引用:辽宁省六校协作体2020-2021学年高二上学期期初考试化学试题
解题方法
9 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2,每生成3mol KH(IO3)2,反应中转移的电子数为___ ,向反应后溶液中加_______ 溶液得到KIO3。
(2)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式__________ 。
②电解过程中通过阳离子交换膜的离子主要为_____ ,其迁移方向是_______ (用A、B表示)。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有_______ (写出一点)。
(3)一种由含碘废水制取碘酸钾的工艺如图:
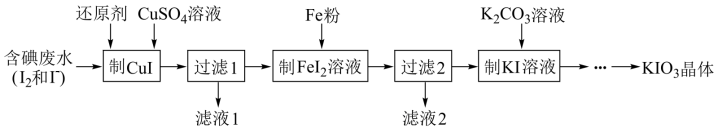
①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加____ 盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为_________ 。
(4)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mg•kg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol•L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量____ mg•kg-1。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2,每生成3mol KH(IO3)2,反应中转移的电子数为
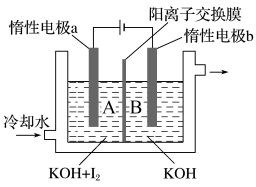
(2)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式
②电解过程中通过阳离子交换膜的离子主要为
③与“电解法”相比,“KClO3氧化法”的主要不足之处有
(3)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加
②“制FeI2”时,发生反应的化学方程式为
(4)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mg•kg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol•L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量
您最近一年使用:0次
10 . 氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是_____ 。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是___ (填元素名称),氧化剂是__ (填化学式)。
②配平该方程式:____ NH3+ ____ Cl2—____ N2+____ HCl
③工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是______ ,产生该现象的反应方程式为___ 。
(3)“地康法”制氯气的反应原理图示如下:
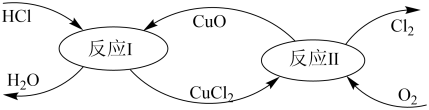
①反应I的化学方程式为____ 。
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为____ 。
(1)下列表述中没有氧化还原反应发生的是
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是
②配平该方程式:
③工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为
您最近一年使用:0次



