解题方法
1 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)为增大水钴矿的浸取效率,可采取的措施为______ 。(任写一条)
(2)向浸出液中加入NaClO3对应的离子反应方程式为______ ,制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为______ ;实验需要制取21.3克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为______ (标准状况)。
(3)向浸出液中加入碳酸钠后析出的沉淀是______ ,至少调节pH为______ 。
(4)滤液Ⅱ中加入萃取剂的目的是______ 。
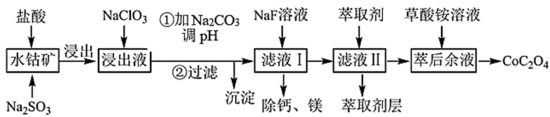
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液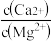 =
=______ 。
(6)取15gCoC2O4样品灼烧(CoC2O4=CoO+CO+CO2,假设杂质不参与变化),将分解产生的气体收集起来得到标况下体积为4.48L的气体,则CoC2O4的纯度为_______ 。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)为增大水钴矿的浸取效率,可采取的措施为
(2)向浸出液中加入NaClO3对应的离子反应方程式为
(3)向浸出液中加入碳酸钠后析出的沉淀是
(4)滤液Ⅱ中加入萃取剂的目的是
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
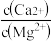 =
=(6)取15gCoC2O4样品灼烧(CoC2O4=CoO+CO+CO2,假设杂质不参与变化),将分解产生的气体收集起来得到标况下体积为4.48L的气体,则CoC2O4的纯度为
您最近一年使用:0次
解题方法
2 . 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业氧化锌[含有 、
、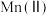 、
、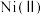 等杂质]的流程如下
等杂质]的流程如下


已知:①在本实验条件下,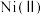 不能被氧化;高锰酸钾的还原产物是
不能被氧化;高锰酸钾的还原产物是 。
。
②不考虑操作过程中引起的质量损失。
回答下列问题:
(1)加稀硫酸酸浸时,常将工业 粉碎,其目的是
粉碎,其目的是_____ 。
(2)过滤时,主要用到的玻璃仪器有烧杯、玻璃棒和________ ,其中玻璃棒的作用为_________ 。
(3)②发生反应的离子方程式有 和
和________ 。
(4)若④中产物仅为 ,则发生反应的离子方程式为
,则发生反应的离子方程式为________ ;取干燥后的滤饼 ,煅烧后可得到产品(
,煅烧后可得到产品( )
) ,则
,则 等于
等于_____ (用含a、m的代数式表示)。
(5)④形成的沉淀要水洗,检验沉淀是否洗涤干净的操作和现象是________ 。
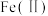 、
、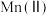 、
、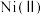 等杂质]的流程如下
等杂质]的流程如下

已知:①在本实验条件下,
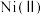 不能被氧化;高锰酸钾的还原产物是
不能被氧化;高锰酸钾的还原产物是 。
。②不考虑操作过程中引起的质量损失。
回答下列问题:
(1)加稀硫酸酸浸时,常将工业
 粉碎,其目的是
粉碎,其目的是(2)过滤时,主要用到的玻璃仪器有烧杯、玻璃棒和
(3)②发生反应的离子方程式有
 和
和(4)若④中产物仅为
 ,则发生反应的离子方程式为
,则发生反应的离子方程式为 ,煅烧后可得到产品(
,煅烧后可得到产品( )
) ,则
,则 等于
等于(5)④形成的沉淀要水洗,检验沉淀是否洗涤干净的操作和现象是
您最近一年使用:0次
解题方法
3 . 氧化钪( )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含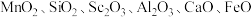 )为原料制备氧化钪的一种工艺流程如图所示。
)为原料制备氧化钪的一种工艺流程如图所示。 ;③草酸可与多种金属离子形成可溶性络合物。
;③草酸可与多种金属离子形成可溶性络合物。
回答下列问题:
(1)为了提高“浸取”效果,可采取的措施有___________ (写出一种)。
(2)“浸取”时铁屑被 氧化为
氧化为 ,该反应的离子方程式是
,该反应的离子方程式是___________ 。
(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为___________ 。___________ 。
(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中 的浓度为
的浓度为___________ 。
(6)已知 ,
,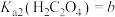 ,
,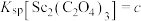 。“沉钪”时,发生反应
。“沉钪”时,发生反应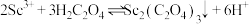 ,此反应的平衡常数
,此反应的平衡常数
___________ (用含a、b、c的代数式表示)。反应过程中,草酸用量过多时,航的沉淀率下降,原因可能是___________ 。
(7)草酸钪晶体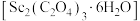 在空气中加热,
在空气中加热, 随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为
随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为___________ 。
 )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含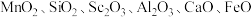 )为原料制备氧化钪的一种工艺流程如图所示。
)为原料制备氧化钪的一种工艺流程如图所示。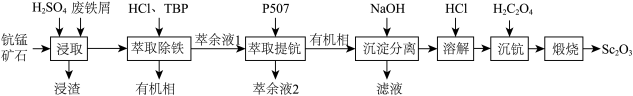
 ;③草酸可与多种金属离子形成可溶性络合物。
;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:
(1)为了提高“浸取”效果,可采取的措施有
(2)“浸取”时铁屑被
 氧化为
氧化为 ,该反应的离子方程式是
,该反应的离子方程式是(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为

(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中
 的浓度为
的浓度为(6)已知
 ,
,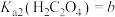 ,
,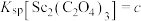 。“沉钪”时,发生反应
。“沉钪”时,发生反应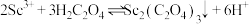 ,此反应的平衡常数
,此反应的平衡常数
(7)草酸钪晶体
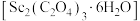 在空气中加热,
在空气中加热, 随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为
随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为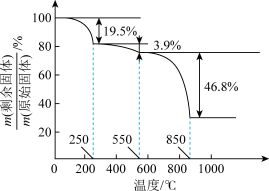
您最近一年使用:0次
名校
解题方法
4 . 以银锰精矿(主要含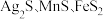 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: 的氧化性强于
的氧化性强于 ;
;
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①“浸锰"过程中,发生反应: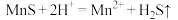 ,则可推断:
,则可推断: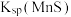
____ (填“ ”或“
”或“ ”)
”)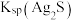 。
。
②在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量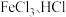 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以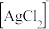 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_______ 。
_______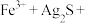 _______
_______ _______
_______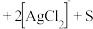 。
。
②结合平衡移动原理,解释浸出剂中 的作用:
的作用:_______ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有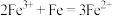 和
和_______ 。
(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图_____ ;基态铁原子核外共有_____ 种不同空间运动状态的电子。
②从结构角度分析, 较
较 稳定的原因是
稳定的原因是_______ 。
③碳与其他元素一起能形成多种酸或酸根。 的空间构型是
的空间构型是_______ 。
④类卤素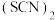 分子中
分子中 键与
键与 键的数目比
键的数目比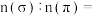
_______ 。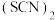 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸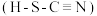 的沸点低于异硫氰酸
的沸点低于异硫氰酸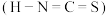 的沸点,其原因是
的沸点,其原因是_______ 。
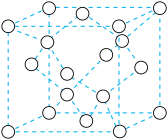
⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体: 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
_______ pm(写出表达式即可)。
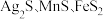 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: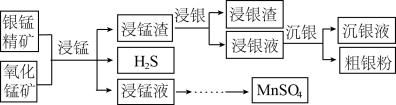
 的氧化性强于
的氧化性强于 ;
;(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①“浸锰"过程中,发生反应:
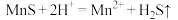 ,则可推断:
,则可推断: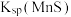
 ”或“
”或“ ”)
”)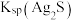 。
。②在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
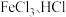 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以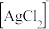 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
_______
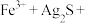 _______
_______ _______
_______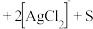 。
。②结合平衡移动原理,解释浸出剂中
 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有
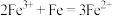 和
和(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图
②从结构角度分析,
 较
较 稳定的原因是
稳定的原因是③碳与其他元素一起能形成多种酸或酸根。
 的空间构型是
的空间构型是④类卤素
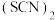 分子中
分子中 键与
键与 键的数目比
键的数目比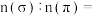
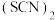 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸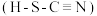 的沸点低于异硫氰酸
的沸点低于异硫氰酸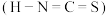 的沸点,其原因是
的沸点,其原因是⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体:
 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
您最近一年使用:0次
解题方法
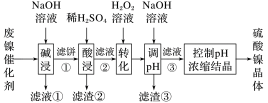
5 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______ 。
(2)“滤液②”中含有的金属离子是______ 。
(3)若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为______ 。
(4)如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是______ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______ 。

| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时 (c=0.01mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时 (c=1.0×10-5mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH的两个作用分别是
(2)“滤液②”中含有的金属离子是
(3)若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为
(4)如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近一年使用:0次
解题方法
6 .  具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:___________ ;加入 的目的是
的目的是___________ 。
(2)滤渣1的主要成分为___________ 、___________ 及不溶于酸、碱的杂质;加入 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
___________ 。
(3)若通入过量 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为___________ 。
(4)写出洗去固体A表面杂质的简要操作:___________ 。
(5)“煅烧”固体A反应的化学方程式为___________ 。
 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、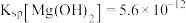 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:
 的目的是
的目的是(2)滤渣1的主要成分为
 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
(3)若通入过量
 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为(4)写出洗去固体A表面杂质的简要操作:
(5)“煅烧”固体A反应的化学方程式为
您最近一年使用:0次
2024-04-25更新
|
180次组卷
|
3卷引用:内蒙古自治区赤峰第四中学2023-2024学年高三下学期开学考试理综试题-高中化学
解题方法
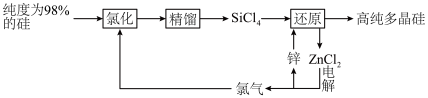
7 . 多晶硅的生产工艺方法主要是改良西门子法,该方法安全可靠,产品纯度高,但是生产成本较高.锌还原法成本低,但制备的多晶硅纯度不高,某研究所对锌还原法进行了研究改良,并成功制得了高纯多晶硅.改良后的锌还原法制备高纯多晶硅的主要流程如图,请回答下列问题: 和焦炭在
和焦炭在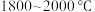 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为___________ ,该反应的氧化产物为___________ (填化学式).高纯硅常用作半导体材料,下列可用作半导体材料的是___________ (填标号).
A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成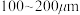 的粉末,这样做的目的是
的粉末,这样做的目的是___________ ;“精馏”可获得纯度为99.99%以上的高纯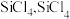 的电子式为
的电子式为___________ ;
(3)“还原”时的温度约为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;“电解”时,熔融 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于___________ (填“离子”或“共价”)化合物,“电解”反应中,每消耗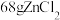 ,则生成
,则生成___________ L(换算成标准状况) 。
。
 和焦炭在
和焦炭在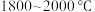 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成
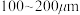 的粉末,这样做的目的是
的粉末,这样做的目的是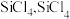 的电子式为
的电子式为(3)“还原”时的温度约为
 ,该反应的化学方程式为
,该反应的化学方程式为 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于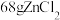 ,则生成
,则生成 。
。
您最近一年使用:0次
解题方法
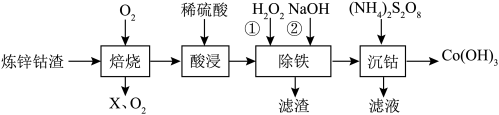
8 . 某校化学研究小组以炼锌钴渣(主要含有Co、Zn、Fe、Ni的金属硫化物)为原料制备Co(OH)3(氢氧化高钴)的流程如图,以实现“变废为宝”。 )时的
)时的 如表所示。
如表所示。
回答下列问题:
(1)在“焙烧”前,将炼锌钴渣磨成细粉,目的是_______ ,“ ”是
”是_______ (写化学式)。
(2)加入硫酸“酸浸”时发生的反应有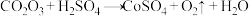 (未配平),该反应中的氧化产物与还原产物的物质的量之比为
(未配平),该反应中的氧化产物与还原产物的物质的量之比为_______ 。
(3)“除铁”时 与先加入的
与先加入的 发生反应的化学方程式为
发生反应的化学方程式为_______ ,反应温度不宜超过55℃的原因是_______ 。
(4)“沉钴”时,使用 调节溶液
调节溶液 ,
, 可将
可将 转化为
转化为 ,自身被还原为
,自身被还原为 ,发生该反应的离子方程式为
,发生该反应的离子方程式为___ ,得到的 经过滤、洗涤、干燥得到较纯产品,检验沉淀是否洗涤干净的操作及现象为
经过滤、洗涤、干燥得到较纯产品,检验沉淀是否洗涤干净的操作及现象为_______ 。
(5)若调节“沉钴”后滤液的 ,同时出现
,同时出现 和
和 沉淀,此时溶液中
沉淀,此时溶液中
_______ 。
 )时的
)时的 如表所示。
如表所示。| 离子 |  |  |  |  |  |  |
开始沉淀时的 | 1.5 | 6.3 | 7.0 | — | 6.4 | 7.2 |
完全沉淀时的 | 2.8 | 8.3 | 9.0 | 1.0 | 8.4 | 9.2 |
(1)在“焙烧”前,将炼锌钴渣磨成细粉,目的是
 ”是
”是(2)加入硫酸“酸浸”时发生的反应有
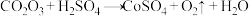 (未配平),该反应中的氧化产物与还原产物的物质的量之比为
(未配平),该反应中的氧化产物与还原产物的物质的量之比为(3)“除铁”时
 与先加入的
与先加入的 发生反应的化学方程式为
发生反应的化学方程式为(4)“沉钴”时,使用
 调节溶液
调节溶液 ,
, 可将
可将 转化为
转化为 ,自身被还原为
,自身被还原为 ,发生该反应的离子方程式为
,发生该反应的离子方程式为 经过滤、洗涤、干燥得到较纯产品,检验沉淀是否洗涤干净的操作及现象为
经过滤、洗涤、干燥得到较纯产品,检验沉淀是否洗涤干净的操作及现象为(5)若调节“沉钴”后滤液的
 ,同时出现
,同时出现 和
和 沉淀,此时溶液中
沉淀,此时溶液中
您最近一年使用:0次
解题方法
9 . 一种从水钴矿(含 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
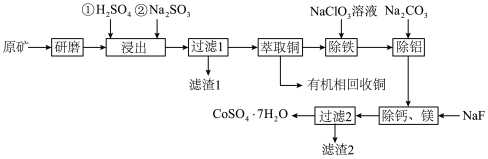
请回答下列问题:
(1)“研磨”的目的是___________ 。
(2)“浸出”时, 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
(3)滤渣1的成分是___________ 。
(4)“除铁”时, 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为___________ ;“除铝”时加入 的目的是
的目的是___________ 。
(5)已知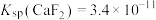 ,
,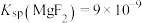 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中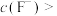
___________  。
。
(6)由“过滤2”后的母液得到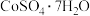 的操作是
的操作是___________ ,___________ 、过滤、洗涤、干燥。
 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是
(2)“浸出”时,
 被浸出的化学方程式为
被浸出的化学方程式为(3)滤渣1的成分是
(4)“除铁”时,
 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为 的目的是
的目的是(5)已知
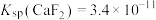 ,
,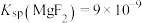 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中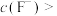
 。
。(6)由“过滤2”后的母液得到
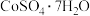 的操作是
的操作是
您最近一年使用:0次
名校
10 . Li2CO3是制备锂离子电极材料LiFePO4的重要原料。以盐湖卤水(主要含有NaCl、MgCl2、LiCl和Na2B4O7等)为原料提取Li2CO3并制备LiFePO4的工艺流程如图所示:

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:
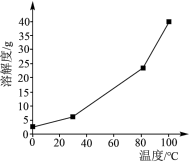
已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与______ mL2.5mol/LNaOH溶液完全反应。“酸化脱硼”中采用______ (填“加热”或“冷却”),其目的是______ 。
(2)“水浸”后的溶液中溶质的主要成分是______ 。
(3)“蒸发分解”生成Li2CO3的化学方程式为______ 。
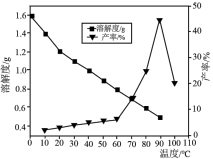
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是______ ,制得的Li2CO3沉淀需要进行洗涤,具体操作为______ 。
(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为______ 。

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:

已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与
(2)“水浸”后的溶液中溶质的主要成分是
(3)“蒸发分解”生成Li2CO3的化学方程式为
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是

(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为
您最近一年使用:0次



