名校
解题方法
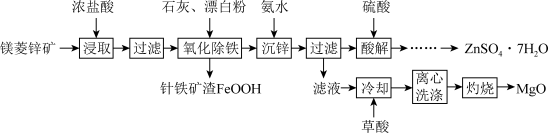
1 . 镁菱锌矿(主要成分为ZnCO3、MgCO3等,含有少量FeCO3、CaCO3等杂质)可用于生产媒染剂、防腐剂ZnSO4•7H2O以及耐火材料MgO。制备工艺流程如图:
回答下列有关问题:
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是_______ 。
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为_______ 。
(3)“沉锌”时,加入氨水调节pH的范围是_______ 。
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、_______ 制得的ZnSO4•7H2O在烘干时需减压烘干的原因是_______ 。
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:_______ 。
| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Mg2+ | Ca2+ |
| 开始沉淀 | 2.7 | 7.6 | 6.2 | 9.4 | 13 |
| 完全沉淀 | 3.7 | 9.6 | 8.2 | 12.4 | _______ |
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为
(3)“沉锌”时,加入氨水调节pH的范围是
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:
您最近一年使用:0次
解题方法
2 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为_______ , 的配位数为
的配位数为_______ 。区别 和
和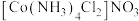 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,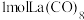 含
含_______  键。
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为 的配位数为
的配位数为 和
和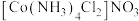 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是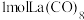 含
含 键。
键。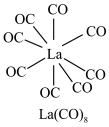
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)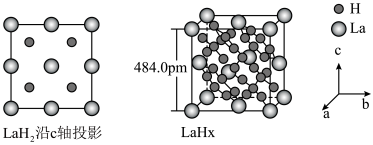
您最近一年使用:0次
3 . 某矿物炼铜后的矿渣固体主要成分为 、
、 、
、 以及少量的CuO、PbO、
以及少量的CuO、PbO、 等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。
等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。 ;
; ;
;
②CuO和PbO均具有一定的“两性”,“碱浸”时均能溶于氢氧化钠溶液。
回答下列问题:
(1)“碱浸”时应进行加热、搅拌等操作,目的是___________ 。
(2)下图为温度和NaOH溶液浓度对确浸出率的影响,实际生产中“碱浸”工序的反应条件为80℃、 的NaOH溶液,而不用更高温度和更大浓度NaOH溶液的原因是
的NaOH溶液,而不用更高温度和更大浓度NaOH溶液的原因是___________ 。 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)滤渣3的主要成分为___________ 。滤液1中 沉淀完全时,
沉淀完全时, 的最大值是
的最大值是___________  (保留小数点后2位。某离子浓度低于
(保留小数点后2位。某离子浓度低于 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(5)在 溶液中通入
溶液中通入 制Se的离子方程式为
制Se的离子方程式为___________ 。
(6)电解后电解液可返回___________ 工序循环使用。
 、
、 、
、 以及少量的CuO、PbO、
以及少量的CuO、PbO、 等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。
等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。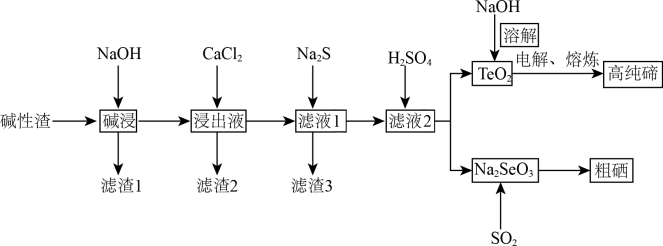
 ;
;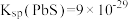 ;
;②CuO和PbO均具有一定的“两性”,“碱浸”时均能溶于氢氧化钠溶液。
回答下列问题:
(1)“碱浸”时应进行加热、搅拌等操作,目的是
(2)下图为温度和NaOH溶液浓度对确浸出率的影响,实际生产中“碱浸”工序的反应条件为80℃、
 的NaOH溶液,而不用更高温度和更大浓度NaOH溶液的原因是
的NaOH溶液,而不用更高温度和更大浓度NaOH溶液的原因是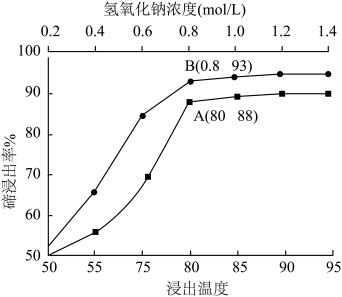
 发生反应的离子方程式为
发生反应的离子方程式为(4)滤渣3的主要成分为
 沉淀完全时,
沉淀完全时, 的最大值是
的最大值是 (保留小数点后2位。某离子浓度低于
(保留小数点后2位。某离子浓度低于 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(5)在
 溶液中通入
溶液中通入 制Se的离子方程式为
制Se的离子方程式为(6)电解后电解液可返回
您最近一年使用:0次
解题方法
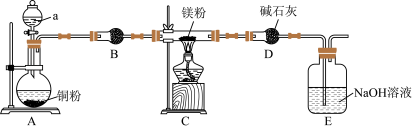
4 . 镁及其化合物是实验设计的热点载体。某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。 能与水反应;②反应完后E中有
能与水反应;②反应完后E中有 。
。
回答下列问题:
(1)仪器a的名称为___________ ;a中试剂是___________ 。
(2)实验时,为了防止Mg与空气中氧气等反应,操作为___________ 。
(3)实验测得Mg与 反应生成MgO、
反应生成MgO、 和
和 ,其中
,其中 和
和 的物质的量相等,则C中反应的化学方程式为
的物质的量相等,则C中反应的化学方程式为___________ 。装置D的作用是___________ 。
(4)E装置中发生反应的离子方程式为___________ 。
(5)写出氮化镁与水反应的化学方程式___________ 。
(6)已知浓硝酸分解反应为: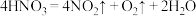 ,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出
,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出 气体能支持燃烧的说法,你认为该说法正确吗?并说明理由
气体能支持燃烧的说法,你认为该说法正确吗?并说明理由___________ 。
 能与水反应;②反应完后E中有
能与水反应;②反应完后E中有 。
。回答下列问题:
(1)仪器a的名称为
(2)实验时,为了防止Mg与空气中氧气等反应,操作为
(3)实验测得Mg与
 反应生成MgO、
反应生成MgO、 和
和 ,其中
,其中 和
和 的物质的量相等,则C中反应的化学方程式为
的物质的量相等,则C中反应的化学方程式为(4)E装置中发生反应的离子方程式为
(5)写出氮化镁与水反应的化学方程式
(6)已知浓硝酸分解反应为:
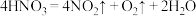 ,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出
,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出 气体能支持燃烧的说法,你认为该说法正确吗?并说明理由
气体能支持燃烧的说法,你认为该说法正确吗?并说明理由
您最近一年使用:0次
解题方法
5 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: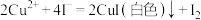 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
 和
和 的部分实验步骤如下:
的部分实验步骤如下: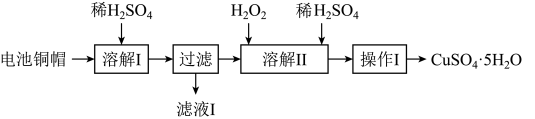
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
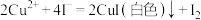 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近一年使用:0次
解题方法
6 . 某工厂以粗硅藻土 主要成分是
主要成分是 和有机质,并含有少量的
和有机质,并含有少量的 、
、 等杂质
等杂质 ,生产精制硅藻土并获得
,生产精制硅藻土并获得 及高铁酸钾
及高铁酸钾 的工艺流程如下:
的工艺流程如下:
(1)粗硅藻土在煅烧过程中,为了加快反应速率可以采取的措施有___________  写两条
写两条 。
。
(2)查阅资料得知:常温下 、
、 在浓度为
在浓度为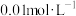 时,氢氧化物沉淀的
时,氢氧化物沉淀的 如下表:
如下表:
要使 与
与 分离,应调节溶液的
分离,应调节溶液的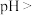
___________ ;根据表中数据,该温度下
___________ 。
(3)滤液 中通入过量
中通入过量 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)滤渣 与
与 溶液、
溶液、 反应的化学方程式为
反应的化学方程式为___________ ;在该反应中每生成 ,转移的电子数为
,转移的电子数为___________ 。
(5)工业可利用电解法制取高铁酸钾 ,装置示意图如下:
,装置示意图如下: 在电解时,镍电极接电源的
在电解时,镍电极接电源的___________ 极 填“正”或“负”
填“正”或“负” 。
。
 在电解过程中,阳极的电极反应式为
在电解过程中,阳极的电极反应式为___________ ;阴极区溶液的
___________ (填“增大”“减少”或“不变” 。
。
 主要成分是
主要成分是 和有机质,并含有少量的
和有机质,并含有少量的 、
、 等杂质
等杂质 ,生产精制硅藻土并获得
,生产精制硅藻土并获得 及高铁酸钾
及高铁酸钾 的工艺流程如下:
的工艺流程如下: 
(1)粗硅藻土在煅烧过程中,为了加快反应速率可以采取的措施有
 写两条
写两条 。
。(2)查阅资料得知:常温下
 、
、 在浓度为
在浓度为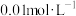 时,氢氧化物沉淀的
时,氢氧化物沉淀的 如下表:
如下表:| 氢氧化物 |  |  |  在 在 时开始溶解, 时开始溶解, 完全溶解 完全溶解 |
开始沉淀的 |  | 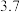 | |
完全沉淀的 |  | 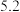 |
 与
与 分离,应调节溶液的
分离,应调节溶液的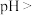

(3)滤液
 中通入过量
中通入过量 发生反应的离子方程式为
发生反应的离子方程式为(4)滤渣
 与
与 溶液、
溶液、 反应的化学方程式为
反应的化学方程式为 ,转移的电子数为
,转移的电子数为(5)工业可利用电解法制取高铁酸钾
 ,装置示意图如下:
,装置示意图如下:
 在电解时,镍电极接电源的
在电解时,镍电极接电源的 填“正”或“负”
填“正”或“负” 。
。 在电解过程中,阳极的电极反应式为
在电解过程中,阳极的电极反应式为
 。
。
您最近一年使用:0次
名校
解题方法
7 . 工业上以软锰矿(主要成分为MnO2,还含有少量Fe2O3)和辉钼矿(主要成分为MoS2,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体[(NH4)2Mo4O13 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下:  分别为19.4和12.6;
分别为19.4和12.6; 。
。
回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有___________ (写一条即可);“高温焙烧”时MnO2、MoS2转化为MnMoO4、MnSO4,写出该反应的化学方程式___________ 。
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式___________ 。
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是___________ [已知pc(S2-)=-lgc(S2-),该溶液中pc(S2-)和pH的关系为pc(S2-)=15.1-pH;忽略溶液体积变化]。
(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,___________ ,使固体MnSO4 H2O与溶液分离,
H2O与溶液分离,___________ ,真空干燥。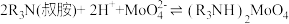 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用___________ (填标号)。
a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是___________ (填名称)。
 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下: 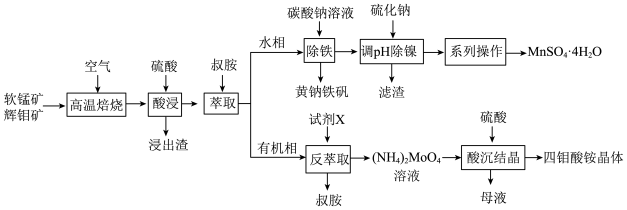
 分别为19.4和12.6;
分别为19.4和12.6; 。
。回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol
 L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4
 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶, H2O与溶液分离,
H2O与溶液分离,
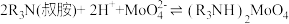 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是
您最近一年使用:0次
解题方法
8 . 锂离子电池正极材料(主要成分为 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: ,
, ,
, 。
。
回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入 溶液中,其目的是
溶液中,其目的是________ 。
(2)滤液1的主要成分是________ (填化学式,下同)。滤液2的主要成分是________ 。
(3)“酸溶”时发生的主要反应的离子方程式________ ;不用盐酸替代硫酸的原因是________ 。
(4)不宜使用 沉钴的原因是
沉钴的原因是________ 。
(5) ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的 ,应控制溶液的
,应控制溶液的
________ 。
(6)若最终得到产品 ,则可以重新制备
,则可以重新制备________  正极材料(含钴
正极材料(含钴 )。
)。
 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: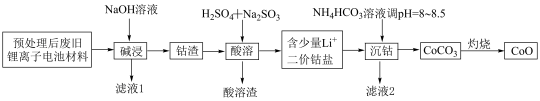
 ,
, ,
, 。
。回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入
 溶液中,其目的是
溶液中,其目的是(2)滤液1的主要成分是
(3)“酸溶”时发生的主要反应的离子方程式
(4)不宜使用
 沉钴的原因是
沉钴的原因是(5)
 ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的 ,应控制溶液的
,应控制溶液的
(6)若最终得到产品
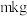 ,则可以重新制备
,则可以重新制备 正极材料(含钴
正极材料(含钴 )。
)。
您最近一年使用:0次
解题方法
9 . 铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。日常生活中可通过食物摄入铁元素,例如黑木耳中就含有比较丰富的铁元素。某研究性学习小组为测定某地黑木耳中铁的含量,开展了如下研究与实践活动。
【研究与实践活动一】
研究黑木耳中含铁物质的水溶性:称取 黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
【研究与实践活动二】
研究黑木耳中铁的含量:称取 黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质___________ (填“难”或“易”)溶于水。
(2)取少量滤液于试管中,滴入 溶液,溶液变红。则滤液中铁元素的存在形式有
溶液,溶液变红。则滤液中铁元素的存在形式有 、
、___________ (填离子符号)。
(3)滤液与Fe生成A的离子方程式为___________ 。
(4)由A转化为B可加入的试剂X可以是___________ (填标号)。
a.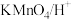 b.
b. c.
c.
(5)由C转化成D的现象:白色沉淀迅速变为灰绿色,最终变为___________ 。C转化成D的化学方程式为___________ 。
(6)将 黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到
黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到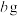 红棕色固体。若流程中加入的铁反应掉
红棕色固体。若流程中加入的铁反应掉 ,则该黑木耳中铁元素的质量分数为
,则该黑木耳中铁元素的质量分数为___________ (用含a、b、c的代数式表示)。
【研究与实践活动一】
研究黑木耳中含铁物质的水溶性:称取
 黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。【研究与实践活动二】
研究黑木耳中铁的含量:称取
 黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。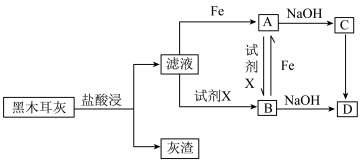
(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质
(2)取少量滤液于试管中,滴入
 溶液,溶液变红。则滤液中铁元素的存在形式有
溶液,溶液变红。则滤液中铁元素的存在形式有 、
、(3)滤液与Fe生成A的离子方程式为
(4)由A转化为B可加入的试剂X可以是
a.
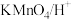 b.
b. c.
c.
(5)由C转化成D的现象:白色沉淀迅速变为灰绿色,最终变为
(6)将
 黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到
黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到 红棕色固体。若流程中加入的铁反应掉
红棕色固体。若流程中加入的铁反应掉 ,则该黑木耳中铁元素的质量分数为
,则该黑木耳中铁元素的质量分数为
您最近一年使用:0次
解题方法
10 .  在室温下为无色液体,易挥发,有强烈的刺激性气味,遇水强烈水解,并放出大量的热,可用
在室温下为无色液体,易挥发,有强烈的刺激性气味,遇水强烈水解,并放出大量的热,可用 与
与 和
和 在加热的条件下来制备。
在加热的条件下来制备。
(1)用所给仪器和药品制备 ,仪器各接口的连接顺序是
,仪器各接口的连接顺序是_________ (填标号)。
(2)当________ 时,点燃装置 处的酒精灯来制备
处的酒精灯来制备 ;装置
;装置 的作用为
的作用为__________ 。
(3)写出装置E的硬质玻璃管中反应的化学方程式:_________ ;装置 水槽中盛放的是
水槽中盛放的是______ (填“冷水”或“热水”)。
(4)该制备 的装置有一定的缺陷,其改进措施是
的装置有一定的缺陷,其改进措施是_________ 。
(5)氮化硅 是一种高温结构陶瓷材料,
是一种高温结构陶瓷材料, 可以在高温条件下由
可以在高温条件下由 蒸气与
蒸气与 反应得到,写出该反应的化学方程式:
反应得到,写出该反应的化学方程式:_________ 。
 在室温下为无色液体,易挥发,有强烈的刺激性气味,遇水强烈水解,并放出大量的热,可用
在室温下为无色液体,易挥发,有强烈的刺激性气味,遇水强烈水解,并放出大量的热,可用 与
与 和
和 在加热的条件下来制备。
在加热的条件下来制备。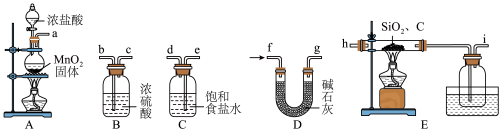
(1)用所给仪器和药品制备
 ,仪器各接口的连接顺序是
,仪器各接口的连接顺序是(2)当
 处的酒精灯来制备
处的酒精灯来制备 ;装置
;装置 的作用为
的作用为(3)写出装置E的硬质玻璃管中反应的化学方程式:
 水槽中盛放的是
水槽中盛放的是(4)该制备
 的装置有一定的缺陷,其改进措施是
的装置有一定的缺陷,其改进措施是(5)氮化硅
 是一种高温结构陶瓷材料,
是一种高温结构陶瓷材料, 可以在高温条件下由
可以在高温条件下由 蒸气与
蒸气与 反应得到,写出该反应的化学方程式:
反应得到,写出该反应的化学方程式:
您最近一年使用:0次



