1 . 亚硝酰氯(NOCl)是有机合成中的重要试剂,熔点为-64.5℃,沸点为-5.5℃,气态呈黄色,液态呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物。NOCl可由NO与Cl2反应制得,相关实验装置如图所示。

回答下列问题:
(1)仪器a的名称是_________ ;装置的连接顺序为A→_________ →D(装置可重复使用);实验开始时先通入干燥纯净的Cl2,当观察到三颈烧瓶中__________________ 时,关闭活塞b,再通入NO。
(2)装置A中发生反应的化学方程式为__________________ ;装置C的作用是__________________ ;装置D吸收NO尾气生成MnO2和 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为_________ 。
(3)取三颈烧瓶中所得产品mg溶于水,配成250mL溶液;取出25.00mL溶液,加入稀硝酸酸化后,与VmLcmol·L-1AgNO3溶液恰好完全反应(杂质不参与反应),则产品中NOCl的质量分数为_________ 。

回答下列问题:
(1)仪器a的名称是
(2)装置A中发生反应的化学方程式为
 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为(3)取三颈烧瓶中所得产品mg溶于水,配成250mL溶液;取出25.00mL溶液,加入稀硝酸酸化后,与VmLcmol·L-1AgNO3溶液恰好完全反应(杂质不参与反应),则产品中NOCl的质量分数为
您最近一年使用:0次
解题方法
2 . 21世纪是海洋的世纪。向海则兴、背海则衰。要提高海洋资源开发能力,着力推动海洋经济向质量效益型转变。下图涉及多个以海水为原料的生产流程。
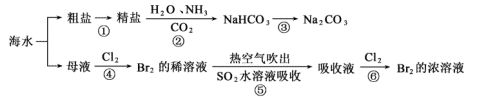
完成下列填空:
(1)写出步骤③的化学方程式:___________ 。
(2)工业上用Cl2与KOH(热溶液)制备KClO3,反应如下:Cl2+KOH→KCl+KClO3+H2O(未配平)上述反应中氧化剂与还原剂的物质的量之比为:___________ 。
(3)下列说法错误的是___________
a.步骤④中实验室制取氯气的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+H2O。
MnCl2+Cl2↑+H2O。
b.步骤②既是离子反应又是氧化还原反应
c.步骤⑤中每有1mol SO2参加反应生成1mol SO 转移2NA个电子。
转移2NA个电子。
d.第⑤⑥步骤的目的是进行溴的富集,提高Br2的浓度
(4)已知氨气极易溶于水,水溶液呈碱性,CO2在水中的溶解度不大,步骤②是在饱和食盐水中先通入NH3再通入CO2,原因是___________ 。
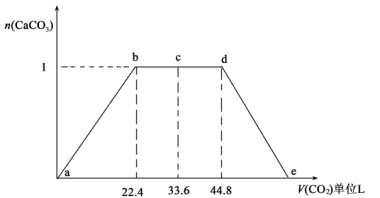
(5)某同学将CO2通入500mlNaOH与Ca(OH)2的混合溶液中,通入CO2的体积(已换算成标况)与沉淀的量如图所示,写出c-d段发生的离子反应方程式:___________ 。由图可知混合溶液中NaOH的物质的量浓度为___________ 。

完成下列填空:
(1)写出步骤③的化学方程式:
(2)工业上用Cl2与KOH(热溶液)制备KClO3,反应如下:Cl2+KOH→KCl+KClO3+H2O(未配平)上述反应中氧化剂与还原剂的物质的量之比为:
(3)下列说法错误的是
a.步骤④中实验室制取氯气的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+H2O。
MnCl2+Cl2↑+H2O。b.步骤②既是离子反应又是氧化还原反应
c.步骤⑤中每有1mol SO2参加反应生成1mol SO
 转移2NA个电子。
转移2NA个电子。d.第⑤⑥步骤的目的是进行溴的富集,提高Br2的浓度
(4)已知氨气极易溶于水,水溶液呈碱性,CO2在水中的溶解度不大,步骤②是在饱和食盐水中先通入NH3再通入CO2,原因是
(5)某同学将CO2通入500mlNaOH与Ca(OH)2的混合溶液中,通入CO2的体积(已换算成标况)与沉淀的量如图所示,写出c-d段发生的离子反应方程式:

您最近一年使用:0次
2021-11-20更新
|
235次组卷
|
3卷引用:山东省临沂市兰陵县2021-2022学年高一上学期期中考试化学试题



