名校
解题方法
1 . 绿水青山是习总书记构建美丽中国的伟大构想,水质净化是水质检验员的主要工作之一,某水质检验员在研究高铁酸钾( )对饮用水消毒时,发现其原理为:
)对饮用水消毒时,发现其原理为:
① ,
, 是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾有强氧化性,酸性条件下,其氧化性强于
是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾有强氧化性,酸性条件下,其氧化性强于 、
、 等。
等。
常通过以下两步反应制备 :
:
②
③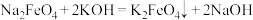
(1)反应②中氧化剂和还原剂的微粒数之比为___________ ,方程式①中,与水反应每消耗1个 转移
转移___________ 个电子。
(2) 还可以用于处理废水,例如可以把废水中的
还可以用于处理废水,例如可以把废水中的 转化为两种无毒气体,反应过程中,氧化剂是
转化为两种无毒气体,反应过程中,氧化剂是___________ ,氧化产物是___________ 。
(3)简要说明 作为水处理剂(消毒杀菌和净水)时所起的作用:
作为水处理剂(消毒杀菌和净水)时所起的作用:___________ 。
(4)为了鉴别 和
和 两种紫色溶液,用一束光照射
两种紫色溶液,用一束光照射 溶液,
溶液,___________ (填“能”或者“不能”)看到一条光亮的通路。
(5)另一种在碱性条件下制备 的反应可能为(配平下列离子方程):
的反应可能为(配平下列离子方程):____________
_____ _____
_____ ______
______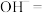 ____
____ _____
_____ _____
_____
 )对饮用水消毒时,发现其原理为:
)对饮用水消毒时,发现其原理为:①
 ,
, 是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾有强氧化性,酸性条件下,其氧化性强于
是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾有强氧化性,酸性条件下,其氧化性强于 、
、 等。
等。常通过以下两步反应制备
 :
:②

③
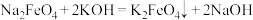
(1)反应②中氧化剂和还原剂的微粒数之比为
 转移
转移(2)
 还可以用于处理废水,例如可以把废水中的
还可以用于处理废水,例如可以把废水中的 转化为两种无毒气体,反应过程中,氧化剂是
转化为两种无毒气体,反应过程中,氧化剂是(3)简要说明
 作为水处理剂(消毒杀菌和净水)时所起的作用:
作为水处理剂(消毒杀菌和净水)时所起的作用:(4)为了鉴别
 和
和 两种紫色溶液,用一束光照射
两种紫色溶液,用一束光照射 溶液,
溶液,(5)另一种在碱性条件下制备
 的反应可能为(配平下列离子方程):
的反应可能为(配平下列离子方程):_____
 _____
_____ ______
______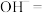 ____
____ _____
_____ _____
_____
您最近一年使用:0次
名校
解题方法
2 . I、地球上的金属矿物资源是有限的,应合理开发利用。
铜在自然界存在于多种矿石中,如:
(1)若 中Cu为+1价、Fe为+3价,高温焙烧时发生的反应是
中Cu为+1价、Fe为+3价,高温焙烧时发生的反应是 ,焙烧过程中被还原的元素有
,焙烧过程中被还原的元素有___________ 。
(2)工业上以辉铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为: ,该反应中氧化剂是
,该反应中氧化剂是___________ ;
(3) 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为___________ 。
II. 是一种常用的氧化剂,工业上用途广泛
是一种常用的氧化剂,工业上用途广泛
(4)工业上可以用浓氨水检验输送氯气的管道是否泄漏,原理为
①该反应中氧化剂与还原剂的分子个数比为___________
②请用单线桥标出该反应中电子转移的方向和数目___________
(5) 与浓盐酸在一定温度下反应会生成氯气和黄绿色的易爆物质
与浓盐酸在一定温度下反应会生成氯气和黄绿色的易爆物质 ,化学方程式:
,化学方程式:
① 。
。___________
②浓盐酸在反应中显示出来的性质是___________ (填写编号)。
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③若产生7.1g ,则生成
,则生成 的质量为
的质量为___________ g。
铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 |  |  |  |
 中Cu为+1价、Fe为+3价,高温焙烧时发生的反应是
中Cu为+1价、Fe为+3价,高温焙烧时发生的反应是 ,焙烧过程中被还原的元素有
,焙烧过程中被还原的元素有(2)工业上以辉铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为:
 ,该反应中氧化剂是
,该反应中氧化剂是(3)
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为II.
 是一种常用的氧化剂,工业上用途广泛
是一种常用的氧化剂,工业上用途广泛(4)工业上可以用浓氨水检验输送氯气的管道是否泄漏,原理为

①该反应中氧化剂与还原剂的分子个数比为
②请用单线桥标出该反应中电子转移的方向和数目
(5)
 与浓盐酸在一定温度下反应会生成氯气和黄绿色的易爆物质
与浓盐酸在一定温度下反应会生成氯气和黄绿色的易爆物质 ,化学方程式:
,化学方程式:①
 。
。②浓盐酸在反应中显示出来的性质是
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③若产生7.1g
 ,则生成
,则生成 的质量为
的质量为
您最近一年使用:0次
2023-09-27更新
|
140次组卷
|
2卷引用:四川省绵阳中学2023-2024学年高一上学期9月月考化学试题
解题方法
3 . 实验室制取Cl2并用Cl2与铜粉反应,制取并收集产物。根据下图回答问题:

(1)写出装置A中发生反应的化学方程式___________ 。
(2)B中最适宜选用的试剂:___________ 。
(3)D中的现象是___________ ;D与E间最好选用粗而短的导管的原因:___________ 。
(4)装置A中若有0.2 mol HCl参加反应,则被氧化的HCl为___________ mol。
(5)若E中盛装蒸馏水,装置F的作用:___________ ;反应的化学方程式为___________ 。
(6)若装置E中装入足量NaOH溶液,则E中的现象:___________ 。反应的离子方程式___________ 。
(7)若无D装置且E中盛有KI -淀粉的混合溶液,E中的现象:___________ ,反应的离子方程式___________ 。

(1)写出装置A中发生反应的化学方程式
(2)B中最适宜选用的试剂:
(3)D中的现象是
(4)装置A中若有0.2 mol HCl参加反应,则被氧化的HCl为
(5)若E中盛装蒸馏水,装置F的作用:
(6)若装置E中装入足量NaOH溶液,则E中的现象:
(7)若无D装置且E中盛有KI -淀粉的混合溶液,E中的现象:
您最近一年使用:0次
名校
解题方法
4 . 硫及其部分化合物的“价类二维图”如下图所示,回答下列问题:
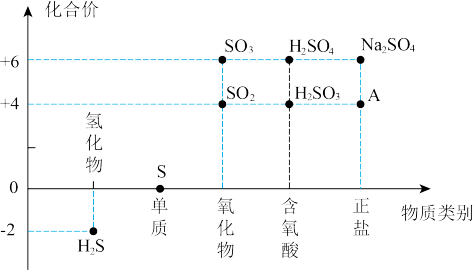
(1)向A的水溶液中滴加NaOH溶液并加热,产生一种能使润湿的红色石蕊试纸变蓝的气体,则A物质的化学式为___________ ,含有的化学键类型为___________ 。
(2)某实验小组为了验证固体A中含有碳酸钠杂质,选用下列装置进行实验:
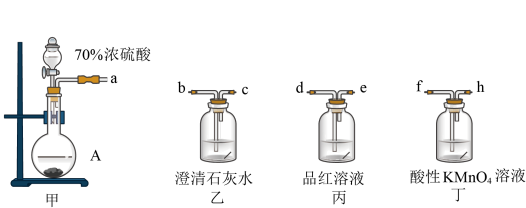
①实验装置的连接顺序为___________ (填选项字母),丁中反应的离子方程式___________ 。
A.abcfhde B.afhedbc C.afhdebc
②能证明固体A中含有碳酸钠的实验现象是___________ 。
(3)向 的水溶液中通入
的水溶液中通入 气体,会产生少量淡黄色沉淀,则反应中氧化剂与还原剂的物质的量之比为
气体,会产生少量淡黄色沉淀,则反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)某实验小组设计了两种制备硫酸铜的方案。
方案Ⅰ: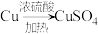
方案Ⅱ: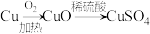
方案___________ (填“Ⅰ”或“Ⅱ”)更合理,理由为___________ 。

(1)向A的水溶液中滴加NaOH溶液并加热,产生一种能使润湿的红色石蕊试纸变蓝的气体,则A物质的化学式为
(2)某实验小组为了验证固体A中含有碳酸钠杂质,选用下列装置进行实验:
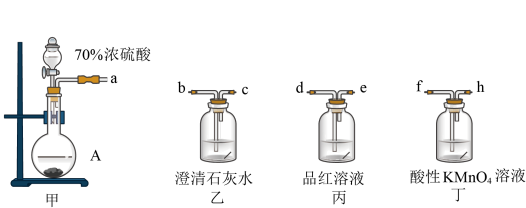
①实验装置的连接顺序为
A.abcfhde B.afhedbc C.afhdebc
②能证明固体A中含有碳酸钠的实验现象是
(3)向
 的水溶液中通入
的水溶液中通入 气体,会产生少量淡黄色沉淀,则反应中氧化剂与还原剂的物质的量之比为
气体,会产生少量淡黄色沉淀,则反应中氧化剂与还原剂的物质的量之比为(4)某实验小组设计了两种制备硫酸铜的方案。
方案Ⅰ:
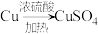
方案Ⅱ:
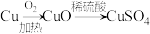
方案
您最近一年使用:0次
2023-06-30更新
|
89次组卷
|
2卷引用:四川省达州市2022-2023学年高一下学期期末统考化学试题
5 . 从电解阳极泥中提取单质硒的工艺流程如下:
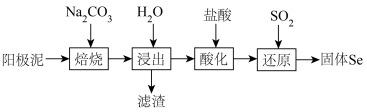
已知:Se在阳极泥中主要以 形式存在,焙烧后转化为
形式存在,焙烧后转化为 ,硒化物有毒。
,硒化物有毒。
下列说法中正确的是

已知:Se在阳极泥中主要以
 形式存在,焙烧后转化为
形式存在,焙烧后转化为 ,硒化物有毒。
,硒化物有毒。下列说法中正确的是
A.若焙烧时反应为 ,反应转移电子12mol ,反应转移电子12mol |
| B.焙烧时需要使用玻璃棒、陶瓷坩埚等仪器 |
C.还原过程中,氧化剂和还原剂的物质的量之比为 |
D.硒代硫酸钠(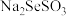 )与 )与 反应可以得到固体Se 反应可以得到固体Se |
您最近一年使用:0次
6 .  粉末在浓度极稀的硝酸(过量)溶液中,发生的反应为
粉末在浓度极稀的硝酸(过量)溶液中,发生的反应为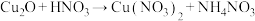
 (未配平),下列说法正确的是
(未配平),下列说法正确的是
 粉末在浓度极稀的硝酸(过量)溶液中,发生的反应为
粉末在浓度极稀的硝酸(过量)溶液中,发生的反应为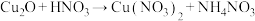
 (未配平),下列说法正确的是
(未配平),下列说法正确的是| A.该反应中参加反应的氧化剂与还原剂的物质的量之比为9:2 |
B.生成的化合物 中N元素的化合价均为+5价 中N元素的化合价均为+5价 |
C.该反应中,每转移0.16mol电子,消耗0.8mol  |
D.反应结束后,取少量上层液于试管中,往试管中加入适量的 白色固体,试管底部会有 白色固体,试管底部会有 白色固体生成 白色固体生成 |
您最近一年使用:0次
2023-03-22更新
|
397次组卷
|
3卷引用:四川省眉山市彭山区第一中学2022-2023学年高一下学期4月月考化学试题
名校
7 . 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。完成下列问题:
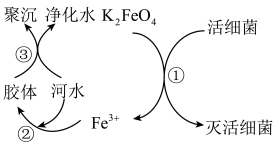
(1)K2FeO4的电离方程式______ 。过程①中K2FeO4表现了______ (填“氧化”或“还原”)性。
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有______ 、______ (填两个)。
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO______ K2FeO4。
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用单线桥法 表示电子转移的方向和数目说明______ ;
世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:
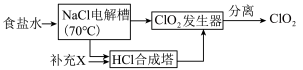
(4)该工艺中,需要补充的物质X为______ (填化学式,下同)。
(5)能参与循环的物质是______ 。
已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:
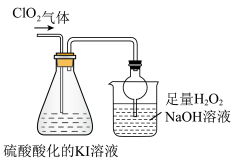
(6)锥形瓶内ClO2进气导管不伸入液面以下,原因是______ 。
(7)烧杯内液体用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2:1,则还原产物的化学式是______ 。
反应后向锥形瓶中加入少量四氯化碳,溶液上下分层,下层为紫红色
已知:I2+Na2S=2NaI+S
(8)若将锥形瓶内溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:______ 。
②请设计实验证明你的假设(仅用离子方程式表示):______ 。

(1)K2FeO4的电离方程式
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用
世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O
 NaClO3+3H2↑
NaClO3+3H2↑发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:

(4)该工艺中,需要补充的物质X为
(5)能参与循环的物质是
已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:

(6)锥形瓶内ClO2进气导管不伸入液面以下,原因是
(7)烧杯内液体用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2:1,则还原产物的化学式是
反应后向锥形瓶中加入少量四氯化碳,溶液上下分层,下层为紫红色
已知:I2+Na2S=2NaI+S
(8)若将锥形瓶内溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:
②请设计实验证明你的假设(仅用离子方程式表示):
您最近一年使用:0次
2023-03-04更新
|
304次组卷
|
2卷引用:四川师范大学附属中学2022-2023学年高一下学期半期考试化学试题
名校
8 . 利用如图所示装置进行 的制备及性质探究实验时,下列说法不正确的是
的制备及性质探究实验时,下列说法不正确的是

 的制备及性质探究实验时,下列说法不正确的是
的制备及性质探究实验时,下列说法不正确的是
| A.甲中反应的氧化剂与还原剂的物质的量之比为1∶4 |
B.乙的作用为除去 中的HCl 中的HCl |
| C.丙中紫色石蕊试液先变红后褪色 |
D.为吸收多余的 ,丁中可盛放NaOH溶液 ,丁中可盛放NaOH溶液 |
您最近一年使用:0次
2023-02-19更新
|
1774次组卷
|
6卷引用:四川省成都市第七中学2023-2024学年高一上学期期中考试化学试题
四川省成都市第七中学2023-2024学年高一上学期期中考试化学试题四川省广安市华蓥中学2023-2024学年高一上学期12月月考化学试题广东省深圳市2022-2023学年高三第一次调研考试化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(选择题6-10)安徽省定远县第三中学2022-2023学年高三下学期二模化学试题(已下线)专题13 化学实验基础
解题方法
9 . 某同学用如图装置制取Cl2并探究其性质,回答下列问题:
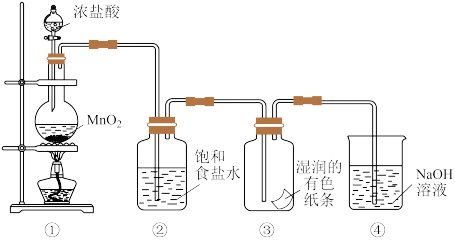
(1)装置①用于制取Cl2,反应的化学方程式是_______ 。
(2)装置②的作用是_______ ,装置③中的现象是_______ 。
(3)装置④的作用是_______ ,如果溶液温度较高,可能发生反应 。该反应中,被氧化的Cl原子和被还原的Cl原子的物质的量之比为
。该反应中,被氧化的Cl原子和被还原的Cl原子的物质的量之比为_______ ,每生成1 mol的NaClO3,转移电子的物质的量为_______ 。
(4)工业上利用下列反应原理检查氯气管道是否漏气,用双线桥标出电子转移的情况。_______ 。3Cl2+8NH3=6NH4Cl+N2
(5)某运输液氯的槽罐车发生泄漏,如果当时你在现场,你应该往哪里撤离?_______ 。(填“高坡上”或“低洼处”)。消防官兵赶到现场后。立即向弥漫氯气的空中喷洒石灰水,写出有关物质之间发生反应的化学方程式:_______ 。

(1)装置①用于制取Cl2,反应的化学方程式是
(2)装置②的作用是
(3)装置④的作用是
 。该反应中,被氧化的Cl原子和被还原的Cl原子的物质的量之比为
。该反应中,被氧化的Cl原子和被还原的Cl原子的物质的量之比为(4)工业上利用下列反应原理检查氯气管道是否漏气,用双线桥标出电子转移的情况。
(5)某运输液氯的槽罐车发生泄漏,如果当时你在现场,你应该往哪里撤离?
您最近一年使用:0次
名校
解题方法
10 . 下列叙述中正确的是
| A.“血液透析”主要是物理过程分离溶液和胶体 |
B. 该反应中氧化产物与还原产物的个数比为1:2 该反应中氧化产物与还原产物的个数比为1:2 |
| C.铁粉常作食品的脱氧剂,生石灰、无水氯化钙、浓硫酸常作食品干燥剂 |
| D.工业上制取NaOH主要采用氧化钠与水的反应,因为原料来源广,成本低 |
您最近一年使用:0次



