解题方法
1 . 锂在电池领域的消费量最大,被称为“21世纪的能源金属”。
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
1.滤渣2的主要成分是_____ ,“除杂2”步骤中氧化剂和还原剂的理论物质的量之比是_____ 。
已知Li2CO3和CaCO3在不同温度下的Ksp:
2.“除杂3”步骤中,原溶液中Ca2+和Li+浓度分别为4.0×10-4mol·L-1和5.0mol·L-1.通过列式计算说明不损失Li+的情况下,Ca2+是否能除尽(工业离子除尽要求是浓度小于1.0×10-6mol·L-1)_____ 。
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为_____ 。
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
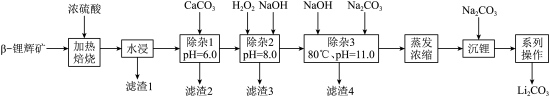
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.2 | 3.7 | 7.5 | 9.6 | 13.37 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 3.2 | 4.7 | 9.0 | 11.0 | — |
已知Li2CO3和CaCO3在不同温度下的Ksp:
| 20℃ | Ksp(Li2CO3)=2.5×10-2 | Ksp (CaCO3)=2.8×10-9 |
| 80℃ | Ksp (Li2CO3)=6.0×10-3 | Ksp (CaCO3)=4.0×10-9 |
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为
您最近一年使用:0次
2 . Ⅰ.完成下列问题
(1)我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,人之亦化为铜。”该炼制过程中没有涉及到的变化是_______
(2)为实现下列物质之间的转化,需要加入还原剂才能实现的是_______
(3)硫单质在反应3S+6KOH 2K2S+K2SO3+3H2O中的变化是_______
2K2S+K2SO3+3H2O中的变化是_______
(4)3Cl2+6KOH(浓) KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______
KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______
(5)神舟十三号载人飞船的燃料可为肼(N2H4),发射时发生的反应为:2N2H4+N2O4=3N2+4H2O,下列说法正确的是
(6)某溶液中可能含有H+、Fe2+、Na+、CO 、SO
、SO 、NO
、NO ,若H+和NO
,若H+和NO 的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______
的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______
Ⅱ.实验室用100mL浓盐酸跟足量的KClO3固体共热制取Cl2,反应的化学方程式为:KClO3+6HCl(浓) KCl+3Cl2↑+3H2O。
KCl+3Cl2↑+3H2O。
(7)用单线桥标出电子转移的方向和数目___________ 。
(8)此反应中,氧化剂为:___________ (填化学式),被氧化的元素为___________ 。
(9)此反应中,氧化产物与还原产物的质量之比为:___________ 。
(10)当有3.36L(STP)Cl2生成时,反应中转移的电子数为___________ 个。
(1)我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,人之亦化为铜。”该炼制过程中没有涉及到的变化是_______
| A.复分解反应 | B.离子反应 | C.置换反应 | D.蒸发结晶 |
| A.KClO3→KCl | B.CuO→Cu | C.Cu→Cu(NO3)2 | D.HCO →CO2 →CO2 |
 2K2S+K2SO3+3H2O中的变化是_______
2K2S+K2SO3+3H2O中的变化是_______| A.被氧化 | B.被还原 |
| C.既被氧化又被还原 | D.既未被氧化又未被还原 |
 KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______
KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______| A.1:5 | B.4:1 | C.5:1 | D.1:4 |
| A.肼在反应中作氧化剂 |
| B.反应中每生成1个H2O转移4个电子 |
| C.N2O4在反应中被氧化 |
| D.氧化产物与还原产物的物质的量之比是2:1 |
 、SO
、SO 、NO
、NO ,若H+和NO
,若H+和NO 的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______
的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______| A.Fe2+ | B.Na+ | C.CO | D.SO |
Ⅱ.实验室用100mL浓盐酸跟足量的KClO3固体共热制取Cl2,反应的化学方程式为:KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O。
KCl+3Cl2↑+3H2O。(7)用单线桥标出电子转移的方向和数目
(8)此反应中,氧化剂为:
(9)此反应中,氧化产物与还原产物的质量之比为:
(10)当有3.36L(STP)Cl2生成时,反应中转移的电子数为
您最近一年使用:0次
名校
3 . NO2是火箭燃料中常用氧化剂,NO是人体中一种传递神经信息的“信使分子”,氮氧化物NOx也是大气污染物之一。
(1)实验室常用一定浓度的硝酸制取NOx。65%的浓硝酸(密度为1.40g/cm3)的物质的量浓度是_______ 。配制100mL0.3mol/L的硝酸需用的定量仪器有(注明仪器规格)_________ 。
工业上在一定的温度和催化剂条件下可用NH3来消除NOx的污染,生成对环境无害的物质。
(2)写出NH3与NO2的化学方程式:________ 。除去5.52gNO2时,氧化产物和还原产物相差______ g。
清华大学有关研究表明,650~850℃时,NOx能够被木炭、无烟煤、焦炭等碳质固体还原,还原率在99%左右。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。
N2(g)+CO2(g)。
(3)在一恒温密闭容器中投入炭和NO,判断该反应达到平衡的标志是______ 。
(4)与氨还原法相比,分析热碳还原法的优缺点:优点是______ ;缺点是______ 。
某温度下,若向2L体积恒定的密闭容器中充入等物质的量N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
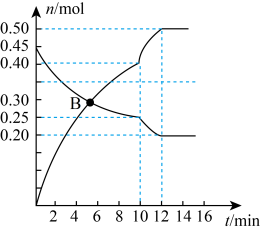
(5)图中B点v正______ v逆。
(6)第10min时,外界改变的条件可能是______ 。
(7)该温度下N2(g)+CO2(g) C(s)+2NO(g)的平衡常数K=
C(s)+2NO(g)的平衡常数K=______ (保留2位小数)。
(1)实验室常用一定浓度的硝酸制取NOx。65%的浓硝酸(密度为1.40g/cm3)的物质的量浓度是
工业上在一定的温度和催化剂条件下可用NH3来消除NOx的污染,生成对环境无害的物质。
(2)写出NH3与NO2的化学方程式:
清华大学有关研究表明,650~850℃时,NOx能够被木炭、无烟煤、焦炭等碳质固体还原,还原率在99%左右。有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。
N2(g)+CO2(g)。(3)在一恒温密闭容器中投入炭和NO,判断该反应达到平衡的标志是
| A.容器内压强不再变化 | B.混合气体的平均相对分子质量不再变化 |
| C.N2和CO2的物质的量之比不再变化 | D.混合气体的密度不再变化 |
(4)与氨还原法相比,分析热碳还原法的优缺点:优点是
某温度下,若向2L体积恒定的密闭容器中充入等物质的量N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
(5)图中B点v正
| A.大于 | B.小于 | C.等于 | D.无法确定 |
(6)第10min时,外界改变的条件可能是
| A.加催化剂 | B.增大C(s)的物质的量 |
| C.减小CO2的物质的量 | D.升温 |
(7)该温度下N2(g)+CO2(g)
 C(s)+2NO(g)的平衡常数K=
C(s)+2NO(g)的平衡常数K=
您最近一年使用:0次
名校
4 . 吸入氧气、排出二氧化碳,这看似再简单不过的新陈代谢,在遥远的太空中却并不容易,因为在航天服、航天器、空间站等密闭系统中,CO2浓度会高得多,而超过一定浓度会导致呼吸急促、头晕头痛、昏迷甚至死亡,因此必须通过一定方法将CO2清除。
I.非再生式氢氧化锂(LiOH)除碳技术
(1)我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附时发生反应的化学方程式为___________ 。采用LiOH而不用NaOH的原因是___________ 。
Ⅱ.再生式快速循环胺技术
(2)以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是___________ 变化。
Ⅲ.萨巴蒂尔(Sabatier)除碳生氧技术
(3)利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。

下列说法错误的是___________。
Ⅳ.富集CO2的原电池模拟装置如图:
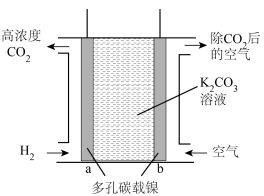
(4)b极为___________ 极,a电极上发生的电极反应为___________ 。
(5)上述电极材料采用多孔碳载镍,“多孔”的优点是___________ 。
(6)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为___________ L(标准状况下)。
V.能量存储与循环技术
(7)将电解水装置与燃料电池配合使用,可实现充放电的循环过程,应用于长寿命的航天器中,工作原理如图:
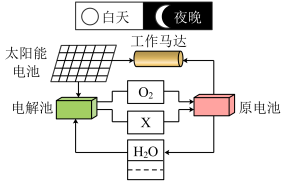
关于该循环系统下列说法正确的是
I.非再生式氢氧化锂(LiOH)除碳技术
(1)我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附时发生反应的化学方程式为
Ⅱ.再生式快速循环胺技术
(2)以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是
Ⅲ.萨巴蒂尔(Sabatier)除碳生氧技术
(3)利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。

下列说法错误的是___________。
| A.CO2的最终产物为CH4和O2 |
| B.电解水装置中,反应物的能量高于生成物的能量 |
| C.萨巴蒂尔反应器中反应的氧化剂与还原剂物质的量之比为1∶4 |
| D.物质转化中O、H原子的利用率均为100% |
Ⅳ.富集CO2的原电池模拟装置如图:

(4)b极为
(5)上述电极材料采用多孔碳载镍,“多孔”的优点是
(6)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为
V.能量存储与循环技术
(7)将电解水装置与燃料电池配合使用,可实现充放电的循环过程,应用于长寿命的航天器中,工作原理如图:

关于该循环系统下列说法正确的是
| A.该系统中存在着太阳能、电能、化学能和机械能之间的相互转化 |
| B.电解池中可选用CuSO4来增强水的导电性 |
| C.太阳能电池帆板的主要成分为SiO2 |
| D.利用太阳能代替化石能源符合“低碳经济” |
您最近一年使用:0次
2023-10-24更新
|
460次组卷
|
3卷引用:上海市复旦大学附属中学2023-2024学年高三上学期暑期学习评估检测化学试题
解题方法
5 . 卤族元素能形成多种物质,结构和性质之间充满联系。
(1)部分卤族元素的某种性质a随核电荷数的变化趋势如图所示,则a表示正确的是_____ 。(填字母)
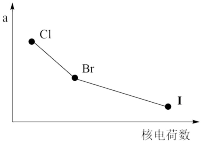
a.原子半径 b.氢化物的稳定性
c.单质的氧化性 d.元素的非金属性
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为_____ ;溴原子核外电子能量最高的电子层符号是_____ 。
(3)ClF3的熔、沸点比BrF3的_____ (填“高”或“低”),理由是_____ 。
ClO2气体可处理污水中的CN-,以下是ClO2的两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(4)ClO2与CN- (C是+2价)反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为_____ 。
(5)请评价上述哪一种方法制备的ClO2更适合用于饮用水的消毒______ 。
(1)部分卤族元素的某种性质a随核电荷数的变化趋势如图所示,则a表示正确的是

a.原子半径 b.氢化物的稳定性
c.单质的氧化性 d.元素的非金属性
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为
(3)ClF3的熔、沸点比BrF3的
ClO2气体可处理污水中的CN-,以下是ClO2的两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(4)ClO2与CN- (C是+2价)反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为
(5)请评价上述哪一种方法制备的ClO2更适合用于饮用水的消毒
您最近一年使用:0次
6 . 氨基钠( )是重要的化学试剂,其与氧气的反应如下:
)是重要的化学试剂,其与氧气的反应如下: 。下列说法正确的是
。下列说法正确的是
 )是重要的化学试剂,其与氧气的反应如下:
)是重要的化学试剂,其与氧气的反应如下: 。下列说法正确的是
。下列说法正确的是A. |
B.每消耗 ,转移电子数是 ,转移电子数是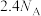 |
C. 是氧化产物 是氧化产物 |
D. 中N的化合价部分发生变化 中N的化合价部分发生变化 |
您最近一年使用:0次
名校
解题方法
7 . 在 元素及其化合物的学习中,我们可以借助“价类二维图”来梳理学习内容。请结合下图,完成相关的问题:
元素及其化合物的学习中,我们可以借助“价类二维图”来梳理学习内容。请结合下图,完成相关的问题:

(1)氯的 价氢化物的水溶液的化学名为
价氢化物的水溶液的化学名为_______ 。
(2)图中过程②是氯气溶于水的过程,写出该反应的化学方程式_______ ;将其滴入少量碳酸氢钠溶液的离子方程式_______ 。将其滴于蓝色石蕊试纸的现象是_______ 。该过程可以检出该混合物中所含有的微粒是_______ 。
(3)某温度下,将 通入
通入 溶液中,反应得到
溶液中,反应得到 、
、 、
、 的混合溶液,经测定
的混合溶液,经测定 与
与 的浓度之比为1:3,则
的浓度之比为1:3,则 与
与 溶液反应时参加反应的
溶液反应时参加反应的 与被氧化的氯气的物质的量之比为
与被氧化的氯气的物质的量之比为_______ ;
(4)图中过程④是制备漂白粉的原理,该反应的原料是氯气和_______ ;(写物质的名称);漂白粉在潮湿的空气中很快变质,写出该过程③的化学方程式:_______ 。
(5)关于 的说法正确的是
的说法正确的是_______ 。
A. 溶液是一种弱电解质 B.
溶液是一种弱电解质 B.  的酸性比碳酸弱
的酸性比碳酸弱
C. 的化学名是氯酸 D.
的化学名是氯酸 D.  溶液是浅黄绿色的
溶液是浅黄绿色的
E. 具有强氧化性 F.
具有强氧化性 F.  具有稳定性
具有稳定性
 元素及其化合物的学习中,我们可以借助“价类二维图”来梳理学习内容。请结合下图,完成相关的问题:
元素及其化合物的学习中,我们可以借助“价类二维图”来梳理学习内容。请结合下图,完成相关的问题:
(1)氯的
 价氢化物的水溶液的化学名为
价氢化物的水溶液的化学名为(2)图中过程②是氯气溶于水的过程,写出该反应的化学方程式
(3)某温度下,将
 通入
通入 溶液中,反应得到
溶液中,反应得到 、
、 、
、 的混合溶液,经测定
的混合溶液,经测定 与
与 的浓度之比为1:3,则
的浓度之比为1:3,则 与
与 溶液反应时参加反应的
溶液反应时参加反应的 与被氧化的氯气的物质的量之比为
与被氧化的氯气的物质的量之比为(4)图中过程④是制备漂白粉的原理,该反应的原料是氯气和
(5)关于
 的说法正确的是
的说法正确的是A.
 溶液是一种弱电解质 B.
溶液是一种弱电解质 B.  的酸性比碳酸弱
的酸性比碳酸弱C.
 的化学名是氯酸 D.
的化学名是氯酸 D.  溶液是浅黄绿色的
溶液是浅黄绿色的E.
 具有强氧化性 F.
具有强氧化性 F.  具有稳定性
具有稳定性
您最近一年使用:0次
8 . 黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),
(1)补全并配平该反应的化学方程式,标出电子转移的数目和方向:_______
□P4+□NaOH+□_______= □PH3↑+□NaH2PO2
标出电子转移的数目和方向:_________
方程式配平_______
(2)其中氧化剂和还原剂质量比为_______ 。
(1)补全并配平该反应的化学方程式,标出电子转移的数目和方向:_______
□P4+□NaOH+□_______= □PH3↑+□NaH2PO2
标出电子转移的数目和方向:
方程式配平
(2)其中氧化剂和还原剂质量比为
您最近一年使用:0次
名校
9 . 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。完成下列问题:
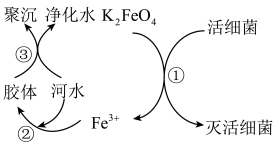
(1)K2FeO4的电离方程式______ 。过程①中K2FeO4表现了______ (填“氧化”或“还原”)性。
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有______ 、______ (填两个)。
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO______ K2FeO4。
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用单线桥法 表示电子转移的方向和数目说明______ ;
世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:
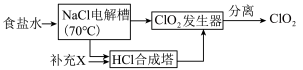
(4)该工艺中,需要补充的物质X为______ (填化学式,下同)。
(5)能参与循环的物质是______ 。
已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:
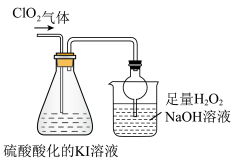
(6)锥形瓶内ClO2进气导管不伸入液面以下,原因是______ 。
(7)烧杯内液体用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2:1,则还原产物的化学式是______ 。
反应后向锥形瓶中加入少量四氯化碳,溶液上下分层,下层为紫红色
已知:I2+Na2S=2NaI+S
(8)若将锥形瓶内溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:______ 。
②请设计实验证明你的假设(仅用离子方程式表示):______ 。

(1)K2FeO4的电离方程式
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用
世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O
 NaClO3+3H2↑
NaClO3+3H2↑发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:

(4)该工艺中,需要补充的物质X为
(5)能参与循环的物质是
已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:

(6)锥形瓶内ClO2进气导管不伸入液面以下,原因是
(7)烧杯内液体用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2:1,则还原产物的化学式是
反应后向锥形瓶中加入少量四氯化碳,溶液上下分层,下层为紫红色
已知:I2+Na2S=2NaI+S
(8)若将锥形瓶内溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:
②请设计实验证明你的假设(仅用离子方程式表示):
您最近一年使用:0次
2023-03-04更新
|
304次组卷
|
2卷引用:上海市杨浦高级中学2022-2023学年高一上学期期末考试化学试题
10 . 氨在常温条件下可与氯气发生反应:8NH3+3Cl2=6NH4Cl+N2,当有0.8mol氨参与反应生成0.6mol氯化铵时,下列说法中正确的是
| A.得到2.8g氮气 | B.反应中转移4.8mol电子 |
| C.氨是氧化剂 | D.0.8mol氨被氧化 |
您最近一年使用:0次



