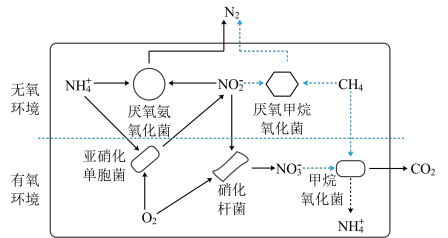
1 . 微生物反应器去除废水中铵盐和甲烷的过程如图。
(1) 的电离方程式为
的电离方程式为_______ 。
(2)Cu和稀硝酸反应的化学方程式为_______ ,反应过程体现了硝酸性质中的________ 。
(3)在厌氧氨氧化菌作用下,转移 电子时产生
电子时产生 的物质的量为
的物质的量为_______ 。
(4)甲烷属于________ (填“电解质”或“非电解质”)。在酸性废水中,甲烷氧化菌催化甲烷转化的离子方程式为_______ 。
(1)
 的电离方程式为
的电离方程式为(2)Cu和稀硝酸反应的化学方程式为
(3)在厌氧氨氧化菌作用下,转移
 电子时产生
电子时产生 的物质的量为
的物质的量为(4)甲烷属于
您最近一年使用:0次
名校
2 . 硫代硫酸钠(Na2S2O3)可用于脱除废水中游离氯。其工业制备方法为:将一定比例的Na2CO3与Na2S配成混合溶液,再通入SO2,先有黄色沉淀生成,当黄色沉淀消失时,即生成了Na2S2O3,同时释放CO2。下列说法错误的是
| A.制备反应中Na2S2O3既是氧化产物又是还原产物 |
B.制备总反应的离子方程式为2S2-+ CO + 4SO2 = CO2 + 3S2O + 4SO2 = CO2 + 3S2O |
| C.产生黄色沉淀的反应中氧化剂与还原剂物质的量之比为2∶1 |
D.将Na2S2O3脱除游离氯反应设计成原电池时,S2O 为负极反应物 为负极反应物 |
您最近一年使用:0次
2023-05-09更新
|
648次组卷
|
5卷引用:福建省龙岩市2023届高中毕业班五月教学质量检测化学试题
福建省龙岩市2023届高中毕业班五月教学质量检测化学试题福建省龙岩市2023届高三下学期5月三模考试化学试题(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)辽宁省沈阳市第二中学2024届高三下学期第四次模拟考试化学试卷
名校
3 .  去除酸性废水中
去除酸性废水中 的反应机理如图所示(图中“HS·”为自由基)。下列说法错误的是
的反应机理如图所示(图中“HS·”为自由基)。下列说法错误的是
 去除酸性废水中
去除酸性废水中 的反应机理如图所示(图中“HS·”为自由基)。下列说法错误的是
的反应机理如图所示(图中“HS·”为自由基)。下列说法错误的是
A.X的化学式为 |
| B.HS·反应活性较强,不能稳定存在 |
| C.步骤III反应中氧化剂与还原剂的物质的量比为8∶1 |
D.步骤IV除砷的方程式为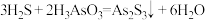 |
您最近一年使用:0次
2023-04-26更新
|
611次组卷
|
4卷引用:福建省邵武第一中学2023-2024学年高三上学期9月月考化学试卷
名校
解题方法
4 . 一氯化碘(ICl)是一种卤素互化物。卤素互化物具有强氧化性稀溶液,可与金属直接反应,也可用作有机合成中的碘化剂,一般可由卤素单质直接化合制得。有关一氯化碘制备及性质验证,请回答下列问题:
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:
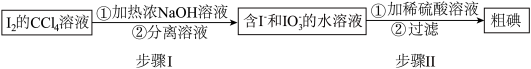
(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和_______ ,步骤Ⅱ的反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______ 。

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。
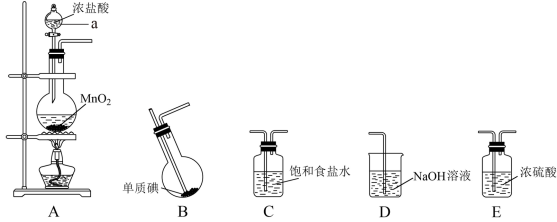
查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;_______
(4)B装置烧瓶需放在冷水中,其目的是:_______ ,B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_______ 。
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式_______ 。
(6)请设计简单的实验证明ICl的氧化性比I2强:_______ 。
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:

(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。

查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;
(4)B装置烧瓶需放在冷水中,其目的是:
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式
(6)请设计简单的实验证明ICl的氧化性比I2强:
您最近一年使用:0次
2023-01-19更新
|
407次组卷
|
2卷引用:福建省厦门市同安第一中学2022-2023学年高一下学期第一次月考化学试题
5 . 化学在治理空气污染方面发挥着重要的作用。
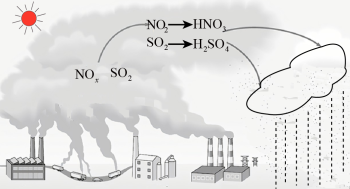
I、化石燃料的过度使用是导致酸雨的主要原因。研究表明,NOx、SO2形成酸雨时的转化关系如图所示:
(1)HNO3的电离方程式为_______ 。
(2)SO2会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是_______ (用化学方程式表示)。
Ⅱ、NOx、SO2等均为大气污染物,需处理后才能排放。
(3)用NaOH溶液可以吸收NOx,反应的化学方程式如下:
i.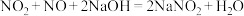
ii.
①反应i中,每消耗0.3molNO2,转移电子数为_______ 。
②反应ii中,氧化剂和还原剂的物质的量之比为_______ 。
(4)用氨水可以吸收SO2制取铵盐。
①实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为_______ 。
②用足量氨水吸收SO2的化学方程式为_______ 。
(5)利用NaClO吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。
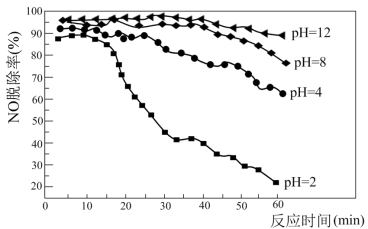
pH=2时,脱除SO2的离子方程式为_______ ;脱硝效率随反应时间的延长而逐渐降低的可能原因是_______ 。
I、化石燃料的过度使用是导致酸雨的主要原因。研究表明,NOx、SO2形成酸雨时的转化关系如图所示:

(1)HNO3的电离方程式为
(2)SO2会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是
Ⅱ、NOx、SO2等均为大气污染物,需处理后才能排放。
(3)用NaOH溶液可以吸收NOx,反应的化学方程式如下:
i.
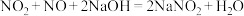
ii.

①反应i中,每消耗0.3molNO2,转移电子数为
②反应ii中,氧化剂和还原剂的物质的量之比为
(4)用氨水可以吸收SO2制取铵盐。
①实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为
②用足量氨水吸收SO2的化学方程式为
(5)利用NaClO吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。

pH=2时,脱除SO2的离子方程式为
您最近一年使用:0次
解题方法
6 . 碱式碳酸锌 可被用于皮肤保护剂、饲料添加剂等,以锌焙砂(主要成分为
可被用于皮肤保护剂、饲料添加剂等,以锌焙砂(主要成分为 及少量
及少量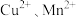 的化合物)为原料制备碱式碳酸锌的工艺流程如图所示,下列说法错误的是
的化合物)为原料制备碱式碳酸锌的工艺流程如图所示,下列说法错误的是

 可被用于皮肤保护剂、饲料添加剂等,以锌焙砂(主要成分为
可被用于皮肤保护剂、饲料添加剂等,以锌焙砂(主要成分为 及少量
及少量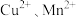 的化合物)为原料制备碱式碳酸锌的工艺流程如图所示,下列说法错误的是
的化合物)为原料制备碱式碳酸锌的工艺流程如图所示,下列说法错误的是
| A.“酸浸”前将锌焙砂粉碎可提高酸浸速率与原料的利用率 |
| B.“氧化”过程中,消耗的氧化剂与还原剂物质的量之比为2∶1 |
C.“沉铜”过程中反应的离子方程式为 |
D.碱式碳酸锌可与盐酸反应,其加热灼烧时可得到 |
您最近一年使用:0次
2022-11-26更新
|
231次组卷
|
3卷引用:福建省福州市福清市虞阳中学2023-2024学年高三上学期化学竞赛试卷
名校
7 . 回答下列问题:
(1)现有以下物质,①纯 、②Cu、③
、②Cu、③ 固体、④熔融的
固体、④熔融的 、⑤酒精、⑥
、⑤酒精、⑥ 、⑦液氯、⑧
、⑦液氯、⑧ 溶液。
溶液。
能导电的物质有_______ (填序号,下间),属于非电解质的是_______ ,属于弱电解质的是_______ 。
(2)已知 (次磷酸)与足量的NaOH反应只生成一种盐
(次磷酸)与足量的NaOH反应只生成一种盐 ,
, 水溶液中存在
水溶液中存在 分子。
分子。 属于
属于_______ 酸(填序号),
a.一元酸 b.二元酸 c.三元酸 d.强酸 e.弱酸
(3)已知高铁酸钾( )中的铁为+6价,是一种新型兼具净水和消毒功能的试剂,它能与盐酸发生如下反应
)中的铁为+6价,是一种新型兼具净水和消毒功能的试剂,它能与盐酸发生如下反应
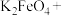 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
①配平该化学方程式____
②_______ 是氧化剂,_______ 是还原产物。
③被氧化的HCl与参加反应的HCl的物质的量之比为_______ 。
(1)现有以下物质,①纯
 、②Cu、③
、②Cu、③ 固体、④熔融的
固体、④熔融的 、⑤酒精、⑥
、⑤酒精、⑥ 、⑦液氯、⑧
、⑦液氯、⑧ 溶液。
溶液。能导电的物质有
(2)已知
 (次磷酸)与足量的NaOH反应只生成一种盐
(次磷酸)与足量的NaOH反应只生成一种盐 ,
, 水溶液中存在
水溶液中存在 分子。
分子。 属于
属于a.一元酸 b.二元酸 c.三元酸 d.强酸 e.弱酸
(3)已知高铁酸钾(
 )中的铁为+6价,是一种新型兼具净水和消毒功能的试剂,它能与盐酸发生如下反应
)中的铁为+6价,是一种新型兼具净水和消毒功能的试剂,它能与盐酸发生如下反应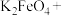 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
①配平该化学方程式
②
③被氧化的HCl与参加反应的HCl的物质的量之比为
您最近一年使用:0次
8 . 金属钛因其硬度大、熔点高、常温时耐酸碱腐蚀等特点而被广泛用作高新科技材料。以钛铁矿(主要成分为FeTiO3,含有少量MgO、Fe2O3、SiO2等杂质)为主要原料冶炼金属钛的工业生产流程如下:
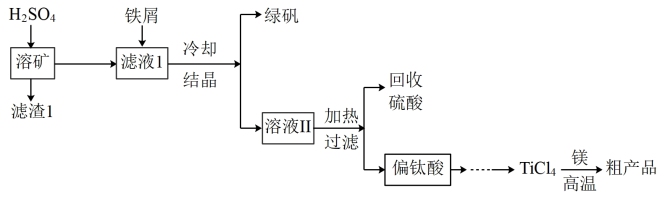
已知: 、
、 ,溶液中某离子浓度小于等于10-5 mol/L时,认为该离子沉淀完全。
,溶液中某离子浓度小于等于10-5 mol/L时,认为该离子沉淀完全。
回答下列问题:
(1)为提高钛铁矿酸浸时的浸出率,可采用循环浸取、延长时间、熔块粉碎、_______ 等措施(写一种方法即可)。
(2)滤渣1的主要成分是_______ 。钛酸亚铁(FeTiO3)和H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_______ 。
(3)将结晶后得到的绿矾经过下列步骤可以制备锂离子电池电极材料
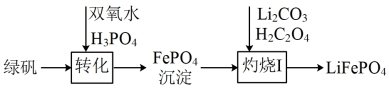
①“转化I”后所得溶液中c(Mg2+)=0.01 mol/L,若其中Fe3+沉淀完全,则溶液中c(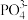 )的数值范围为
)的数值范围为_______ ;
②“煅烧I”反应中氧化剂和还原剂的物质的量之比为_______ ;
(4)溶液II中TiO2+水解生成TiO(OH)2 (偏钛酸)沉淀,TiO2+水解的离子方程式_______ 。

已知:
 、
、 ,溶液中某离子浓度小于等于10-5 mol/L时,认为该离子沉淀完全。
,溶液中某离子浓度小于等于10-5 mol/L时,认为该离子沉淀完全。回答下列问题:
(1)为提高钛铁矿酸浸时的浸出率,可采用循环浸取、延长时间、熔块粉碎、
(2)滤渣1的主要成分是
(3)将结晶后得到的绿矾经过下列步骤可以制备锂离子电池电极材料

①“转化I”后所得溶液中c(Mg2+)=0.01 mol/L,若其中Fe3+沉淀完全,则溶液中c(
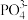 )的数值范围为
)的数值范围为②“煅烧I”反应中氧化剂和还原剂的物质的量之比为
(4)溶液II中TiO2+水解生成TiO(OH)2 (偏钛酸)沉淀,TiO2+水解的离子方程式
您最近一年使用:0次
解题方法
9 . 软锰矿-硫铁矿制取电池级二氧化锰的工艺流程如下图:

回答下列问题:
(1)“浸取”过程主要反应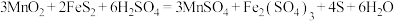 ,则氧化剂与还原剂物质的量之比为
,则氧化剂与还原剂物质的量之比为_______ 。
(2)“氧化ⅰ”过程软锰矿的作用是_______ 。
(3)“除铁”后溶液中残留的
_______  。(25℃时,
。(25℃时, 的
的 为
为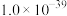 )
)
(4)“沉锰”过程 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
(5)“焙烧”过程 转化为
转化为 的化学方程式为
的化学方程式为_______ 。
(6)“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是_______ (填标号)。
a. b.
b. c.
c.
(7)将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为: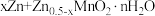
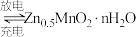 ,放电时正极的电极反应式为
,放电时正极的电极反应式为_______ 。

回答下列问题:
(1)“浸取”过程主要反应
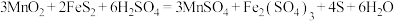 ,则氧化剂与还原剂物质的量之比为
,则氧化剂与还原剂物质的量之比为(2)“氧化ⅰ”过程软锰矿的作用是
(3)“除铁”后溶液中残留的

 。(25℃时,
。(25℃时, 的
的 为
为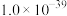 )
)(4)“沉锰”过程
 转化为
转化为 的离子方程式为
的离子方程式为(5)“焙烧”过程
 转化为
转化为 的化学方程式为
的化学方程式为(6)“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是
a.
 b.
b. c.
c.
(7)将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为:
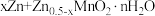
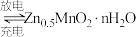 ,放电时正极的电极反应式为
,放电时正极的电极反应式为
您最近一年使用:0次
名校
解题方法
10 . 铬铁矿的主要成分为 ,还含有
,还含有 、
、 、
、 等杂质。工业上利用铬铁矿制备
等杂质。工业上利用铬铁矿制备 晶体的工艺流程如下图所示。
晶体的工艺流程如下图所示。
 ,还含有
,还含有 、
、 、
、 等杂质。工业上利用铬铁矿制备
等杂质。工业上利用铬铁矿制备 晶体的工艺流程如下图所示。
晶体的工艺流程如下图所示。
A.“高温氧化”中,氧化剂和还原剂物质的量之比为 |
B.“滤渣1”的主要成分为 、 、 |
C.通 调 调 发生的化学反应仅有 发生的化学反应仅有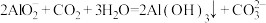 |
D.试剂 可以为稀 可以为稀 |
您最近一年使用:0次
2021-10-12更新
|
423次组卷
|
6卷引用:选择题6-10
(已下线)选择题6-10重庆市2022届高三第二次质量检测化学试题重庆市南开中学2022届高三第二次(10月)质量检测化学试题湖南省益阳市沅江市第一中学2022届高三下学期期中考试化学试题(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)



