1 .  是一种重要的化工原料,利用其制备烧碱和
是一种重要的化工原料,利用其制备烧碱和 的原理如图所示,下列说法错误的是
的原理如图所示,下列说法错误的是

 是一种重要的化工原料,利用其制备烧碱和
是一种重要的化工原料,利用其制备烧碱和 的原理如图所示,下列说法错误的是
的原理如图所示,下列说法错误的是
A.反应①的化学方程式为 |
B.反应①中的氧化产物和还原产物的质量比为 |
C. 的电离方程式为 的电离方程式为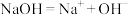 |
D.纯净的 能在 能在 中安静地燃烧,发出苍白色火焰 中安静地燃烧,发出苍白色火焰 |
您最近一年使用:0次
2 . 从碲铜渣 (Cu2Te)中可回收碲元素(已知碲元素与氧元素同主族),变废为宝,其中一步反应为 (未配平),下列有关说法正确的是
(未配平),下列有关说法正确的是
 (未配平),下列有关说法正确的是
(未配平),下列有关说法正确的是A. 中 中 的化合价为+2价 的化合价为+2价 | B. 元素得电子,发生氧化反应 元素得电子,发生氧化反应 |
C. 在反应中作氧化剂 在反应中作氧化剂 | D.n(氧化产物):n(还原产物)=1:1 |
您最近一年使用:0次
2023-07-06更新
|
105次组卷
|
2卷引用:陕西省商洛市2022-2023学年高二下学期7月期末考试化学试题
3 . 草酸(H2C2O4)是重要的化工原料,其制取原理之一为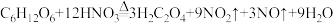 。下列说法正确的是
。下列说法正确的是
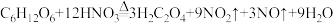 。下列说法正确的是
。下列说法正确的是| A.可用排空气法收集NO |
B.可通过蒸馏水除去 中的NO 中的NO |
C.用适量 溶液除去 溶液除去 溶液中的HCl 溶液中的HCl |
| D.该反应中氧化剂与还原剂的质量之比为12∶1 |
您最近一年使用:0次
解题方法
4 . 硫酸铁铵[NH4Fe(SO4)2•xH2O]是一种重要的铁盐,为充分利用资源,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图:

回答下列问题:
(1)NH4Fe(SO4)2•xH2O中铁元素的化合价为____ 价。
(2)步骤②的操作名称为____ ,主要用到的玻璃仪器有烧杯、漏斗和玻璃棒,其中玻璃棒的作用为____ 。
(3)下列有关固体硫酸铵的说法正确的是____ (填标号)。
A.从物质的组成来看,硫酸铵属于氧化物
B.0.1mol硫酸铵中所含的氮元素的总质量为2.8g
C.固体硫酸铵不能导电,但其属于电解质
(4)步骤③中通入O2的目的是将Fe2+全部转化为Fe3+,请写出反应的离子方程式:____ ,该反应中,每转移0.2mol电子,此时消耗O2的体积为____ L(标准状况下)。

回答下列问题:
(1)NH4Fe(SO4)2•xH2O中铁元素的化合价为
(2)步骤②的操作名称为
(3)下列有关固体硫酸铵的说法正确的是
A.从物质的组成来看,硫酸铵属于氧化物
B.0.1mol硫酸铵中所含的氮元素的总质量为2.8g
C.固体硫酸铵不能导电,但其属于电解质
(4)步骤③中通入O2的目的是将Fe2+全部转化为Fe3+,请写出反应的离子方程式:
您最近一年使用:0次
2022-12-08更新
|
121次组卷
|
2卷引用:陕西省咸阳市高新一中2022-2023学年高一上学期第三次质量检测化学试题
5 . CuCl2是一种重要的化工原料,不能采用Cu与稀盐酸直接反应制取CuCl2,但持续通入空气,并向溶液中加入FeCl3,可发生如图所示的反应。
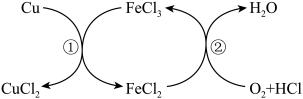
下列说法正确的是

下列说法正确的是
| A.反应①的离子方程式为Cu+Fe3+=Fe2++Cu2+ |
| B.反应②中氧化剂与还原剂的质量比为32∶127 |
| C.整个反应中,每消耗1个O2分子,一定转移4个电子 |
| D.FeCl3充当催化剂,且要不断添加FeCl3溶液 |
您最近一年使用:0次
2022-11-13更新
|
173次组卷
|
2卷引用:陕西省宝鸡市渭滨区2022-2023学年高一年级上学期期末考试化学试题
名校
6 . 亚磷酸(H3PO3)是一种弱酸,其与足量的NaOH反应的化学方程式为:2NaOH+H3PO3=Na2HPO3+2H2O,亚磷酸受热分解的方程式为:4H3PO3 3H3PO4+PH3↑。下列说法正确的是
3H3PO4+PH3↑。下列说法正确的是
 3H3PO4+PH3↑。下列说法正确的是
3H3PO4+PH3↑。下列说法正确的是| A.Na2HPO3属于酸式盐 |
B.Na2HPO3在水溶液中的电离方程式为Na2HPO3=2Na++H++PO |
| C.亚磷酸受热分解的过程中,被氧化的亚磷酸和被还原的亚磷酸分子个数比为1∶3 |
| D.亚磷酸属于二元酸 |
您最近一年使用:0次
2022-10-05更新
|
602次组卷
|
5卷引用:陕西省西安交通大学附属中学2022-2023年高一上学期第一次月考化学试题
解题方法
7 . 空间站中的物质循环利用是重要研究课题。关于如下“转化图”,说法正确的是


| A.Sabatier反应器中反应的氧化剂与还原剂物质的量之比为1∶4 |
| B.水电解系统的阳极产物应该输送进入Sabatier反应器 |
| C.采用高压和合适催化剂均有利于提高Sabatier反应器中的反应 |
| D.由图可知,该系统中H2O的循环利用率为100% |
您最近一年使用:0次
2022-05-27更新
|
284次组卷
|
4卷引用:陕西省咸阳市2021-2022学年高二下学期期末考试化学试题
陕西省咸阳市2021-2022学年高二下学期期末考试化学试题山东省名校联盟2022届高三下学期5月模拟考试化学试题(已下线)第09练 以隔膜在电化学中的功能突破电解原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)1.3.1 氧化还原反应的基本概念(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)
名校
8 . 物质的类别和核心元素的化合价是学习研究物质性质的两个重要角度。根据硫元素的价类二维图回答下列问题:

(1)Z为钠的正盐,在反应中既可作氧化剂,又可作还原剂,当Z作氧化剂时,理论上可被还原为_______ (填字母)。
A. B.
B. C.
C. D.
D. E.
E.
(2)X与Y反应可生成淡黄色固体,反应的化学方程式为_______ ,该反应中氧化产物与还原产物的物质的量之比为_______ 。
(3)W的浓溶液与铜单质在加热条件下发生反应的化学方程式为_______ ,反应中W表现的性质是_______ ,该反应中每转移 电子,生成标准状况下气体的体积为
电子,生成标准状况下气体的体积为_______ L。
(4)已知空气中 的最大允许排放浓度不得超过
的最大允许排放浓度不得超过 ,可通过下列装置定量分析空气中
,可通过下列装置定量分析空气中 的含量。
的含量。

该组同学查阅资料得知测定原理为 ,若从气体通入起计时直到广口瓶中溶液蓝色恰好褪去结束,用时9min。已知空气的流速为
,若从气体通入起计时直到广口瓶中溶液蓝色恰好褪去结束,用时9min。已知空气的流速为 ,则该地空气中的
,则该地空气中的 含量是
含量是_______  (结果精确到0.001)。
(结果精确到0.001)。

(1)Z为钠的正盐,在反应中既可作氧化剂,又可作还原剂,当Z作氧化剂时,理论上可被还原为
A.
 B.
B. C.
C. D.
D. E.
E.
(2)X与Y反应可生成淡黄色固体,反应的化学方程式为
(3)W的浓溶液与铜单质在加热条件下发生反应的化学方程式为
 电子,生成标准状况下气体的体积为
电子,生成标准状况下气体的体积为(4)已知空气中
 的最大允许排放浓度不得超过
的最大允许排放浓度不得超过 ,可通过下列装置定量分析空气中
,可通过下列装置定量分析空气中 的含量。
的含量。
该组同学查阅资料得知测定原理为
 ,若从气体通入起计时直到广口瓶中溶液蓝色恰好褪去结束,用时9min。已知空气的流速为
,若从气体通入起计时直到广口瓶中溶液蓝色恰好褪去结束,用时9min。已知空气的流速为 ,则该地空气中的
,则该地空气中的 含量是
含量是 (结果精确到0.001)。
(结果精确到0.001)。
您最近一年使用:0次
2022-02-21更新
|
767次组卷
|
4卷引用:陕西省渭南市临渭区2021-2022学年高一上学期期末教学质量检测化学试题
9 . 绿水青山就是金山银山,我国的废水处理再利用技术取得了重大突破.
(1)生活污水中的氮是造成水体富营养化的主要原因.某污水中同时存在 和
和 时,可用下列方法除去:
时,可用下列方法除去:
Ⅰ.先利用O2将 氧化成
氧化成 :
: (未配平);
(未配平);
Ⅱ.再将 还原成
还原成 (未配平).
(未配平).
①配平步骤Ⅰ中的方程式并用单线桥法标出电子转移的方向和数目____________________ .
②若该污水中含有1 mol NH4NO3,用上述方法处理完全后,共消耗__________ mol H2。
(2)含有NaCN的废水常用Ca(ClO)2处理,使其最终转化为无害物质.其反应如下:
反应Ⅰ:
反应Ⅱ: (CNO-中C为
(CNO-中C为 价)(未配平)
价)(未配平)
反应Ⅲ: (未配平)
(未配平)
①反应Ⅱ中的氧化剂是________________ (填化学式),氧化产物与还原产物的物质的量之比为________ 。
②若反应Ⅲ中转移0.6 mol电子,则生成的气体在标准状况下的总体积为__________ L。
(3)含高浓度CN-的废水可用多硫化物MS4溶液在碱性条件下处理,CN-被氧化成毒性较小的SCN-,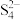 转化为S2-,写出该反应的离子方程式
转化为S2-,写出该反应的离子方程式_______________ 。
(4)工业上还可用硝酸铜和柠檬酸为原料,以 为催化剂,催化氧化处理含高浓度CN-的废水。CN-去除率与搅拌速率、时间和pH的关系如图所示:
为催化剂,催化氧化处理含高浓度CN-的废水。CN-去除率与搅拌速率、时间和pH的关系如图所示:

①由上图可知,在相同时间内最佳反应条件为______________________ 。
②分析pH>6时CN-去除率降低的原因(用相关离子方程式和文字说明)______________________ 。
(1)生活污水中的氮是造成水体富营养化的主要原因.某污水中同时存在
 和
和 时,可用下列方法除去:
时,可用下列方法除去:Ⅰ.先利用O2将
 氧化成
氧化成 :
: (未配平);
(未配平);Ⅱ.再将
 还原成
还原成 (未配平).
(未配平).①配平步骤Ⅰ中的方程式并用单线桥法标出电子转移的方向和数目
②若该污水中含有1 mol NH4NO3,用上述方法处理完全后,共消耗
(2)含有NaCN的废水常用Ca(ClO)2处理,使其最终转化为无害物质.其反应如下:
反应Ⅰ:

反应Ⅱ:
 (CNO-中C为
(CNO-中C为 价)(未配平)
价)(未配平)反应Ⅲ:
 (未配平)
(未配平)①反应Ⅱ中的氧化剂是
②若反应Ⅲ中转移0.6 mol电子,则生成的气体在标准状况下的总体积为
(3)含高浓度CN-的废水可用多硫化物MS4溶液在碱性条件下处理,CN-被氧化成毒性较小的SCN-,
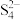 转化为S2-,写出该反应的离子方程式
转化为S2-,写出该反应的离子方程式(4)工业上还可用硝酸铜和柠檬酸为原料,以
 为催化剂,催化氧化处理含高浓度CN-的废水。CN-去除率与搅拌速率、时间和pH的关系如图所示:
为催化剂,催化氧化处理含高浓度CN-的废水。CN-去除率与搅拌速率、时间和pH的关系如图所示:
①由上图可知,在相同时间内最佳反应条件为
②分析pH>6时CN-去除率降低的原因(用相关离子方程式和文字说明)
您最近一年使用:0次
10 . 氯气是常用的自来水消毒杀菌剂,但氯气在杀菌过程中会产生有害物质,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为自来水的消毒剂。
(1)实验室常通过加热二氧化锰和浓盐酸的混合物制备氯气,该反应的化学方程式为__________ ,反应中氧化剂与还原剂的物质的量之比为__________ ;制得的氯气中常混有HCl气体,可选用__________ (填试剂名称)除去混合气体中的HCl;将红热的铁丝伸入装满氯气的集气瓶中,发生反应的化学方程式为__________ (用单线桥法标出电子转移方向和数目)。
(2)工业上ClO2常用NaClO3溶液、Na2SO3溶液和稀硫酸混合反应制备,该反应的离子方程式为__________ ,该反应中氧化剂为_________ (填化学式,下同),氧化产物为__________ 。
(1)实验室常通过加热二氧化锰和浓盐酸的混合物制备氯气,该反应的化学方程式为
(2)工业上ClO2常用NaClO3溶液、Na2SO3溶液和稀硫酸混合反应制备,该反应的离子方程式为
您最近一年使用:0次



