1 . 下列关于氮及其化合物的叙述错误的是
| A.大多数铵盐易溶于水,在农业上常用作氮肥 |
| B.NO在化学反应中,既能做还原剂,又能做氧化剂 |
C. 为红棕色气体,因此将少量 为红棕色气体,因此将少量 通入水中,溶液显红棕色 通入水中,溶液显红棕色 |
D.在 与水的反应中氧化剂与还原剂的物质的量之比为1:2 与水的反应中氧化剂与还原剂的物质的量之比为1:2 |
您最近一年使用:0次
名校
解题方法
2 . 工业上可由天然二氧化锰粉与硫化锰矿(还含 等元素)制备
等元素)制备 ,工艺流程如图:
,工艺流程如图:

下列说法正确的是
 等元素)制备
等元素)制备 ,工艺流程如图:
,工艺流程如图:
下列说法正确的是
A.已知“滤渣1”中含有S,则“溶浸”中涉及生成S的反应中氧化剂与还原剂的物质的量之比为 |
B.“氧化”中添加适量的 的作用是将 的作用是将 氧化为 氧化为 以保证铁元素全部进入“滤渣2” 以保证铁元素全部进入“滤渣2” |
C.为提高生产效率,“调 ”工序应该在较高温度下进行 ”工序应该在较高温度下进行 |
D.已知“除杂2”的目的是生成 沉淀,则溶液酸度越高越能减少氢氧化物形式沉淀,除杂效果越好 沉淀,则溶液酸度越高越能减少氢氧化物形式沉淀,除杂效果越好 |
您最近一年使用:0次
2024-03-18更新
|
336次组卷
|
3卷引用:河北省保定市部分高中2023-2024学年高三下学期开学化学试题
名校
3 . 亚氯酸钠( )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
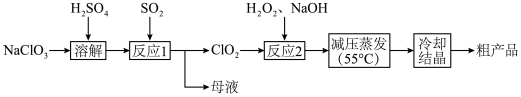
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L 溶液,现进行溶液配制。
溶液,现进行溶液配制。
①实验室购买的浓硫酸标签如图所示。配制所需的 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有___________ ,需要量取的浓硫酸的体积是___________ mL。
②在容量瓶的使用方法中,下列操作正确的是___________ 。
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中
③配制过程中下列各项操作可能导致浓度偏小的有___________ (填写字母)。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是___________ 。
(3)“反应2”中加入的 的电子式是
的电子式是___________ ,发生反应的离子方程式是___________ 。
 )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L
 溶液,现进行溶液配制。
溶液,现进行溶液配制。①实验室购买的浓硫酸标签如图所示。配制所需的
 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有| 硫酸化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的
 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中③配制过程中下列各项操作可能导致浓度偏小的有
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是
(3)“反应2”中加入的
 的电子式是
的电子式是
您最近一年使用:0次
4 . 碲( )被誉为“现代工业、国防与尖端技术的维生素”。一种从废弃的声光器件(主要含
)被誉为“现代工业、国防与尖端技术的维生素”。一种从废弃的声光器件(主要含 和
和 等杂质)中提取粗碲的工艺流程如图:
等杂质)中提取粗碲的工艺流程如图:
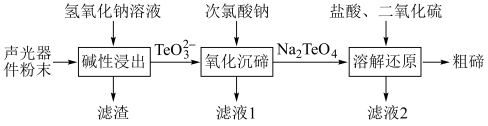
下列说法错误的是
 )被誉为“现代工业、国防与尖端技术的维生素”。一种从废弃的声光器件(主要含
)被誉为“现代工业、国防与尖端技术的维生素”。一种从废弃的声光器件(主要含 和
和 等杂质)中提取粗碲的工艺流程如图:
等杂质)中提取粗碲的工艺流程如图:
下列说法错误的是
| A.滤液1和滤液2混合可能产生白色沉淀 |
| B.“碱性浸出”工序中,得到的滤渣为铜 |
C.“氧化沉碲”工序的离子方程式为 |
D.“溶解还原”工序中氧化剂和还原剂的物质的量之比为 |
您最近一年使用:0次
名校
5 . 氯元素的化合价与部分物质类别的对应关系如图所示,据图判断下列说法错误的是
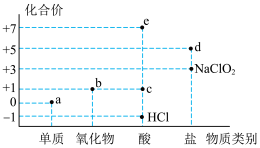
| A.c在光照条件下很容易分解 |
| B.b不是酸性氧化物,因为它没有对应的含氧酸 |
| C.图中a、b、c、d、e五种物质中均含有共价键,且c、d、e属于电解质 |
D.将a通入 溶液中,已知生成 溶液中,已知生成 、 、 和d的混合物,若 和d的混合物,若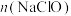 与 与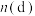 之比为 之比为 ,则氧化剂与还原剂的物质的量之比为 ,则氧化剂与还原剂的物质的量之比为 |
您最近一年使用:0次
2023-11-21更新
|
392次组卷
|
5卷引用:河北省沧衡八校联盟2023-2024学年高三上学期11月期中考试化学试题
名校
6 . 根据所学知识回答下列问题:
(1)黄铁矿(主要成分为 ,其中Fe为+2价)的燃烧是工业上制硫酸时得到
,其中Fe为+2价)的燃烧是工业上制硫酸时得到 的途径之一,其反应为
的途径之一,其反应为 。
。
① 中硫元素的化合价为
中硫元素的化合价为___________ 价,该化合物中
___________ 。
②该反应中氧化剂与还原剂的质量之比为___________ 。
③该反应的氧化产物为___________ (填化学式)。
(2)次磷酸( )是一种精细的磷化工产品,具有较强的还原性,
)是一种精细的磷化工产品,具有较强的还原性, 可与溶液中的
可与溶液中的 发生反应,生成物为Ag和
发生反应,生成物为Ag和 ,从而可用于化学镀银。
,从而可用于化学镀银。
已知: 和
和 在溶液中均以分子的形成存在。
在溶液中均以分子的形成存在。
① 的相对分子质量为
的相对分子质量为___________ ,该分子中的磷原子和氧原子的个数之比为___________ 。
②该反应中 体现了
体现了___________ (填“还原”或“氧化”)性。
③该反应的离子方程式为___________ 。
(1)黄铁矿(主要成分为
 ,其中Fe为+2价)的燃烧是工业上制硫酸时得到
,其中Fe为+2价)的燃烧是工业上制硫酸时得到 的途径之一,其反应为
的途径之一,其反应为 。
。①
 中硫元素的化合价为
中硫元素的化合价为
②该反应中氧化剂与还原剂的质量之比为
③该反应的氧化产物为
(2)次磷酸(
 )是一种精细的磷化工产品,具有较强的还原性,
)是一种精细的磷化工产品,具有较强的还原性, 可与溶液中的
可与溶液中的 发生反应,生成物为Ag和
发生反应,生成物为Ag和 ,从而可用于化学镀银。
,从而可用于化学镀银。已知:
 和
和 在溶液中均以分子的形成存在。
在溶液中均以分子的形成存在。①
 的相对分子质量为
的相对分子质量为②该反应中
 体现了
体现了③该反应的离子方程式为
您最近一年使用:0次
2023-11-15更新
|
53次组卷
|
2卷引用:河北省2023-2024学年高一上学期选科调考第二次联考化学试题
名校
7 . 化学上用分类法学习化学物质的共性,用比较法学习化学物质的特性,物质的氧化性与还原性尤为重要,回答下列问题:
(1)磷元素的含氧酸有H3PO4、H3PO3(亚磷酸)、H3PO2(次磷酸)等多种,其中已知H3PO3+2NaOH(过量)=Na2HPO3+2H2O。
H3PO3属于________ (选填“一”“二”或“三”)元酸。
NaH2PO3属于_______ (填“正盐”或“酸式盐”)。
H3PO2可将溶液中的Ag+转化为银,自身变为H3PO4,可用于化学镀银。
利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的个数比为________ 。
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:_______ 。
_______Fe(OH)3+______CH4+______H+ _____Fe2++______HCO
_____Fe2++______HCO +________。
+________。
(3)强酸反应体系中发生的一个离子反应中,反应物和生成物共六种微粒:Fe2+、NO 、Fe3+、NH
、Fe3+、NH 和H2O,写出该反应的离子方程式
和H2O,写出该反应的离子方程式_______ 。
(4)NaBH4常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1个NaBH4的还原能力相当于_____ 个H2的还原能力(B元素化合价不变,氧化产物中氢元素化合价相同)。
(1)磷元素的含氧酸有H3PO4、H3PO3(亚磷酸)、H3PO2(次磷酸)等多种,其中已知H3PO3+2NaOH(过量)=Na2HPO3+2H2O。
H3PO3属于
NaH2PO3属于
H3PO2可将溶液中的Ag+转化为银,自身变为H3PO4,可用于化学镀银。
利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的个数比为
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:
_______Fe(OH)3+______CH4+______H+
 _____Fe2++______HCO
_____Fe2++______HCO +________。
+________。(3)强酸反应体系中发生的一个离子反应中,反应物和生成物共六种微粒:Fe2+、NO
 、Fe3+、NH
、Fe3+、NH 和H2O,写出该反应的离子方程式
和H2O,写出该反应的离子方程式(4)NaBH4常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1个NaBH4的还原能力相当于
您最近一年使用:0次
名校
解题方法
8 . 物质类别和元素价态是学习元素及其化合物性质的重要认识视角。硫元素的“价-类”二维关系图如图所示,已知G的溶液为常见的蓝色溶液,下列说法正确的是


| A.A、C都可以用F的浓溶液干燥 |
B.将C溶于水得到的E长时间露置于空气中,溶液 会增大 会增大 |
C. 不能被F的稀溶液溶解,但可与F浓溶液加热反应生成G,同时生成D 不能被F的稀溶液溶解,但可与F浓溶液加热反应生成G,同时生成D |
| D.A和C生成B的反应中,氧化产物和还原产物的物质的量之比为2∶1 |
您最近一年使用:0次
名校
9 . 电池正极片由镍钴锰酸锂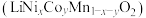 正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
(1)滤液1中含铝微粒为___________ 。
(2)“碱浸”后需进行过滤、洗涤,简述洗涤的操作过程:___________ 。
(3)“还原”时,参加反应的
___________ 。
(4)“分离”过程包含萃取和反萃取,萃取时必须使用的仪器是___________ ;萃取时利用有机物HT将Co2+从水溶液中萃取出来,该过程可表示为Co2+(水层)+2HT(有机层) CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:
CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:___________ 。
(5)“氧化”过程中MnSO4发生反应生成MnO2、(NH4)2SO4和H2SO4的化学方程式为___________ 。
(6)“沉钴”后获得CoC2O4·2H2O,取mgCoC2O4·2H2O进行“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:
)与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:___________ ;“高温分解”需控制的最低温度为___________ 。
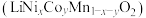 正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
(1)滤液1中含铝微粒为
(2)“碱浸”后需进行过滤、洗涤,简述洗涤的操作过程:
(3)“还原”时,参加反应的

(4)“分离”过程包含萃取和反萃取,萃取时必须使用的仪器是
 CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:
CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:(5)“氧化”过程中MnSO4发生反应生成MnO2、(NH4)2SO4和H2SO4的化学方程式为
(6)“沉钴”后获得CoC2O4·2H2O,取mgCoC2O4·2H2O进行“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:
)与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:
您最近一年使用:0次
名校
解题方法
10 . 工业革命以来人类对于防治大气中NOx(由NO与NO2组成的混合物,当x=1.5时,混合物中NO与NO2物质的量之比为1:1)污染的研究从未停歇。回答下列问题:
(1)NaOH溶液可以吸收NOx,反应方程式如下:
ⅰ. (未配平)
(未配平)
ⅱ.
①当x=1.25时,NOx中NO与NO2的物质的量之比为___________ 。
②配平并写出反应ⅰ的化学方程式:___________ ;反应ⅱ中,每吸收0.3mol NO2,转移电子为___________ mol。
③将一定体积的NOx通入足量NaOH溶液中,若NOx可以被完全吸收,x的取值范围为___________ 。
(2)利用NaClO吸收液可以同时脱除燃煤烟气中NO和SO2。研究发现NaClO吸收液在不同的初始pH条件下,对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示:

①pH=12时,脱除SO2的离子方程式为___________ 。
②酸性条件下,SO2的脱除率高于NO,其原因除SO2的还原性比NO强外,还可能是___________ 。
③若用盐酸调节NaClO吸收液的pH,不仅不利于NO的吸收,还会在反应过程中生成一种有毒气体,其化学式为___________ 。
(1)NaOH溶液可以吸收NOx,反应方程式如下:
ⅰ.
 (未配平)
(未配平)ⅱ.

①当x=1.25时,NOx中NO与NO2的物质的量之比为
②配平并写出反应ⅰ的化学方程式:
③将一定体积的NOx通入足量NaOH溶液中,若NOx可以被完全吸收,x的取值范围为
(2)利用NaClO吸收液可以同时脱除燃煤烟气中NO和SO2。研究发现NaClO吸收液在不同的初始pH条件下,对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示:

①pH=12时,脱除SO2的离子方程式为
②酸性条件下,SO2的脱除率高于NO,其原因除SO2的还原性比NO强外,还可能是
③若用盐酸调节NaClO吸收液的pH,不仅不利于NO的吸收,还会在反应过程中生成一种有毒气体,其化学式为
您最近一年使用:0次
2023-05-10更新
|
216次组卷
|
3卷引用:河北省沧州市盐山中学、海兴中学、南皮中学等2022-2023学年高一下学期6月月考化学试题



