名校
解题方法
1 .  作为一种广泛的消毒剂,它易溶于水而难溶于有机溶剂,实验室用
作为一种广泛的消毒剂,它易溶于水而难溶于有机溶剂,实验室用 与
与 反应制得
反应制得 和NaCl。如图是实验室用于制备和收集一定量纯净的
和NaCl。如图是实验室用于制备和收集一定量纯净的 的装置(某些夹持装置和垫持用品省略)。其中E中盛有液体(用于除去
的装置(某些夹持装置和垫持用品省略)。其中E中盛有液体(用于除去 中的未反应的
中的未反应的 ,氯气几乎不溶于饱和食盐水)。
,氯气几乎不溶于饱和食盐水)。
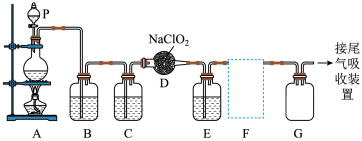
(1)仪器P的名称是__________ 。
(2)请写出装置A中烧瓶内发生反应的化学方程式:______________________________ ,每转移1mol电子时,产生标准状况下
__________ L。
(3)B、C装置中所盛试剂分别是__________ 、__________ 。
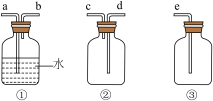
(4)F为 收集装置,应选用如图的哪组装置来收集
收集装置,应选用如图的哪组装置来收集__________ (填序号),其中与装置E导管相连的导管口是__________ (填接口字母)。
(5)装置D中发生反应的化学方程式为______ 。
(6)将 通入冷的石灰乳中即制得漂白粉,请写出该反应的化学方程式
通入冷的石灰乳中即制得漂白粉,请写出该反应的化学方程式______________________________ ,漂白粉在使用时会与空气中 反应,
反应, 为
为__________ (填“酸性氧化物”或“碱性氧化物”)。
 作为一种广泛的消毒剂,它易溶于水而难溶于有机溶剂,实验室用
作为一种广泛的消毒剂,它易溶于水而难溶于有机溶剂,实验室用 与
与 反应制得
反应制得 和NaCl。如图是实验室用于制备和收集一定量纯净的
和NaCl。如图是实验室用于制备和收集一定量纯净的 的装置(某些夹持装置和垫持用品省略)。其中E中盛有液体(用于除去
的装置(某些夹持装置和垫持用品省略)。其中E中盛有液体(用于除去 中的未反应的
中的未反应的 ,氯气几乎不溶于饱和食盐水)。
,氯气几乎不溶于饱和食盐水)。

(1)仪器P的名称是
(2)请写出装置A中烧瓶内发生反应的化学方程式:

(3)B、C装置中所盛试剂分别是
(4)F为
 收集装置,应选用如图的哪组装置来收集
收集装置,应选用如图的哪组装置来收集(5)装置D中发生反应的化学方程式为
(6)将
 通入冷的石灰乳中即制得漂白粉,请写出该反应的化学方程式
通入冷的石灰乳中即制得漂白粉,请写出该反应的化学方程式 反应,
反应, 为
为
您最近一年使用:0次
名校
2 . 某小组同学探究不同条件下氯气与二价锰化合物的反应,实验记录如下:
资料:水溶液中, 为棕黑色沉淀,
为棕黑色沉淀, 为白色沉淀,
为白色沉淀, 呈绿色;浓碱性条件下,
呈绿色;浓碱性条件下, 可被
可被 还原为
还原为 ;
; 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
下列说法错误的是
| 序号 | 实验方案 | 实验现象 | |
| 实验装置 | 试剂a | ||
| ① | 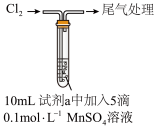 | 水 | 产生黑色沉淀,放置后不发生变化 |
| ② |  溶液 溶液 | 产生黑色沉淀,放置后溶液变为紫色,仍有沉淀 | |
| ③ | 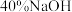 溶液 溶液 | 产生黑色沉淀,放置后溶液变为紫色,仍有沉淀 | |
| ④ | 取③中放置后的悬浊液 ,加入 ,加入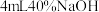 溶液 溶液 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | |
| ⑤ | 取③中放置后的悬浊液 ,加入 ,加入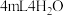 | 溶液紫色缓慢加深 | |
 为棕黑色沉淀,
为棕黑色沉淀, 为白色沉淀,
为白色沉淀, 呈绿色;浓碱性条件下,
呈绿色;浓碱性条件下, 可被
可被 还原为
还原为 ;
; 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。下列说法错误的是
| A.对比实验①和②可知,碱性环境中,二价锰化合物可被氧化到更高价态 |
B.④中溶液紫色迅速变为绿色的可能原因是: 被 被 还原生成 还原生成 |
C.⑤中紫色缓慢加深的主要原因是: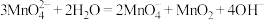 |
D.③中未得到绿色溶液,可能是因为 被氧化为 被氧化为 的反应速率快于 的反应速率快于 被还原为 被还原为 的反应速率 的反应速率 |
您最近一年使用:0次
2023-12-12更新
|
276次组卷
|
2卷引用: 湖南师范大学附属中学2023-2024学年高三下学期第六次月考化学试题
名校
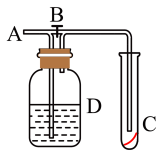
3 . 如图所示,在A处通入未经干燥的氯气。当关闭B处的弹簧夹时,C处的红布条看不到明显现象;当打开B处的弹簧夹后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是
| A.③④ | B.②③ | C.①③ | D.①② |
您最近一年使用:0次
2023-12-07更新
|
105次组卷
|
3卷引用:湖南省长沙市长郡中学2023-2024学年高一下学期选科适应性检测化学试卷
4 . 某小组设计实验探究氯气性质,装置如图(夹持装置已省略)。下列叙述错误的是
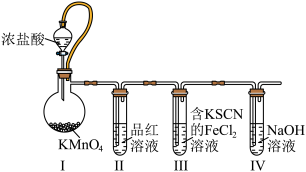

| A.I装置中浓盐酸只表现还原性,可以用Ca(ClO)2替代KMnO4 |
| B.若加热II装置中的无色溶液后,溶液仍为无色,则氯水具有永久漂白性 |
| C.若III装置中溶液变红色,则氯气表现氧化性 |
| D.IV装置用于吸收尾气中氯气 |
您最近一年使用:0次
名校
5 .  在常温下为黄色气体,熔点为-59.5℃,沸点为11℃,易溶于水,其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应:
在常温下为黄色气体,熔点为-59.5℃,沸点为11℃,易溶于水,其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应: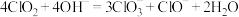 。
。 的制备方法有多种。回答下列问题:
的制备方法有多种。回答下列问题:
(1)一种制备 的反应为
的反应为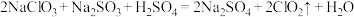 ,用单线桥法标明该反应中电子转移的方向和数目:
,用单线桥法标明该反应中电子转移的方向和数目:_______ 。
(2)一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”溶于水时,逸出大量
的“二氧化氯泡腾片”溶于水时,逸出大量 ,同时
,同时 在酸性条件下发生自身氧化还原反应,得到
在酸性条件下发生自身氧化还原反应,得到 溶液。
溶液。
① 中Cl元素的化合价为
中Cl元素的化合价为_______ 。
②上述反应产生大量 的离子方程式为
的离子方程式为_______ 。
③上述反应生成 的离子方程式为
的离子方程式为_______ 。
(3)实验室可用如图所示装置制备 (夹持装置略)。
(夹持装置略)。

①装置A中发生反应的化学方程式为_______ 。
②装置B收集 时,为了收集更多的
时,为了收集更多的 ,可采取的措施为
,可采取的措施为_______ (填一条)。
(4) 的稳定性较差,易分解,常用
的稳定性较差,易分解,常用 和NaOH的混合溶液将其转化为
和NaOH的混合溶液将其转化为 进行保存,该反应的离子方程式为
进行保存,该反应的离子方程式为_______ ,若加入过量的NaOH可能导致的后果是_______ 。
 在常温下为黄色气体,熔点为-59.5℃,沸点为11℃,易溶于水,其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应:
在常温下为黄色气体,熔点为-59.5℃,沸点为11℃,易溶于水,其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应: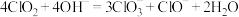 。
。 的制备方法有多种。回答下列问题:
的制备方法有多种。回答下列问题:(1)一种制备
 的反应为
的反应为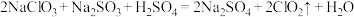 ,用单线桥法标明该反应中电子转移的方向和数目:
,用单线桥法标明该反应中电子转移的方向和数目:(2)一种有效成分为
 、
、 、
、 的“二氧化氯泡腾片”溶于水时,逸出大量
的“二氧化氯泡腾片”溶于水时,逸出大量 ,同时
,同时 在酸性条件下发生自身氧化还原反应,得到
在酸性条件下发生自身氧化还原反应,得到 溶液。
溶液。①
 中Cl元素的化合价为
中Cl元素的化合价为②上述反应产生大量
 的离子方程式为
的离子方程式为③上述反应生成
 的离子方程式为
的离子方程式为(3)实验室可用如图所示装置制备
 (夹持装置略)。
(夹持装置略)。
①装置A中发生反应的化学方程式为
②装置B收集
 时,为了收集更多的
时,为了收集更多的 ,可采取的措施为
,可采取的措施为(4)
 的稳定性较差,易分解,常用
的稳定性较差,易分解,常用 和NaOH的混合溶液将其转化为
和NaOH的混合溶液将其转化为 进行保存,该反应的离子方程式为
进行保存,该反应的离子方程式为
您最近一年使用:0次
名校
6 . 下列反应的离子方程式正确的是
A.向 溶液中滴加稀 溶液中滴加稀 溶液: 溶液: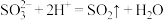 |
B.向 溶液中加入过量澄清石灰水: 溶液中加入过量澄清石灰水: |
C.向 溶液中通入 溶液中通入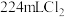 : :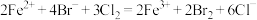 |
D.常温下Cl2通入NaOH溶液中转化为2种盐: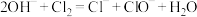 |
您最近一年使用:0次
名校
解题方法
7 . 下列操作、现象和结论均正确且有相关性的是
| 选项 | 操作、现象 | 结论 |
| A | 向酸性高锰酸钾溶液中通入 ,溶液褪色 ,溶液褪色 |  表现还原性 表现还原性 |
| B | 向紫色石蕊溶液中持续通入 ,溶液变为无色 ,溶液变为无色 |  表现漂白性 表现漂白性 |
| C | 向 溶液腐蚀铜版的废液中滴加氨水,产生红棕色沉淀 溶液腐蚀铜版的废液中滴加氨水,产生红棕色沉淀 | 该废液中含 |
| D | 将粗乙烯气体通入酸性 溶液中,溶液褪色 溶液中,溶液褪色 | 乙烯中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-28更新
|
105次组卷
|
2卷引用:湖南省三湘创新发展联合体2023-2024学年高三上学期9月月考化学试题
名校
解题方法
8 . 下列反应的离子方程式正确的是
| A.向 FeCl2 溶液中滴加 H2O2:H2O2+2Fe2+=2H2O+2Fe3+ |
B.NaHCO3 溶液中通入过量 SO2:HCO +SO2= HSO +SO2= HSO +CO2 +CO2 |
C.乙醇与 K2Cr2O7 酸性溶液反应:3CH3CH2OH+2Cr2O +11H2O=3CH3COOH + 4Cr(OH)3↓+4OH- +11H2O=3CH3COOH + 4Cr(OH)3↓+4OH- |
| D.氯气与热的 NaOH 溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
您最近一年使用:0次
名校
解题方法
9 . 下列离子方程式书写正确的是
A.用Na2SO3溶液吸收少量 : : |
B.FeI2溶液中滴入过量溴水: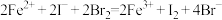 |
C.工业上制漂白粉: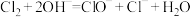 |
D.向NH4HCO3溶液中滴加少量NaOH溶液: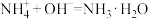 |
您最近一年使用:0次
名校
10 . 有某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的质量分数,实验采用下列步骤进行:①准确称量m g样品(在2~3g范围内);②向样品中加入10 mL 6mol·L-1的盐酸。再加入蒸馏水,配制成250 mL溶液;③量取25 mL操作②中所配的溶液,加入3 mL氯水,加热使其反应完全;④趁热迅速加入10%的氨水至过量,充分搅拌,使沉淀完全;⑤过滤,将沉淀洗涤后,灼烧、冷却、称重,并重复操作至恒重。若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,则样品中铁元素的质量分数为
A.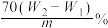 | B.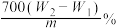 |
C.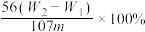 | D.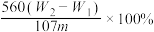 |
您最近一年使用:0次
2023-09-23更新
|
246次组卷
|
7卷引用:湖南省百校联盟2023-2024学年高三上学期9月一轮复习联考化学试题



